改良导管固定法在硬膜外阻滞大鼠模型构建中的应用
2012-02-03陈国忠刘小龙许秀艺王丽萍
周 波,陈国忠,,刘小龙,许秀艺,刘 韧,王丽萍
(1.福建医科大学福总临床医学院麻醉科,福州 350025;2.厦门市妇幼保健院麻醉科,厦门 361003; 3.南京军区福州总医院麻醉科,福州 350025)
硬膜外阻滞(epidural anesthesia)是临床上常用的麻醉方法,近年来研究发现硬膜外阻滞具有独特的选择性、节段性交感神经阻滞作用[1],在临床上引起日渐重视。其动物模型在冠心病、脑血管痉挛、急性胰腺炎、肠缺血再灌注等疾病的实验生理学、实验病理学和实验治疗学等方面具有广阔的应用前景[2-4]。然而硬膜外阻滞动物模型构建难度大、导管脱出率高、稳定性差[5],极大地制约了相关研究的深入开展。为了提高硬膜外置管的成功率和稳定性,本研究在国内外硬膜外阻滞模型研究基础上[5,6],对常用的单纯缝线环绕导管固定法进行技术改良,显著提高大鼠硬膜外阻滞模型的稳定性和成功率。
1 材料和方法
1.1 实验动物
清洁级雄性 W istar大鼠24只,体重290~330 g,来源于上海斯莱克实验动物有限责任公司【SCXK (沪)2007-0005】。实验在中国人民解放军南京军区福州总医院比较医学科完成【SYXK(军)2007-031】,实验前大鼠适应性喂养7 d,置管成功后单独饲养。
1.2 实验试剂和材料
氯胺酮注射液?(福建古田药业股份有限公司);咪唑安定注射液(江苏恩华药业股份有限公司),阿托品注射液,罗哌卡因(AstraZeneca AB瑞典),肝素,生理盐水;硬膜外导管(F2型,外径0.7 mm,常州迈创医疗器械有限公司),输液贴(威海威高富森医用材料有限公司),锥形侧孔注射针(规格:1.2* 33),硬膜外穿刺针,医用胶带(普通级,不透气)。
1.3 实验方法
1.3.1 实验分组
采用excel 2010软件对大鼠按体重排序,并利用其插入随机数字和排序的功能将所有大鼠随机分为实验组和对照组,每组12只。
1.3.2 改良硬膜外导管
将无菌输液贴剪成宽约2 mm的长条型,分别于距离导管置入端尖端2 cm、6 cm、15 cm处环形缠绕厚度约为1 mm的输液贴,分别命名为关卡1、关卡2、关卡3。管内预充50 U/m L肝素生理盐水。
1.3.3 硬膜外置管
术前大鼠禁食12 h,不禁水,腹腔内注射氯胺酮90 mg/kg、咪唑安定0.5 mg/kg、阿托品0.05 mg/kg混合液麻醉。以髋结节平第6腰椎(L6)棘突[7]为体表标志,向上定位第4腰椎(L4)棘突并用记号笔标记。颈部和背部剔毛,常规消毒铺巾。以L4棘突为中心行纵行切口切开背部皮肤,切口约为2 cm,切开表层肌肉,钝性分离棘突及椎板附着肌肉组织,暴露L3~L4棘突根部,轻提L3棘突,锥形针剥除少许L3~L4之间的韧带组织,随后向头侧置入硬膜外导管至2 cm处,反复行液体负压实验以避免导管置入硬膜下或蛛网膜下腔。
1.3.4 固定导管
实验组大鼠缝合肌肉同时用缝线环绕固定法将关卡1和关卡2固定于肌层,其中关卡1被包埋于肌组织内;随后用硬膜外穿刺针自后颈部做皮下隧道至切口处,引出硬膜外导管,缝合穿刺口将关卡3固定在皮下,在距离隧道口2 cm处剪断,用无菌医用胶带封闭导管;切口滴抹适量的金霉素眼膏,术后3 d每天肌注青霉素20万单位预防感染。
对照组导管不设计关卡,采用缝线环绕固定法在肌肉层固定2次、皮下隧道口处固定1次;在距离隧道口2 cm处剪去多余导管,连接临床常用硬膜外导管接头,再将接头缝合于颈后皮肤上,其余操作同实验组。
1.3.5 硬膜外给药
置管成功后第2天开始,每天硬膜外腔注射浓度为0.1%的罗哌卡因30 uL,持续28 d,给药方法:将大鼠置于固定架中,实验组撕去医用胶带后消毒、连接无菌硬膜外导管接头给药,注药完毕旋出接头、重新用胶带封闭导管;对照组按常规硬膜外导管接头给药。
1.3.6 观察指标
术后感染每天观察有无切口发红、发热、破裂和流脓等炎性指标,实验结束后解剖观察有无脓肿形成。
模型有效时间硬膜外腔注射罗哌卡因后,利用针刺法测定麻醉平面,若麻醉平面具有节段性,证明导管在硬膜外隙,模型有效;若无上述表现,或出现漏液、导管接头脱落等需通过再次手术修复者,宣告模型失效。累计观察28 d,记录模型失效的时间及数目。
硬膜外腔内导管深度实验结束后用放血法处死大鼠,咬开脊柱,测量并记录导管尖端至穿刺点的距离,如导管脱出,记为0 cm,测量方法见彩插3图1。
1.4 统计学分析
采用SPSS19.0统计软件包进行分析。感染率的比较采用卡方检验;模型有效时间的比较采用kap lan-meier法进行单因素生存分析,采用log-rank法进行检验;导管深度以均数±标准差(±s)表示,两组间的比较用近似t检验,其离散程度的比较采用方差齐性检验;P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
两组大鼠体重差异无统计学意义;大鼠硬膜外置管手术全程时长为20~30 min;实验组大鼠术中死亡1例,不纳入研究,对照组全部存活。
2.2 术后感染率
实验组术后出现2例感染(18.2%),对照组1例(8.3%),两组术后感染的发生率无明显差异(P>0.05)。
2.3 模型有效时间
28 d后,实验组11只大鼠仍有10只大鼠模型有效,有效率为90.9%;对照组12只仅有6只有效,有效率为50.0%,实验组大鼠模型的平均有效时间为26.2±1.7 d,对照组为18.5±3.0 d,经logrank检验实验组模型有效时间明显长于对照组(P<0.05)。(图2)。
2.4 硬膜外腔导管深度
对照组有1例导管脱出,实验组未出现。硬膜外导管长度值:实验组(1.81±0.07)与对照组(1.44±0.55)比,其均值和离散程度的差异均具有显著性(P<0.05),(图3)。
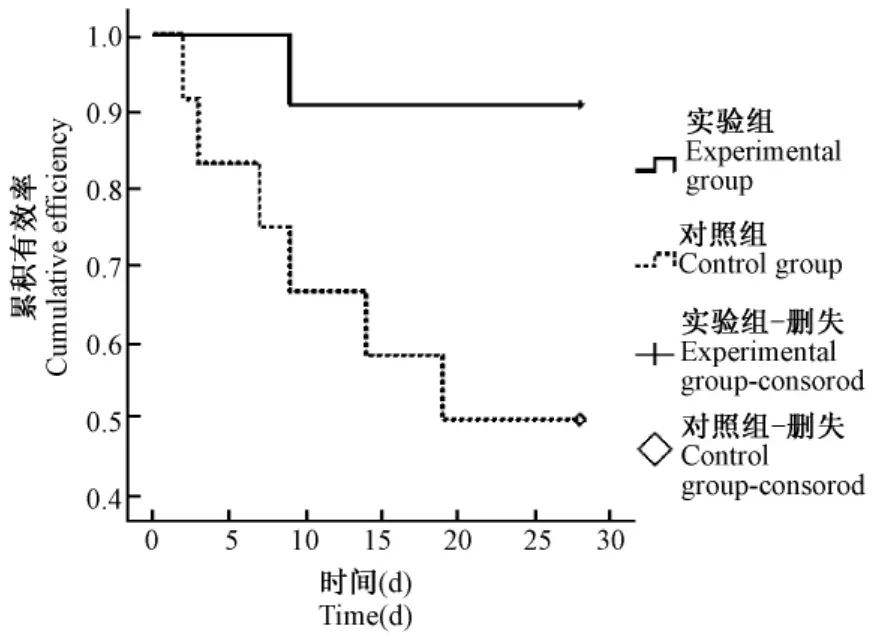
图2 两组间模型有效曲线的比较Fig.2 Comparison of effective time of themodel between two groups

图3 两组间导管深度的比较(±s)Fig.3 Comparison of the depth of epidural catheterbetween two groups(±s)
3 讨论
硬膜外阻滞大鼠模型构建过程中,固定导管、捉拿大鼠、注射药物等操作难免会牵拉导管,致导管在硬膜外腔活动或脱出,成为构建成功率高、稳定性好的硬膜外阻滞大鼠模型技术瓶颈。针对这一瓶颈制约,国内外学者进行了大量的技术改良应用研究,如毛晶晶等[8]用热熔将3根聚乙烯管(PE-20、PE-10、被拉长的PE-10)连接成外径逐渐变细的硬膜外导管,在导管上设置7个环形小,用于固定导管。此方法也可以有效的防止导管脱出,但导管本身的设计过程复杂,导管连接处容易出现漏口或闭塞。本研究直接选用F2型硬膜外导管、利用输液贴设计关卡,克服了前期相关研究的不足,操作简单方便,并能起到良好的固定作用。其中关卡1起主要固定作用,约束导管的前后活动,其他关卡则起缓冲作用。研究结果显示,实验组硬膜外腔内导管深度变化的离散程度远低于对照组,不仅降低了长期硬膜外阻滞模型的导管脱出率,而且使得置管的深度更具有均衡可比性。
传统硬膜外阻滞模型构建过程中通常采用导管接头连接导管后一起固定[5],虽然给药方便,却增加大鼠的不适感和负重感,使其不断对导管进行抓挠和撕咬,致导管容易被咬破、咬断、导管与接头脱离等,甚至导致模型在实验过程中失效。本研究摒弃了直接连接导管接头,而采用医用胶带封管,虽然给药时需撕去胶带,连接导管接头,给药完成后还需用胶带封闭,过程较对照组复杂,但减少了大鼠的负重感和不适感,并在大鼠抓挠异物时缺乏着力点,明显增加了硬膜外阻滞模型的有效时间。
本研究对照组采用输液贴体内固定,增加了大鼠体内外源性物质的植入,虽然可能导致大鼠术后感染及肉芽肿形成机率增加,但在术前充分准备、术中无菌操作、术后预防感染等措施积极干预下,两组大鼠术后感染发生率并无差异,应用改良硬膜外导管固定法构建动物模型感染率并无明显上升。
总之,改良硬膜外导管固定法可以显著提高单纯缝线环绕导管固定法构建硬膜外阻滞动物模型的成功率和模型间导管位置的稳定性,且安全性良好。如何应用该方法构建出持续泵注的硬膜外阻滞动物模型以克服当前分次给药的不足,从而维持稳定的硬膜外腔药物浓度和容量,还有待进一步研究。
[1]Clemente A,Carli F.The physiological effects of thoracic epidural anesthesia and analgesia on the cardiovascular,respiratory and gastrointestinal systems[J].Minerva Anestesiol,2008,74(10):549-563.
[2]Demirag A,Pastor CM,Morel P,et al.Epidural anaesthesia restores pancreatic microcirculation and decreases the severity of acute pancreatitis[J].World JGastroenterol,2006,12(6):915 -920.
[3]许秀艺,陈国忠,吴晓智,等.上胸段硬膜外阻滞对脑血管痉挛兔脑组织GR表达及血清炎性细胞因子含量的影响[J].中国临床神经外科杂志,2012,17(3):161-164.
[4]Bedirli N,Akyurek N,Kurtipek O,et al.Thoracic epidural bupivacaine attenuates inflammatory response,intestinal lipid peroxidation,oxidative injury,and mucosal apoptosis induced by mesenteric ischemia/reperfusion[J].Anesth Analg,2011,113(5):1226-1232.
[5]王庆祥,陈国忠,吴晓智.寰枢关节尾向置管建立上胸段硬膜外阻滞大鼠模型[J].中国比较医学杂志,2009,19(11):35-37.
[6]Schaper J,Ahmed R,Perschel FH,et al.Thoracic epidural anesthesia attenuates endotoxin-induced impairment of gastrointestinal organ perfusion[J].Anesthesiology,2010,113 (1):126-133.
[7]王增涛,郝丽文,李桂石,等.W istar大鼠解剖图谱[M].济南:山东科学技术出版社,2009:2-3.
[8]毛晶晶,马汉祥,熊祥生,等.大鼠蛛网膜下腔和硬膜外腔阻滞模型的建立[J].宁夏医学杂志,2011,33(10):973 -974.
