重组家蝇细胞色素P450 6A1的大肠杆菌对艾氏剂的生物降解作用
2012-02-03吴云华
吴云华,杨 帆
(中南民族大学生命科学学院,武汉430074)
艾氏剂是持久性有机污染物(POPs)之一,可引起人肝功能障碍、致癌[1].通过生物修复改善持久性有机污染物的环境污染是全球环境保护的研究热点[2].细胞色素 P450(cytochrome P450,CYP450)是一类依赖于氧气与NADPH催化内源性和外源性化合物代谢的酶.CYP450酶可通过羟基化、环氧化、脱烷基化和脱卤化氢等作用催化多种结构不同的物质,使许多类型化合物的化学性质发生变化,以解毒或降解POPs[3].近年来利用CYP450对污染物进行生物降解的研究有很大进展__[4],但对艾氏剂的生物降解未见报道.本研究以大肠杆菌为宿主表达家蝇细胞色素P450 6A1酶,研究CYP6A1酶及重组大肠杆菌对艾氏剂的生物降解能力.
1 材料和方法
1.1 材料
CYP450 6A1基因为本室家蝇克隆所得,表达载体PCW由美国Vanderbilt大学医学中心提供,载体上含有CPR(人细胞色素P450还原酶)基因.
限制性内切酶Nde I和Hin dⅢ,DNA聚合酶(LA Taq酶)和T4 DNA连接酶(Takara公司);氨苄青霉素(Amp)(上海生工生物工程有限公司);异丙基-β-D-硫代吡喃 半 乳糖苷(IPTG),δ-氨 基-γ-酮 戊酸(ALA)和二硫苏糖醇(DTT)(Alfa Aesar公司).
1.2 缓冲液的配制
2 ×TSE Buffer:将34.22g蔗糖和0.0372g EDTA·2Na溶于20mL,1mol/L的 Tris Buffer(pH7.6)过滤除菌.
磷酸缓冲液(spheroplast buffer):将0.1286g乙酸镁加少许水溶解后加20 mL甘油,1mol/L的K2HPO4和1mol/L的KH2PO4共10 mL,调pH为7.6,定容至100 mL.
1.3 CYP450 6A1-CPR原核表达载体的构建
将CYP6A1基因C末端原有SalⅠ酶切位点改为Hin dⅢ酶切位点,同时用Hin dⅢ单酶切CYP3A4 PCW载体,获得CPR基因片段(N端含有一段连接片段),再将CYP6A1基因和CPR基因连接在一起.(见图1).
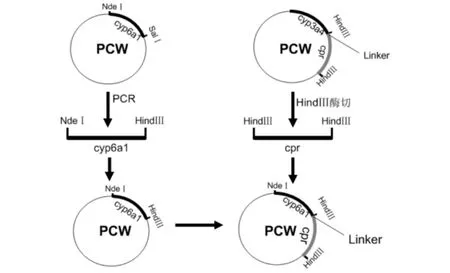
图1 pCW/CYP6A1-CPR载体构建流程图Fig.1 Construction of expression vector pCW/CYP6A1-CPR
CYP6A1 PCR扩增所用引物序列为:5'-AGCGACATATGGCTTTTGGTTCATTTCT-3'(上游),5'-GCCAAGCTTTTATTTAATTTTCTTTCTT-3'(下游).
1.4 蛋白诱导表达
将含有pCW空载体质粒和重组表达质粒pCW/CYP6A1和pCW/CYP6A1-CPR的大肠杆菌单菌落接种到5mL LB培养基,37℃培养过夜.取4mL菌液加至400mL新鲜含 50 ng/L Amp、1 mmol/L VB1和100μL微量元素的TB培养基中,培养约3h使其OD600值约0.6,加 IPTG 至终浓度为1mmol/L,同时加入33.6mg ALA,28℃诱导36h[5].
1.5 膜蛋白的提取
取50mL诱导的培养物,冰上放置30 min.4℃,2800g离心20 min,弃上清收集菌体,用10mL 2×TSE Buffer加等体积冷无菌水重悬.再加10mg溶菌酶,冰上轻摇30 min后,4℃,2800g离心20min,用16mL冰磷酸缓冲液重悬,加16μL DTT,置-70℃冻存过夜.冻存样品融化后于冰浴中超声破碎,4mL/次,每破碎5s间隔5s,共8min.取5mL破碎后混合物-80℃保存,其余于4℃,1.2 ×104g离心12min,取上清4℃,1.8 ×105g离心60 min,用4mL磷酸缓冲液重悬沉淀[6].
1.6 CYP6A1及CPR的活性测定
CYP6A1含量按Omura和Sato分光光度法测定.在2个比色杯中各加2mL P450测定液,再分别加入20μL待测样品和10μL连二亚硫酸钠,混匀,1min后于紫外分光光度仪上扫描基线,样品杯中通入CO约1min,稳定1min后于400~500 nm内扫描,得还原型细胞色素P450-CO复合物的吸收光谱图,记录A450和A490,按如下公式计算P450含量:

CPR活性测定按照Dignam方法[7]改良:分别吸取含0.05mmol/L细胞色素C的0.1mol/L磷酸缓冲液(pH 7.4)0.98mL、CPR 酶粗液 1 0μL,混匀后测A550,在样品池中加入5mmol/L NADPH 10μL,立即混匀后隔15s测定A5501次,连续测定3min.根据A550差值,按如下公式计算酶活力:

1.7 膜蛋白对艾氏剂的催化
根据CYP6A1及CPR的活性分别对其进行定量,在磷酸缓冲液中分别加入终浓度为50μmol/L CYP450膜蛋白和2,4,20,40μmol/L艾氏剂,再加入1.5mmol/L NADPH起始反应,总反应体积为0.5mL,37℃水浴15min后加入-20℃预冷的乙酸乙酯终止反应,以七氯作内标,用酯和正己烷(体积比1∶1)的混合液萃取若干次,蒸干,加入石油醚溶解,做GC-MS分析[8].色谱条件:DB-5MS毛细管柱(30m ×0.25mm ×0.25μm),He 载气(纯度 >99.999%),柱头压61.8kPa,载气恒线速度1.0mL/min,不分流进样1.0μL,进样口温度 0℃,检测器 300℃,气质接口250℃.色谱柱升温程序:50℃ (保持1min)→50℃(25℃ /min)→150℃(5℃ /min)→250℃ (20℃ /min)→250℃ (保持 5min)[9].
1.8 转基因大肠杆菌对艾氏剂的代谢
将活化的菌液按1∶100加至30mL LB培养液中,培养至 A600约为0.6,加入艾氏剂使其终浓度为5μmol/L,混匀后按2mL/2h取菌液进行萃取,共取8h.用旋转蒸发仪蒸干萃取样品后进行GC-MS分析.
2 结果及分析
2.1 载体构建
构建的CYP450载体用1.3中引物做PCR鉴定,CYP450-CPR载体用NdeⅠ内切酶和Hin dⅢ内切酶做双酶切鉴定,见图2.由图2可见,CYP6A1基因为1537bp,CPR基因为2034bp.2个载体均为阳性,测序结果正确.

图2 重组质粒鉴定图Fig.2 Identification of recombinant plasmid
2.2 原核蛋白诱导表达
原核蛋白电泳结果见图3.由图3可见,2种转基因大肠杆菌表达的蛋白与对照组(空载体)蛋白对比,可明显看到目的蛋白CYP6A1的表达,大小为58kDa.CPR蛋白由于表达量较低,SDS-PAGE无法检出.

图3 CYP6A1在不同重组菌表达的SDS-PAGE电泳图Fig.3 Characterization of expression of CYP6A1in different recombinant cells by SDS-PAGE
用CO差异光谱法测定CYP6A1蛋白含量,结果见图4.由图4可见,400~500nm扫描为最大吸收波长,ΔACYP6A1-CPR=0.029,ΔACYP6A1=0.024.根据公式(1)算得表达的CYP6A1在CYP6A1-CPR和CYP6A1宿主菌的含量分别为68.2nmol/g和50.05 nmol/g.时间扫描法测定CPR的酶活力,根据公式(2)算得8 nmoL/(min·mg).

图4 重组菌的CYP6A1及CPR表达量的测定Fig.4 Determination of the expressed amount of CYP6A1-CPR and CYP6A1 in recombinant E.coli cells
2.3 膜蛋白催化艾氏剂
用3种膜蛋白催化艾氏剂,仅有CYP6A1-CPR蛋白显示催化艾氏剂氧化的能力,氧化产物为狄氏剂,结果见图5.PCW空载宿主菌及CYP6A1宿主菌的膜蛋白与艾氏剂混合后未出现产物,而CYP6A1-CPR宿主菌的膜蛋白与艾氏剂混合后有明显的产物峰生成,结果见图6.
根据各浓度样品的狄氏剂产量及剩余的艾氏剂的量,由双倒数作图法可求得CYP6A1的米氏常数Km=46.1μmol/L.

图5 CYP6A1-CPR蛋白催化艾氏剂质谱分析图Fig.5 GC-MSprofiles of aldrin catalyzed by CYP6A1-CPR protein
2.4 转基因大肠杆菌对艾氏剂的代谢
将3种宿主菌活化,于对数生长期(A600分别为0.492,0.581,0.630)加入艾氏剂,取样 1 次/2h,萃取后进行GC-MS分析,并根据狄氏剂产量确定不同宿主菌对艾氏剂的代谢能力,结果见图7.

图7 不同菌液对艾氏剂代谢产物狄氏剂的生成量-时间变化图Fig.7 Time-amount changes of aldrin metabolites-dieldrin by different recombinant E.coli cells
由图7可见,CYP6A1宿主菌菌液培养2h未检测到到狄氏剂的生成,而4,6,8h后测得狄氏剂含量分别为1.40,3.50,7.57nmol/L;CYP6A1-CPR 宿主菌菌液培养2,4,6,8h后测得狄氏剂含量分别为3.39,10.52,127.76nM,163.36nmol/L.说明 PCW空载宿主菌无代谢艾氏剂的活性,CYP6A1宿主菌显示微弱的代谢活性,因大肠杆菌体内存在与CPR蛋白功能类似的递H+蛋白,而CYP6A1-CPR宿主菌显示较强的代谢活性.
3 结语
将家蝇体内提取得到的CYP6A1基因转入到大肠杆菌,由大肠杆菌大量表达CYP6A1蛋白,研究CYP6A1蛋白对艾氏剂的代谢能力,并在CYP6A1基因后面加入CPR基因,探讨CPR蛋白在CYP6A1蛋白对艾氏剂催化的过程中的作用.结果表明:CYP6A1蛋白对艾氏剂有环氧化作用,CPR蛋白在CYP6A1对艾氏剂催化的过程中起关键作用,CYP6A1-CPR宿主菌有一定的代谢艾氏剂的能力.

图6 代谢产物狄氏剂的二次离子质谱图(SIM)Fig.6 Detection ofmetabolism product dieldrin by SIM
[1]刘征涛.持久性有机污染物的主要特征和研究进展[J].环境科学研究,2005,18(3):93-102.
[2]Abhilash P C,Jamil S,Singh N.Transgenic plants for enhanced biodegradation and phytoremediation of organic xenobiotics[J].Biotechnol Adv,2009,27(4):474-488.
[3]任 彭,刘兆平.细胞色素P450研究概况及其应用[J].食品与药品,2006,8(10):8-13.
[4]Shinkyo R,Kamakura M,Ikushiro S,et al.Biodegradation of dioxins by recombinant Escherichia coli expressing rat CYP1A1 or its mutant[J].Appl Microbiol Biot,2006,72(3):584-590.
[5]Zhang L,Liu X,Wang C,et al.Expression,purification and direct eletrochemistry of cytochrome P450 6A1 from the house fly,Musca domestica[J].Protein Expr Purif,2010,71(1):74-78.
[6]Andersen J F,Utermohlen JG,Feyereisen R.Expression of house fly CYP6A1 and NADPH-cytochrome P450 reductase in Escherichia coli and reconstitution of an insecticide-metabolizing P450 system [J].Biochemistry,1994,33(8):2171-2177.
[7]阮仁余,孔建强,郑晓东,等.中国红豆杉细胞色素P450还原酶的基因克隆、表达与活性分析[J].遗传,2010,32(11):1187-1194.
[8]Wu Y H.Direct electrochemistry of cytochrome P450 6A1 in mimic bio-membrane and its application for pesticides sensing[J].Sensor Actuat B-Chem,2011,156(2):773-778.
[9]许 华,曹 红,蔡雪凤.茶叶中有机氯农药的质谱确证分析[J].分析测试学报,2004,23(z1):270-271.
