β-环糊精衍生物流动相添加剂应用于HPCE中分离布洛芬
2012-02-03沈静茹朱财延余学红韦慧慰邱思杨
沈静茹,朱财延,余学红,韦慧慰,邱思杨
(1中南民族大学化学与材料科学学院分析化学国家民委重点实验室,武汉430074;2中南民族大学校医院,武汉430074)
药物布洛芬(结构式见图1)在临床上多以其外消旋体广泛应用,具有活性的是S体,而R-体无活性[1],若以布洛芬的单一对映体给药对提高药效和降低潜在危害具有重要意义.布洛芬的分离分析方法包括萃取法[2]、高效液相色谱法[3,4]、高效毛细管电泳技术(HPCE)[5,6]以及联用技术[7]等,大多以构建手性分离环境实施.β-环糊精及其衍生物是常用的手性选择剂[8-11].前人以β-环糊精为手性选择剂,在贝克曼HPCE仪上较弱地部分分离布洛芬[9];或通过点击化学方法将环糊精键合到固定相中分离布洛芬,但分离度 Rs仅0.50[10];或利用带有4-二甲氨基-1,8-萘二甲酰亚胺官能团的环糊精衍生物通过开环反应制备手性整体柱,在HPCE条件下,12min内基线分离布洛芬,Rs达2.26,此法的缺点是制柱过程复杂[11].本文以双-[6-氧-(2-间羧基苯磺酰基-丁二酸单酯-4)]β-CD(β-CD-B2)为HPCE流动相手性添加剂,在硼砂缓冲液中分离布洛芬对映体,通过线性范围考察该分析方法和它与手性药物布比卡因的分离情况,为实现布洛芬单一对映体的分离分析提供条件.

图1 布洛芬的结构Fig.1 Stucture of ibuprofen
1 实验部分
1.1 仪器与试剂
高效毛细管电泳仪(P/ACE MDQ,美国BECKMAN公司),酸度计(pHs-3c型,上海伟业仪器厂),熔融石英毛细管(75μm,ID,河北省永年光纤厂),微孔滤膜(0.22μm,上海市新亚净化器件厂).
β-环糊精(β-CD)、马来酸酐、苯甲酸、丙酮、甲醇(国药集团化学试剂有限公司),氯磺酸(上海朝晖药业有限公司),布洛芬标样(含量99.5%,中国药品生物制品检定所),布洛芬片(江苏平光制药有限责任公司),超纯水和其他试剂均分析纯.
1.2 药品处理
将布洛芬溶于硼砂溶液作为样品;另将不同浓度β-CD-B2溶于缓冲液中,并按分离需要调节不同的pH值作为流动相.所有溶液均经0.22μm微孔滤膜过滤.
1.3 HPCE分析前处理
每次运行前先用水洗柱子3min,背景溶液洗3min.采用压力进样,0.5psi进样 5s,分离电压为25kV,检测波长为254nm,温度20℃.
1.4 β-CD-B2的合成
参照文献[12],首先将β-CD与马来酸酐合成中间体β-CD-A2,之后与间羧基苯磺酰氯合成目标产物 β-CD-B2.
2 结果与讨论
2.1 对比试验
在50mmol/L、pH8.0的硼砂缓冲液,其他条件同1.3,以纯硼砂缓冲液分离布洛芬;并分别以浓度均为5g/L 的 β-CD、β-CD-A2、β-CD-B2为HPCE 流动相添加剂分离布洛芬,结果见图2.
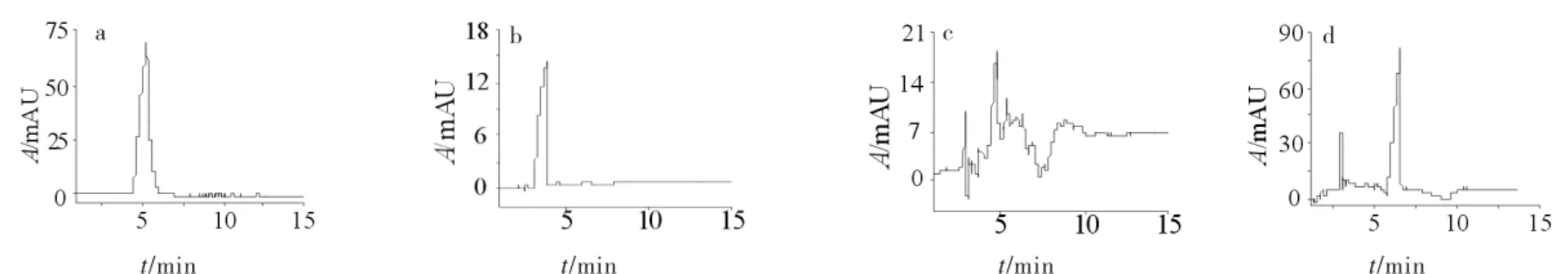
图2 加入不同手性添加剂时布洛芬的分离Fig.2 HPCE Separation of ibuprofen with different chiral additive
由图2可见,纯硼砂缓冲液和β-CD对布洛芬无手性分离迹象,且β-CD和β-CD-A2对药物的洗脱强度较弱;β-CD-A2对布洛芬异构体有分离迹象,因极性大对基线的影响较大且杂峰较多;β-CD-B2对布洛芬不仅洗脱强度大,且使手性异构体达到了基线分离.说明对β-环糊精进行官能团修饰后生成侧链带苯环的衍生物β-CD-B2,布洛芬结构中的苯环能与其产生腔体内包合作用和π-π共轭.且2个对映体分子中含羧基官能团与衍生物分子碳碳双键、羧基、磺酸基团等的氢键或共轭协同作用,使布洛芬两手性异构体与手性添加剂β-CD-B2的复合物在适宜的HPCE体系中产生足够电荷差异,实现布洛芬手性异构体的分离.
2.2 缓冲液pH值对手性分离布洛芬的影响
选取50mmol/L的硼砂缓冲溶液,β-CD-B2浓度为5g/L,其他条件同 1.3,改变缓冲液的 pH值(3.0,5.0,6.5,7.0,7.5,7.8,8.0,8.2,8.4,8.6,9.2,9.7,10.2),考察 pH 值对布洛芬对映体分离的影响,结果见图 3.由图 3 可知,pH5.0 ~9.2,布洛芬对映体均可达到基线分离.当缓冲液的pH<5.0时,布洛芬无分离迹象,且基线波动大;当缓冲液pH≥5.0时,布洛芬对映体达到基线分离;随着溶液pH的增大,后峰逐渐对称,pH=8.0时,两峰的对称性和基线均相对适宜,两峰的洗脱强度均较强,随后两峰对称性有所减弱,响应值也有所减小,即流动相洗脱强度减弱;当pH=9.7时,前峰消失,无法分离对映异构体.缓冲液酸度变化影响布洛芬两手性异构体与β-CD-B2复合物表面的电荷量,布洛芬酸离解常数pKa=4.3[13],故而在溶液pH大于布洛芬酸离解常数pKa的电场中,两对映体保留时间差异逐渐加大,峰的洗脱强度逐渐增强,对称性渐好,最终达到基线分离.故选取pH8.0为缓冲液的最佳分离pH值,最佳分离酸度范围为pH5.0~9.2.

图3 不同缓冲液pH下布洛芬的HPCE分离Fig.3 HPCE Separation of Ibuprofen under different pH buffer
2.3 硼砂缓冲液浓度对手性分离布洛芬的影响
在pH8.0的缓冲液中β-CD-B2浓度为5g/L,其他条件同 1.3,改变硼砂溶液浓度(20,30,40,50,60mmol/L)考察其对布洛芬的影响,结果见表1.由表1可见,硼砂缓冲液浓度在20~60mmol/L均可达到基线分离.当缓冲液浓度为20mmol/L时,后峰响应值较小,且有前伸现象;随着缓冲液浓度的增大,后峰的洗脱强度逐渐加强,当浓度为50mmol/L时达到最佳,且基线平稳,Rs达4.26;当浓度为60mmol/L时,分离效果与50mmol/L相当,Rs略有下降,故选择50mmol/L为分离布洛芬对映体的最佳硼砂缓冲液浓度.
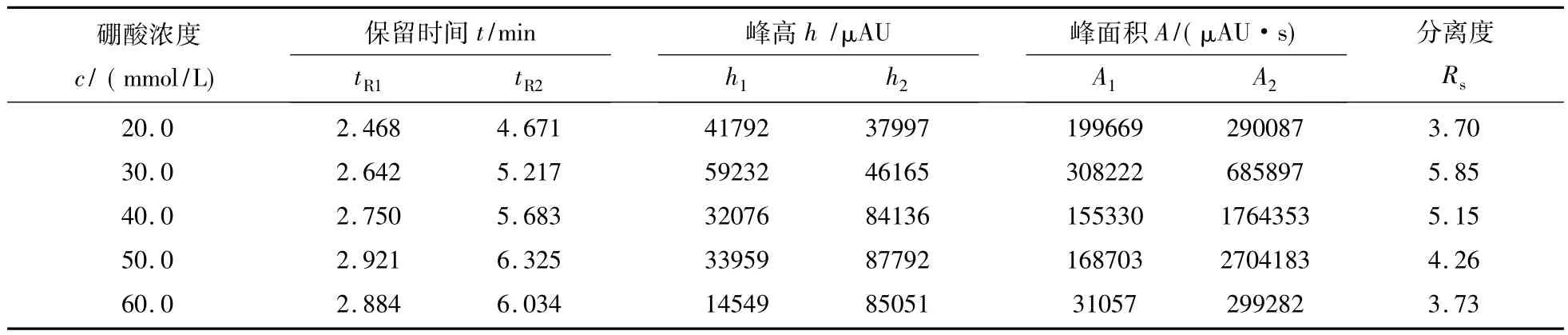
表1 不同缓冲液浓度下布洛芬的分离Tab.1 Separation of Ibuprofen under the bufferwith different concentration
2.4 β-CD-B2浓度对布洛芬分离的影响
在pH8.0的缓冲液中,其他条件同1.3,改变β-CD-B2浓度 ρ(2,3,4,5,6,7g/L),考察其对布洛芬分离的影响,结果见图4.由图4可见,当β-CD-B2存在时,布洛芬对映体Rs>2.5.当ρ=2g/L时,后峰洗脱强度大,前峰太小且基线波动大,两峰对称性较差;随着β-CD-B2的浓度增大,前峰洗脱强度增大,两峰对称性逐渐增强;当ρ=5g/L时,对称性及分离度均达到最佳;当ρ=6g/L(或7g/L)时 ,分离度均Rs≈4.0,几近平台.故选取 5g/L 的 β-CD-B2为分离布洛芬对映体的最佳流动相手性添加剂浓度.
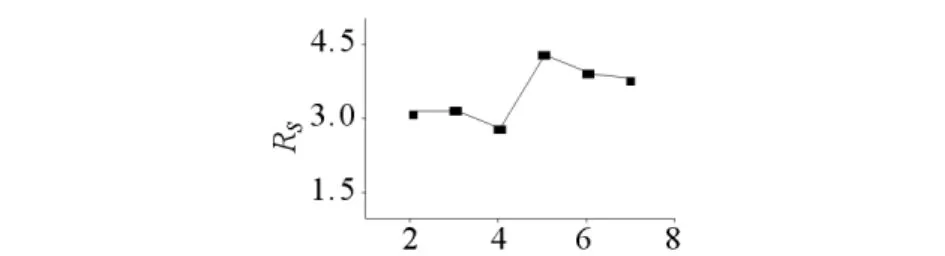
图4 不同手性添加剂用量对布洛芬分离的影响Fig.4 Separation of ibuprofen with different concentration of chiral additive
2.5 分离电压对布洛芬分离的影响
在pH8.0的缓冲液中 β-CD-B2浓度为5g/L,其他条件同 1.3,改变分离电压(10,15,20,25,30kV),考察其对布洛芬分离的影响,结果见图5.由图5可见,当分离电压为10kV(见图5a),两峰出现分裂现象,呈非线性,后峰出峰时间长,20min方完成;随着电压的升高,峰形逐渐对称,出峰时间缩短(见图5b,5c),25kV 时最佳,分离度为4.26;当分离电压为30kV(见图5d)也可分离,且分离时间缩短,但基线波动稍大.故选取25 kV为分离布洛芬对映体的最佳分离电压.
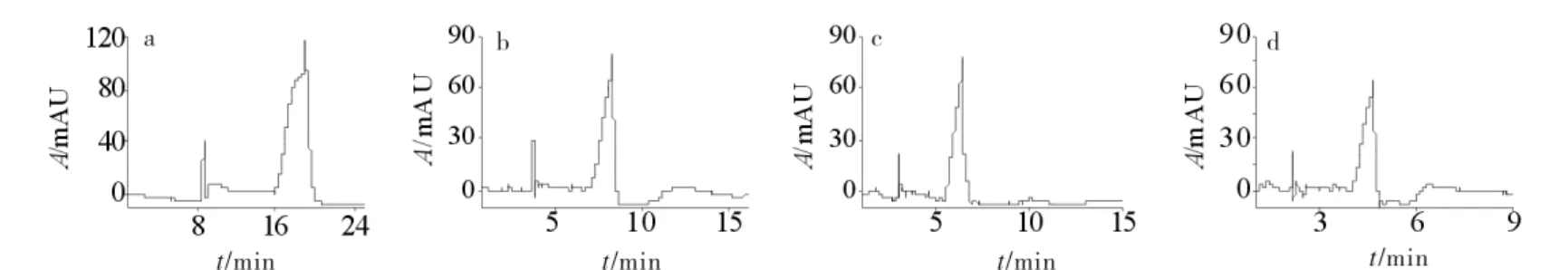
图5 不同电压下对布洛芬分离的影响Fig.5 Separation of ibuprofen under different voltage
2.6 线性范围
在最佳HPCE分离条件下(50mmol/L硼砂缓冲液,pH8.0,β-CD-B2浓度5g/L,进样量为 0.5psi,5s,分离电压25kV,检测波长254nm,分离温度20℃),以50mmol/L的硼砂为溶剂配制不同浓度的布洛芬标准品溶液,得到布洛芬对映体的电泳峰高、峰面积与浓度呈线性关系的结果见图6.其中,前峰出现于布洛芬浓度为0.053~0.942mg/mL范围内,峰高-浓度的标准曲线方程为:y=10049.62679+4834.93635x,相关系数 r=0.99564;峰面积-浓度的标准曲线方程为:y=87662.72919+43145.38656x,相关系数r=0.92265.后峰出现于布洛芬浓度为0.178 ~0.942mg/mL 范围内,峰高-浓度的标准曲线方程为:y=0.14698+9.78769 ×10-5x,相关系数 r=0.96836;峰面积-浓度的标准曲线方程为:y=0.27099+9.74608 ×10-7x ,相关系数 r=0.94263.由此可知,采用前峰的峰高-浓度可准确定量,相关系数r=0.99564.略高于文献气质联用的方法[7].
2.7 2种手性药物的分离
药物布比卡因[14]为长效局麻药,左旋体对中枢神经及心脏的毒性明显低于右旋体;布洛芬是抗炎镇痛药,若两者能同时使用并分离可达到同时监控外消旋体布比卡因和布洛芬两对映异构体的目的.制作模拟样,将布洛芬溶液与布比卡因溶液混合,前者浓度为后者浓度的2倍,在分离布洛芬的最佳条件下,同时分离布洛芬与布比卡因,结果见图6.经定性研究确认,同一分离电泳条件下,图6(a)中的峰1为布洛芬的一个对映体;峰2为布比卡因且与图6(b)中峰一致;峰3为布洛芬的另一个对映体.

图6 布洛芬与布比卡因HPCE分离图Fig.6 HPCE separation of ibuprofen and bupivacaine
3 结语
以 5g/L的 β-CD-B2为流动相添加剂,50mmol/L硼砂为缓冲液,pH8.0,分离电压 25kV,进样量0.5psi,5.0s,检测波长 254nm,温度 20℃,在HPCE中分离布洛芬对映体,8min内对映体基线分离,电泳峰对称性最佳Rs为4.26.布洛芬对映体分离的前峰线性范围为0.053~0.942g/L,后峰线性范围为0.178~0.942g/L.在分离布洛芬的最佳条件下,可同时分离布洛芬两对映异构体与布比卡因外消旋体的混合溶液.
[1]Jamali F,Mehvar R,Pasutto F M.Enantioselective aspects of drug action and disposition:therapeutic pitfalls[J].JPham Sci,1989,78(9):695-715.
[2]Tang Kewen,Zhang Panliang,Li Hongjian.Experimental and model study on themultiple chemical equilibrium for reactive extraction of ibuprofen enantiomerswith HP-β-CD as hydrophilic selector[J].Process Biochem,2011,46(9):1817-1824.
[3]Perera RW,Lough W J.Assessment of chiral stationary phases for suitability for combined enantiomeric impurity/related substances assays[J].J Chromatogr A,2011,1218(48):8655-8663.
[4]Zheng Chaonan,Hao Haiping,Wang Guangji,et al.Chiral separation of ibuprofen and chiral pharmacokinetics in healthy Chinese volunteers[J].Eur JDrug Metab Ph,2008,33(1):45-51.
[5]Hsu C H,Cheng Y J,Singco B,et al.Analyses of nonsteroidal anti-inflammatory drugs by on-line concentration capillary electrochromatography using poly(stearyl methacrylate-divinylbenzene)monolithic columns[J].J Chromatogr A,2011,1218(2):350-358.
[6]Prokhorovaa A F,Shapovalovaa EN,Shpaka A V,etal.Enantiorecognition of profens by capillary electrophoresis using a novel chiral selector eremomycin [J]. J Chromatogr A,2009,1216(17):3674-3677.
[7]Hashim N H,Khan S J.Enantioselective analysis of ibuprofen,ketoprofen and naproxen in wastewater and environmental water samples[J].J Chromatogr A,2011,1218(29):4746-4754.
[8]Zhang Changqiao,Zhu Chenfu,Lin Xiuli.Enantiomeric sepatation of primaquine ,an anti-malarial drug,by cyclodextrin-modified micellar clectrokinetic capillary chromatography[J].Anal Sci,2002,18(5):595-597.
[9]Reijenga JC,Ingelse B A,Everaerts FM.Thermodynamics of chiral selectivity in capillary electrophoresis:separation of ibuprofen enantiomers with β-cyclodextrin[J].J Chromatogr A,1997,792(I-2):371-378.
[10]Wang Huaisong,Jiang Ping,Zhang Min,et al.Synthesis of a novel restricted access chiral stationary phase based on atom transfer radical polymerization and click chemistry for the analysis of chiral drugs in biological matrices[J].J Chromatogr A,2011,1218(9):1310-1313.
[11]Tian Y,Zhong C,Fu E,et al.Novel beta-cyclodextrin derivative functionalized polymethacrylate-based monolithic columns for enantioselective separation of ibuprofen and naproxen enantiomers in capillary electrochromatography[J].J Chromatogr A,2009,1216(6):1000-1007.
[12]雷双双,杨 曦,沈静茹,等.新型β-环糊精衍生物在高效毛细管电泳分离扁桃酸中的应用[J].中南民族大学学报:自然科学版,2008,27(1):30-33.
[13]Cabot JM ,Fuguet E ,Ràfols C,et al.Fast highthroughput method for the determination of acidity constants by capillary electrophoresis II:acidic internal standards[J].J Chromatogr A,2010,1217(52):8340-8345.
[14]Tahraoui A,Watson D G,Skellern G G,et al.Comparative study of the determination of bupivacaine in human plasma by gas chromatography-mass spectrometry and high-performance liquid chromatography[J].J Pharm Biomed Anal,1996,15(2):251-257.
