帕金森病患者脑灰质变化的VBM-MRI研究☆
2012-02-01郭黎史长征胡艳彭子文杨柳徐安定
郭黎 史长征 胡艳⊙ 彭子文 杨柳△ 徐安定
帕金森病患者脑灰质变化的VBM-MRI研究☆
郭黎*史长征**胡艳**⊙彭子文▲杨柳*△徐安定*
目的 应用核磁共振的基于体素形态学 (voxel-based morphometry method ofmagnetic resonance imaging,VBM-MRI)技术,研究帕金森病(Parkinson disease,PD)患者大脑灰质变化的状况。方法 28例PD组与年龄、受教育年限相匹配32例健康对照组的VBM-MRI图像数据进行比较,PD组中,早期PD组(early Parkinson disease,EPD, n=14)与晚期 PD 组((late Parkinson disease, LPD, n=14)的 VBM-MRI图像数据进行比较。结果 与健康对照组比较,VBM-MRI显示PD组患者存在下列脑区灰质体积减少:额叶(双侧额上回、左额下回)、双侧颞叶(颞上回、颞中回)、右侧扣带回、右侧丘脑、双侧尾状核及左顶下小叶。与EPD比较,VBM-MRI显示LPD在下列脑区存在灰质体积减少:额叶(双侧额上回、右侧额下回、右侧额叶眶部、双侧内侧前额叶),颞叶(右侧颞上回、左侧颞中回),右侧海马旁回、右侧尾状核、右侧下丘脑,差异均有显著统计学意义。结论 本组PD患者的脑灰质改变,主要集中在额叶、颞叶、右侧扣带回及皮质下的灰质。随着PD病程进展,这些部位的灰质减少加剧,并在边缘叶有进展的趋势。
帕金森病 灰质 核磁共振成像 基于体素的形态学
帕金森病(Parkinson disease,PD)是一种在中老年人发生的进行性变性疾病,一般病程10年以上可能发生痴呆样症状,即帕金森病痴呆(Parkinson diseasewith dementia ,PDD)[1]。 在几个的交叉研究报告中,PDD发病率是40%[2],是健康人群的6倍。但是,有关PD(特别是伴有认知障碍)的大脑结构改变的临床研究并不充分。在PDD死后尸检研究中,病理发现是边缘叶及大脑皮质的路易体样变性及程度不同的阿尔茨海默病型变化[3-7]。近年来,应用核磁共振基于体素的形态学(voxelbased morphometry method of magnetic res onance imaging,VBM-MRI)技术做结构影像学的研究,为脑器质性疾病的结构研究提供了一个新的重要手段[8-9],已经显示在 PD 及 PDD 患者的皮质及皮质下区域的脑灰质体积变化的研究中[10]。相比以前PD患者的MRI研究是基于视觉检查或是感兴趣区域(region of interest,ROI)的方法,自动、无偏差的VBM-MRI使得研究者在一个独立的环境下分析全脑的变化,更为便利、准确地研究PD,特别是 PDD的发病机制[10]。本研究应用VBM技术,研究一组PD患者脑灰质变化的状况。
1 资料与方法
1.1 研究对象 收集2010年3月至2011年1月于暨南大学附属第一医院神经内科住院及门诊部就诊的PD患者,入组标准:①按照2006中国PD的诊断标准[11];②签署知情同意书。 排除标准:①各种原因导致的帕金森综合征及帕金森叠加综合征;②晚期的PD患者,不能耐受核磁共振检查;③目前合并其他严重躯体疾病;④所有患者在本次检查前不曾接受帕金森病手术治疗。共计PD患者28例,男18例,女10例,年龄55~83岁,平均(69.6 ± 8.9)岁,病期 1~ 18年,平均(4.9 ± 3.8)年;受教育年限 3~ 19年,平均(10.5 ± 4.4)年。PD组神经心理学检测: 蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)7~ 30 分,平均(19.8 ± 6.3)分;汉密尔顿抑郁量表评分(Hamilton depression scale,HMAD)2~ 29 分,平均(15.8 ±8.0)分;统一帕金森病评分量表-运动检查(unified Parkinson’s disease rating scale,UPDRS-Ⅲ)[12]为(6~ 61)分,平均(26.5 ± 13.4)分。 另外,PD 组还做了简易精神状态检查量表 (mini-mental state examination,MMSE)的检查。 PD组的人口统计学及临床资料见表1。以Hoehn&Yahr修正分期量表[12]将患者分期:结果PD组包含1期4例,2期10例,3 期 12 例,4 期 2 例,参考相关文献[13-14]并根据本研究病例组的具体情况,将≤2.5期归为EPD,共 14例(男 9例,女 5例),≥3.0期归为 LPD,共14例(男9例,女5例)。EPD和LPD的人口学及临床资料特点见表2。
通过招募,纳入年龄和受教育程度与PD组相匹配的健康志愿者为健康对照组,共计32例,男12例,女20例,无精神疾患及明显脑的器质性疾患,年龄 50~ 80 岁,平均(69.6 ± 8.9)岁,受教育程度 0~ 26年,平均(10.7 ± 5.1)年。 HAMD5~ 18分,平均(10.4 ± 3.7)分。 所有受检者在参与实验前均被告知相关事宜并取得受检者同意,PD组与健康对照组在年龄、受教育年限的差异无统计学意义(t= 1.484, P = 0.142; t= 0.204, P = 0.839)。 本研究经本院伦理委员会的审核批准。
1.2 研究方法
1.2.1 磁共振成像 成像设备为美国 GE 1.5T Signa HD MR 扫描仪,梯度场强 23mT·m-1,梯度切换率为 120mT·m-1·ms-1, 采用头颈 8 通道相控阵线圈作为发射和接受线圈,所有研究对象双耳塞上适当大小棉球以减少噪音的影响,线圈覆盖被检查者头部,头部尽量摆正并用海绵垫固定两侧。以听眦线为基线精确定位,T1像采用三维扰相梯度回波序列 (3 demension-spoiled gradient recalled echo,3D-SPGR)进行图像采集,扫描范围覆盖全脑,扫描参数:TR 8.6ms,TE 2.0ms,TI 350ms, 层厚 1.4mm,层间距-0.7 mm,矩阵 256 × 256,激励次数:2。所有扫描均由同一名影像科医师操作完成。
1.2.2 影像数据处理与统计分析 使用MRIcroN软件对获取的图像进行预处理,将所得结构图像利用SPM8及VBM8软件在Matlab6.5上进行标准化。然后对标准后的图像进行分割及平滑,并对平滑后的灰质结果进行统计分析。采用双样本t检验的方法进行组间比较,统计阈值取0.05(FDR校正),20个以上的体素集合才被视为有统计学意义的差异脑区。将t检验结果叠加到T1结构像的模板上,结果由MRIcroN软件呈现。
PD组与健康对照组,PD组中的EPD与LPD的性别、年龄构成、受教育年限、MoCA、MMSE、HMAD、及UPDRS-Ⅲ的数值均以±s表示,利用SPSS 11.0软件进行分析,分别采用卡方检验、两样本t检验及秩和检验,检验水准α=0.05。
2 结果
2.1 M oCA、MMSE、HAMD 及 UPDRS-Ⅲ的比较
与健康对照组比较,PD组的MoCA得分有显著降低 (P < 0.001)、HAMD 得分有显著升高 (P <0.01),提示PD组有显著的认知功能损害和抑郁症,但在年龄、受教育年限无统计学差异。与EPD比较,LPD 病期长 (P < 0.01)、UPDRS-Ⅲ分值高(P< 0.001),Hoehn & Yahr分 期 显 著 高 级 数 (P <0.001),提示随着病期延长,LPD运动方面的残疾加重,而两组在年龄、MoCA、MMSE及HAMD无统计学差异(表 1,2)。
2.2 VBM-MRI参数的比较 与健康对照组比较,VBM-MRI显示PD组患者存在下列脑区灰质体积减少:额叶(双侧额上回、左额下回)、双侧颞叶(颞上回、颞中回)、右侧扣带回、右侧丘脑、双侧尾状核及顶下小叶 (小体积校正后P均 <0.05)(见表 3、4,图 1)。

表1 PD组和健康对照组的人口学特点及临床资料

表2 早期PD组和晚期PD组的人口学特点及临床资料
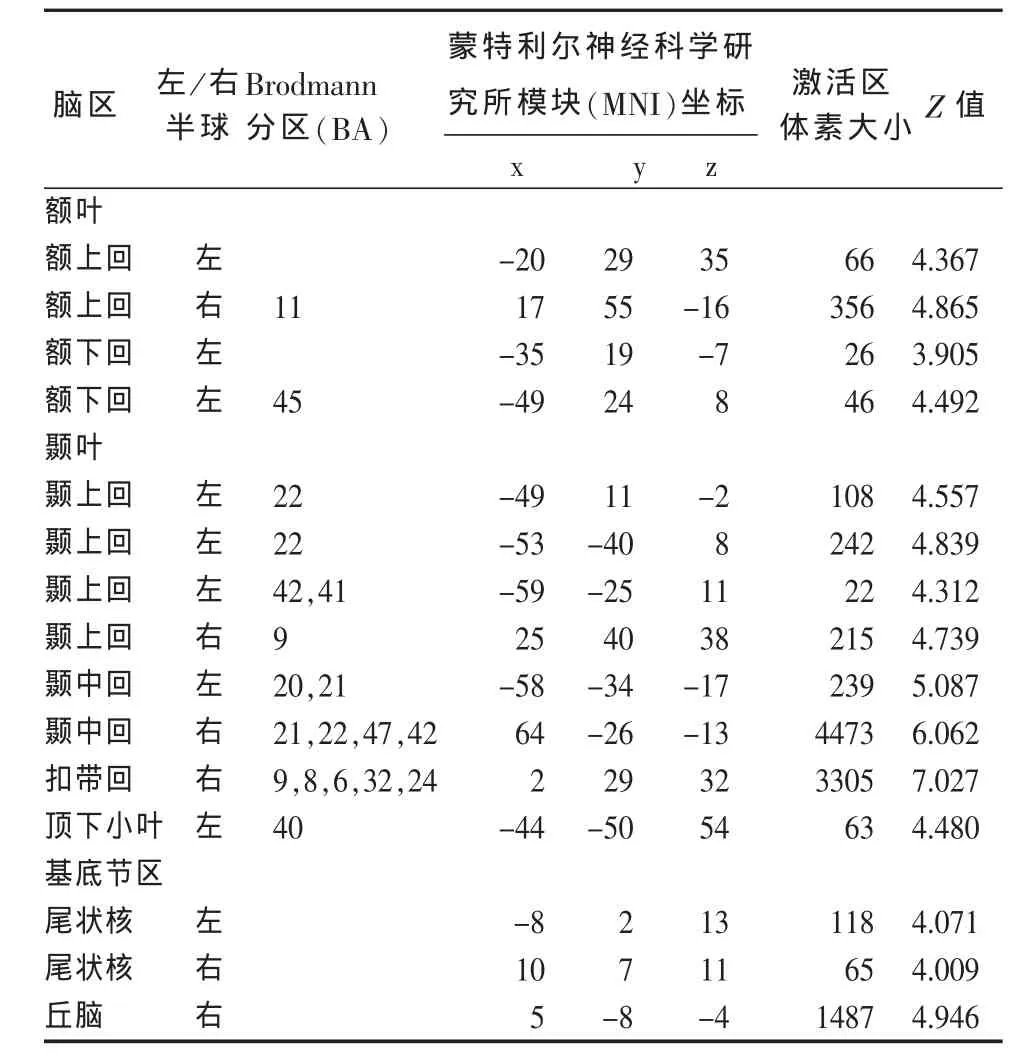
表3 PD患者组比健康对照组灰质体积减少的脑区
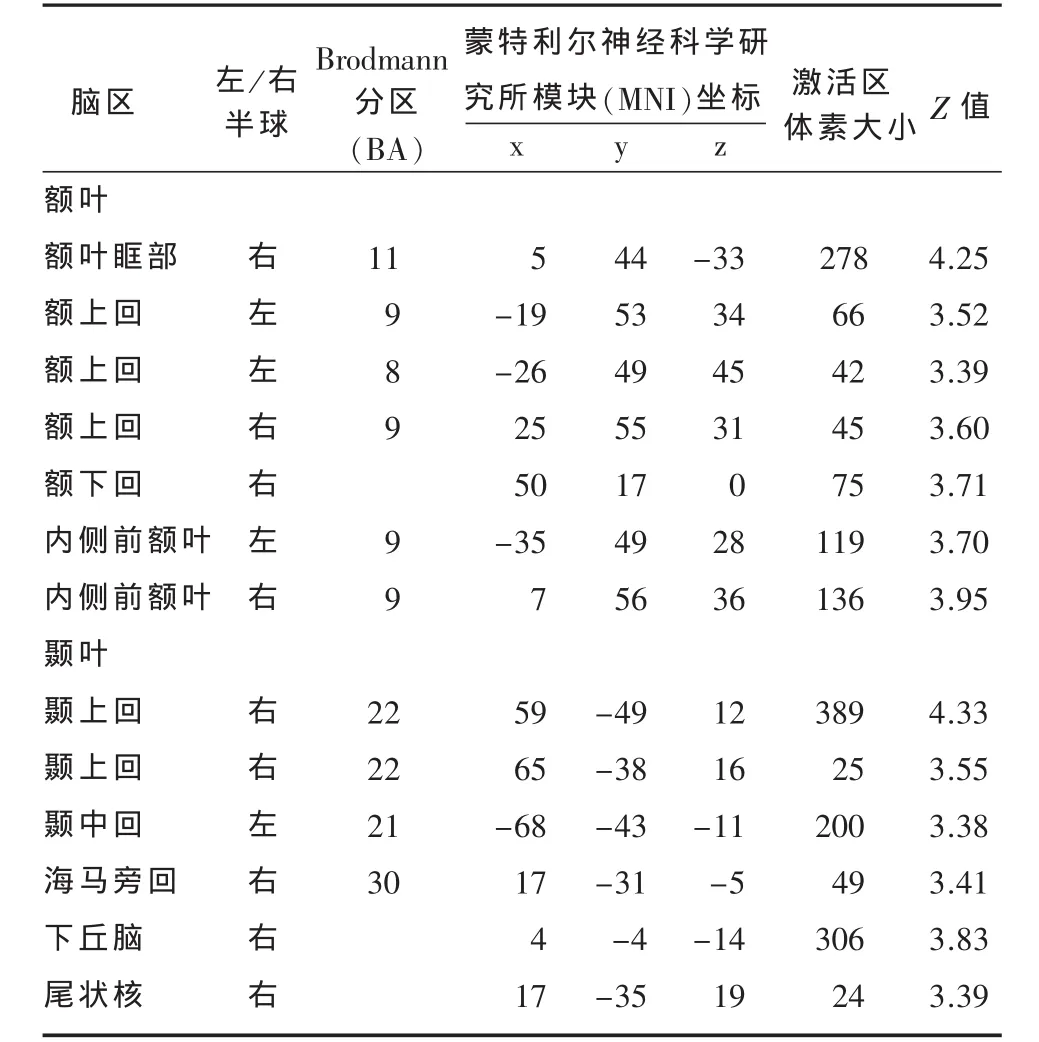
表4 晚期PD组比早期PD组灰质体积减少的脑区
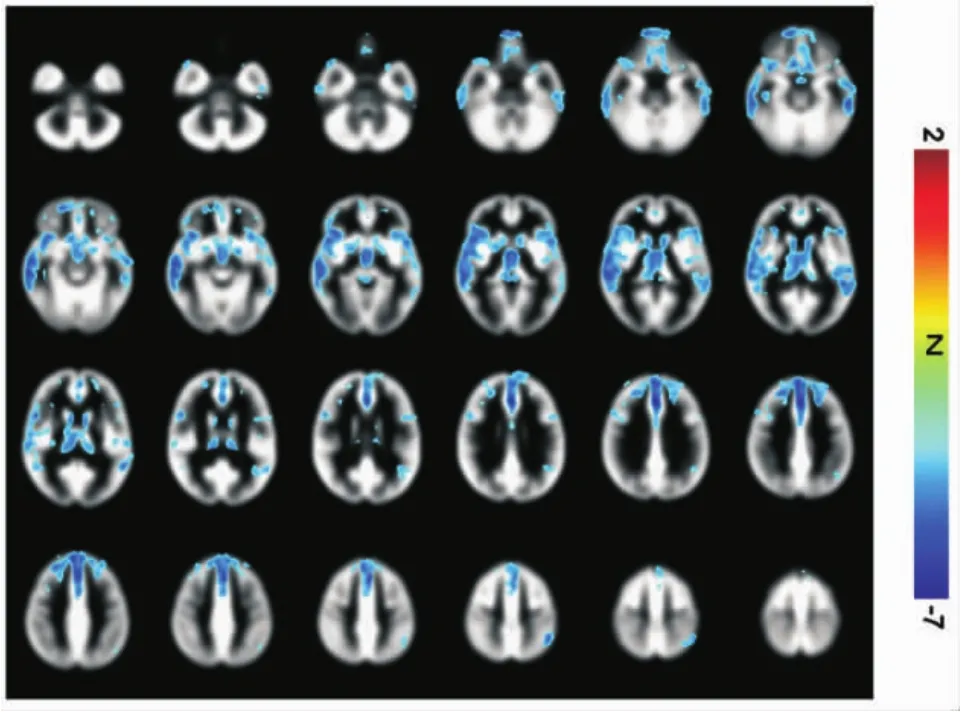
图1 PD组比健康对照组灰质体积减少的脑区的统计参数图
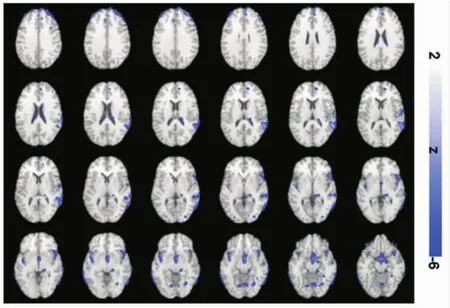
图2 LPD比EPD灰质体积减少的脑区的统计参数图
与EPD比较,VBM-MRI显示LPD在下列脑区存在灰质体积显著减少:额叶(双侧额上回、右侧额下回、右侧额叶眶部、双侧内侧前额叶),颞叶(右侧颞上回、左侧颞中回),右侧海马旁回、右侧尾状核、右侧下丘脑。(小体积未校正后P均<0.001)(见表 4, 图 2)。
3 讨论
VBM技术是以图像中的体素(voxel)为基本单位,基于统计参数图软件SPM自动化地对大脑形态进行客观分析的技术。该方法通过定量计算分析MRI图形中每一个体素的脑灰质及脑白质体积变化,对全脑的解剖结构差异进行评价。与以往ROI分析方法比较,VBM具有以下优点:客观性强,可重复性好,操作简单,易于临床推广[8]。但也有认为它有限的空间分辨率和不充分组织分层的准确性可能影响皮层下结构的探测[15]。
根据MoCA、HAMD量表,较健康对照组,PD患者组有显著的认知功能损害及抑郁症。但是,根据Hoehn&Yahr分期,虽然病期上有显著差异,但是MoCA、MMSE在早期、晚期两组中差别不显著,可能与LPD患者的病期仍未达到帕金森病痴呆的高发时期(病程10年以后)[16]及样本量较小有关。
PD组的大脑灰质在额叶、颞叶及扣带回(前部)体积减少最显著,这与有关文献报道相一致[10,15]。 额叶灰质容积的减少与PD患者的执行功能异常有关,并且是PD的较早期变化[17]。而扣带回前部参与许多复杂的躯体和内脏运动功能和疼痛反应,可能与帕金森病的淡漠及抑郁症状有关[18-20]。依照 MMSE的标准,PD组包括了18例认知正常者,10例认知功能损害者,其中5例达到了初筛PDD的标准,因此,PD组是一个认知功能正常为主的混合状态。
与EPD比较、LPD患者额叶、颞叶灰质体积减少的状况继续进展。本研究中LPD出现了海马旁回Brodmann 30脑灰质的体积减少,提示LPD脑灰质病变向边缘叶扩展的趋势。类似研究中未见以Hoehn-Yahr分期作为分组的依据,而是主要以是否伴有认知障碍为分组依据。如果患者的病程延长,LPD达到痴呆的例数可能会显著增加[16]。因此,颞叶、顶叶、枕叶及边缘叶的灰质体积减少更多可能在病期较长的患者中,特别是PDD的患者中[6,10]。另外, PD 的非运动症状,例如抑郁症,也可能影响到脑两侧眶额叶、右颞叶及边缘叶的灰质体积减少[21]。
本研究仅是一个横断面的研究,样本量较小,达到痴呆标准的例数较少,难以作出PD病例认知障碍的分层分析。将来可做进一步扩大样本量,增加神经心理学的研究。另外,正电子发射型计算机断层显像(PET)是反映脑代谢水平的活体检测,与VBM-MRI的研究相结合,更能反映PD患者大脑功能与形态的变化。
[1]Johansen KK, White LR, Sando S, et al. Biomarkers:Parkinson disease with dementia and dementia with Lewy bodies[J].Parkinsonism & Related Disorders, 2010,16(5):307-315.
[2]Chaudhuri KR,Healy DG,Schapira AHV.Non-motor symptoms of Parkinson's disease: diagnosis and management[J].The Lancet Neurology, 2006,5(3):235-245.
[3]Apaydin H,Ahlskog JE,Parisi JE,et al.Parkinson disease neuropathology:Later developing dementia and loss of the levodopa response[J].Arch Neuro,.2002,59:102-112.
[4]Hurtig HI, Trojanowski JQ, Galvin J, et al.Alpha-synucleincortical Lewy bodies correlate with dementia in Parkinson’s disease[J].Neurology, 2000,54(10):1916-1921.
[5]Matsuda H,Kitayama N,Ohnishi T,et al.Longitudinal evaluation of both morphologic and functional changes in the same individuals with Alzheimer’s disease[J].Nucl Med, 2002,43(3):304-311.
[6]Burn DJ. Cortical Lewy body disease and Parkinson's disease dementia[J].Current Opinion in Neurology, 2006,19(6):572-579.
[7]De Vos RA, Jansen EN, Stam FC, et al.Lewy body disease’: clinico-pathological correlations in 18 consecutive cases of Parkinson’s disease with and without dementia [J]. Clin Neurol Neurosurg, 1995,97(1):13-22.
[8]Good CD, Johnsrude IS, Ashburner J, et al.A Voxel-Based Morphometric Study of Ageing in 465 Normal Adult Human Brains[J].NeuroImage, 2001,14(1):21-36.
[9]Pavese N, Brooks DJ.Imaging neurodegeneration in Parkinson's disease[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2009,1792(7):722-729.
[10]Burton EJ, McKeith IG, Burn DJ, et al.Cerebral atrophy in Parkinson’s disease with and without dementia: a comparison with Alzheimer’s disease, dementia with Lewy bodies and controls[J].Brain, 2004,127(4):791-800.
[11]中华医学会神经病学分会运动障碍及帕金森病学组.帕 金森病的诊断[J]. 中华神经科杂志, 2006,39(6):408-409.
[12]陈海波,王新德.统一帕金森病评定量表[J].中华老年医学杂志, 1999,18(1):61-62.
[13]Zhao YJ, Wee HL, Au WL, et al.Selegiline use is associated with a slower progression in early Parkinson's disease as evaluated by Hoehn and Yahr Stage transition times[J]. Parkinsonism Relat Disord, 2011,17(3):194-197.
[14]Qin Z, Zhang L, Sun F, et al.Health related quality of life in early Parkinson's disease: impact of motor and non-motor symptoms, results from Chinese levodopa exposed cohort[J].Parkinsonism Relat Disord, 2009,15(10):767-771.
[15]Nishio Y,Hirayama K,Takeda A,et al.Corticolimbic gray matter loss in Parkinson’s disease without dementia[J].European Journal of Neurology, 2010,17(8):1090-1097.
[16]Ramírez-Ruiz B, MartíMJ, Tolosa E, et al.Longitudinal evaluation of cerebral morphological changes in Parkinson's disease with and without dementia[J].Journal of Neurology,2005,252(11):1345-1352.
[17]Borghammer P, Østergaard K ,Cumming P,et al.A deformation-based morphometry study of patients with early-stage Parkinson’s disease[J].European Journal of Neurology, 2010,17(2):314-320.
[18]吴敏范,滕国玺.扣带回的形态结构[J].解剖科学进展,2000,6(4):329-331.
[19]郭玉璞,王维治.神经病学[M].人民卫生出版社,2006,1:327.
[20]Matsui H,Nishinaka K,Oda M,et al.Depression in Parkinson's disease.Diffusion tensor imaging study [J].J.Neurol,2007,254(9):1170-1173.
[21]Feldmann A, Illes Z, Kosztolanyi P, et al.Morphometric changes of gray matter in Parkinson's disease with depression:A voxel'based morphometry study[J].Movement Disorders,2008,23(1):42-46
Voxel-based morphometry MRIstudy of graymatter change in patientswith Parkinson’s disease.
GUO Li,SHIChangzhen, HU Yan, PENG Ziwen, YANG Liu, XU Anding.Department of Neurology, the First Affiliated Hospital of Jinan University, Huangpu AvenueWest 613, Tianhe Distract, Guangzhou 510630, China.Tel: 020-38688637.
ObjectiveTo delineate the gray matter changes of Parkinson’s disease(PD) patients applied by voxel-based morphometrymethod (VBM) of magnetic resonance imaging (MRI).Methodsof the regional graymatter volume was studied using voxel-based morphometry in 28 PD patients including 14 early stage PD (EPD) and 14 late stage PD (LPD) and 32 age-and education-matched controls.ResultsCompared with normal controls, PD patients had significant reductions of the gray matter volume in the frontal lobe (bilateral superior frontal gyrus, left inferior frontal gyrus), bilateral temporal lobes (superior temporal gyrus, middle temporal gyrus), right cingulated gyrus, right thalamus, bilateral caudate nucleus, and left inferior parietal lobe.Compared with EPD, LPD had significant reductions of gray matter volume in the frontal lobe(bilateral superior frontal gyrus, right inferior frontal gyrus, right orbitofrontal cortex and bilateralmedial anterior frontal lobe), temporal lobe (right superior temporal gyrus, leftmiddle temporal gyrus),right parahippocampal gyrus, right caudate nucleus and right hypothalamus.ConclusionPD patients have significant reductions of the graymatter volumemainly in the frontal lobe, temporal lobe, right cingulate gyrus and subcortical graymatter.With the progression of PD,the reductions of graymatter volume increase in these regions and expend to the limbic system.
Parkinson’s disease Gray matter Magnetic resonance imaging Voxel-based morphometry
(E-mail:tguoli@jnu.edu.cn)
R742.5
A
10.3969 /j.issn.1002-0152.2012.06.004
☆ 广东省医学科学基金项目(编号:A2009358)
* 暨南大学附属第一医院神经内科(广州 510630)
△ 湖南省湘南学院附属医院神经内科
** 暨南大学附属第一医院影像中心
⊙ 湖南省宁乡县人民医院CT室
▲ 中山大学公共卫生学院,现在广州市中小学保健所
2011-12-13)
李立)
·论 著·
