醇析法结合离子交换法提取分离卵转铁蛋白
2012-01-28张晴晴侯惠静刘爱国张佳慧帖航吴子健
张晴晴,侯惠静,刘爱国,张佳慧,帖航,吴子健
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
卵转铁蛋白(Ovotransferrin,OVT)又称副卵白蛋白或卵伴白蛋白,是禽蛋清中一种含686 个氨基酸残基的单肽链糖蛋白,其约占鸡蛋蛋清蛋白总量的12%。该蛋白分子质量为78 ku~80 ku,pI 为6.0,天然状态下,其分子中所含的半胱氨酸残基均参与形成稳定蛋白结构的二硫键,总共有15 个二硫桥键[1]。可结合铁、铜、锌等金属离子,具抗细菌、抗真菌、抗病毒活性以及提高免疫力等生理功能。在制药工业和食品工业极具有广泛的应用前景。
目前国内外用于提取制备卵转铁蛋白方法有盐沉淀法、膜分离技术法、阴阳离子树脂交换法以及乙醇析出法,但提取蛋白的纯度较低;也有固定化金属螯合亲和色谱法产量虽有所提高,但过程较为复杂,且产量也较低。本文主要研究醇析法结合弱酸性阳离子交换法提取分离卵转铁蛋白的工艺条件,目的在于既提高卵转铁蛋白制备的产量,又有效提高产品的纯度。
1 材料与方法
1.1 卵转铁蛋白制备工艺路线
原蛋清→蛋清预处理→两步醇析→两步弱酸性阳离子层析→透析除盐→冷冻干燥→产品
1.2 材料及仪器
新鲜鸡蛋:超市购买;其他试剂均为国产分析纯;3-18K 低温高速离心机:德国Sigma 公司;FDU-810 型EYELA 冷冻干燥机:日本东京理化公司;JY-SCZ2+型电泳槽、JY600 型电泳仪:北京君意东方电泳设备有限公司;WFZ800-D3B 紫外可见分光光度计:北京瑞利分析仪器公司;AUW120D 电子天平:SHIMADZU 公司;Bio-rad 凝胶电泳成像仪:bio-rad laboratories-Segrate Milan ltaly。
1.3 方法
1.3.1 蛋白质浓度的测定[2]
采用考马斯亮蓝法测定所提取样品的蛋白质浓度。
1.3.2 蛋白质的SDS-PAGE 电泳[3]
SDS-PAGE 电泳检测蛋白质样品条件:12%的分离胶和5 %的浓缩胶,上样量10 μL,蛋白质浓度为1 mg/mL,200 V 恒压电泳1 h。
1.3.3 蛋清的预处理[4-5]
蛋清预处理参照2001年Thomas Croguennec 等和2005年C Guérin-Dubiard 等的方法并稍加改进。取新鲜鸡蛋,手工分离得到蛋清,加入3 倍去离子水混匀稀释,6 层纱布过滤除去不溶性物,滤液用1 mol/L HCl调pH 至6.0,4 ℃下搅拌过夜,之后置于4 ℃下3 000×g离心5 min。离心后,上清液即为“无黏蛋白”蛋清(“mucin-free”EW)。
1.3.4 乙醇析出法提取卵转铁蛋白粗品[6]
将经1.3.3 法预处理后的蛋清的pH 调节至pH9.0,按照2008年K.Y.Ko 等的方法,采用乙醇析出法提取卵转铁蛋白粗品,方法简要如下:将经1.3.3 法预处理好的蛋清溶液pH 调节至9.0,加入NaHCO3、NaCl 和FeCl3至终浓度分别为50 mmol/L、150 mmol/L和20 mmol/L,搅拌30 min 并加入乙醇至终浓度为43%(体积分数)后离心(4 ℃,3 220 g,20 min)取上清再滴加乙醇至终浓度为59 %,室温下搅拌30 min 后离心(4 ℃,3 220 g,20 min)取沉淀复溶于柠檬酸盐缓冲液(50 mmol/L)中并调节pH 至4.7,再加入已处理的pH 为4.7 的阳离子树脂并室温下搅拌3 h,过滤出去树脂,滤液冻干得OVT 粗品。
1.3.5 两步弱酸性阳离子交换层析法进一步纯化卵转铁蛋白[7]
参照2005年C Guérin-Dubiard 等的方法进行离子交换层析,略有改进,具体如下:经1.3.4 法提取的卵转铁蛋白粗品用磷酸缓冲液(pH8.0、20 mmol/L)溶解,至终浓度50 mg/mL,并用NaOH(1.0 mol/L)调节pH 至8.0,蛋白溶液经低温离心(4 ℃、6 000 g、30 min)得到蛋白滤液再经两步离子交换层析:第一步为pH8.0 弱酸性阳离子树脂去除碱性蛋白(缓冲液为:pH8.0 20 mmol/L 磷酸缓冲液;洗脱液为:0.5 mol/L NaClpH8.0 20 mmol/L 磷酸缓冲液;流速为20 mL/min;柱子25 cm×3 cm)收集峰1 组分;第二步为pH5.2 弱酸性阳离子树脂提取卵转铁蛋白粗品(缓冲液为:pH5.2 10 mmol/L 柠檬酸盐缓冲液;洗脱液为:0.5 mol/L NaCl-pH5.2 10 mmol/L 柠檬酸盐缓冲液;流速为20 mL/min;柱子25 cm×3 cm),收集峰2 组分含有卵转铁蛋白,再经透析除盐(4 ℃,24 h)就会得到高纯度的产品,最后进行电泳检测。
2 结果与分析
2.1 乙醇析出法提取卵转铁蛋白粗品的结果
碱性条件下(pH=9.0)并有伴阴离子(HCO3-)的存在下,OVT 可通过HCO3-与Fe3+形成三元复合体,即Fe3+2-HCO3-OVT 复合物,呈橙红色。OVT 蛋白分子中的N-端瓣和C-端瓣各含有一个金属结合位点[8],其中N-端瓣中的4 个氨基酸残基(即Asp60、Tyr191、Tyr92和His250)与来自伴阴离子的HCO3-共拥有6 个可与Fe3+结合的配位键,同样C-端瓣的Asp395、Tyr524、Tyr431 和His592 也与来自一个HCO3-离子拥有6 个可与Fe3+结合的配位键,从而形成了2 个金属结合位点。OVT 蛋白与HCO3-以及Fe3+相互结合后会使整个蛋白分子结构变得更紧密、封闭、稳定,并且提高了其对乙醇沉淀作用的耐受性。
方法1.3.4 先形成了OVT-HCO3--Fe3+三元复合体,后在43%乙醇浓度下,稀释后的蛋清液中几乎除了OVT 蛋白的其他蛋白都会沉淀,经4 ℃离心(3 220×g,20 min)后可除去大部分除了转铁蛋白杂蛋白,而大部分形成三元复合体的OVT 则存在于呈亮橙红色的上清液中,但当乙醇终浓度到了59%时,溶液中橙红色物质,即OVT 三元复合体会发生沉淀,沉淀再用去离子水复溶成为亮橙红色溶液,调节此溶液pH 至4.7,此时三元复合体在酸性条件下稳定性下降,HCO3-和Fe3+会游离出来,溶液颜色会由亮橙红色逐渐变为乳白色,再加入阴离子交换树脂并经搅拌,HCO3-被阴离子交换树脂吸附,经过滤后,结合了HCO3-的树脂可被除去,此时,脱辅基蛋白就不会再结合Fe3+。得到溶液经透析,冻干,得到脱辅基的卵转铁蛋白。SDS-PAGE电泳得到的电泳图如图1 所示。表明,此时蛋白的纯度较高,经凝胶成像系统的软件分析表明该蛋白的纯度高于96%。
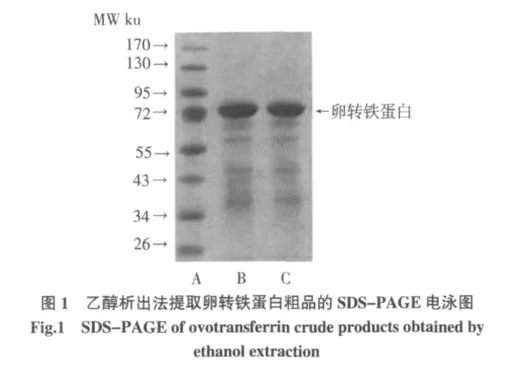
注:5%浓缩胶、12%分离胶;A 电泳道为Marker(PageRuler Prestained Protein Ladder#Sm0672,Fermentas 公司),上样量5 μL;B 和C 电泳道分别为2 次提取的OVT 样品,浓度为1 mg/mL、上样量10 μL。
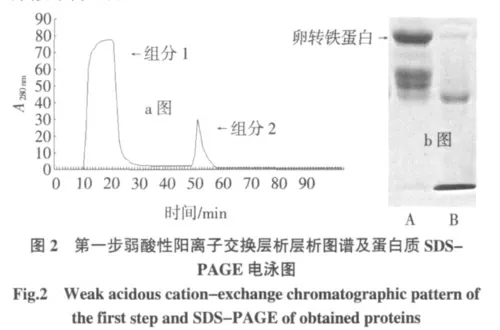
注:a 图中,层析柱:2.0 cm×4 cm、平衡缓冲液:pH5.2,0.05 mol/L 柠檬酸-柠檬酸钠缓冲液、流速:1 mL/min、洗脱液:0.05 mol/L 柠檬酸-柠檬酸钠缓冲液pH5.2 并含0.5 mol/L NaCl;b 图中,A 电泳道为组分1的图谱,B 电泳道为组分2 的图谱,C 电泳道为蛋白质marker。
从电泳图谱的结果来看,由方法1.3.4 提取的OVT 蛋白粗品仍含有其他蛋白质,特别是分子量在72 ku~34 ku 范围内的其他蛋白。
2.2 两步弱酸性阳离子交换层析进一步纯化卵转铁蛋白的结果
第一步弱酸性阳离子交换层析过程如图2a 所示,峰1 处所收集的蛋白液含有OVT 蛋白的组分1,峰2处所收集的为含有溶菌酶以及抗生素蛋白的组分2,经SDS-PAGE 电泳的检测结果如图2b 所示,经过这一步离子交换步骤,可有效地将等电点≥8.0 杂蛋白从样液中除去。
3 结论
鸡蛋原蛋清经过蛋清预处理后可以得到“无黏蛋白”被稀释的蛋清液,再经过两步醇析法可以得到纯度较高的卵转铁蛋白,最后的两步弱酸性阳离子层析法以及相应的冷冻干燥可是得到纯度高于96%的卵转铁蛋白产品。
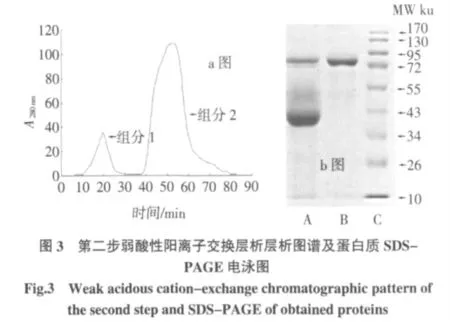
注:a 图中,层析柱:2.0 cm×4 cm、平衡缓冲液:pH8.0,0.05 mol/L 磷酸盐缓冲液、流速:1 ml/min、洗脱液:0.05 mol/L 磷酸盐缓冲液pH8.0 并含0.5 mol/LNaCl;b 图中,A 电泳道为组分1 图谱,B 电泳道为组分2图谱。
第二步弱酸性阳离子交换层析过程如图3 所示,峰1 处所收集的组分1 蛋白液所含的大多数蛋白质的等电点小于pH5.2,而峰2 处所收集的组分2 蛋白液为OVT 蛋白组分,经SDS-PAGE 电泳的检测结果如图2b 所示,经过第二步离子交换后,B 电泳道的图谱
[1] Spik G,Coddeville B,Montreuil J.Comparative study of the primary structures of sero-,lacto-and ovotransferrin glycans from different species[J].Biochimie,1988,70(11):1459-1469
[2] 陈庆森,庞光昌,吴子健.实用生物化学实验技术指导[M].天津:天津科学技术出版社,2006:40-41
[3] 理查德J 辛普森.蛋白质与蛋白质组学实验指南[M].何大澄,译.北京:化学工业出版社,2006:35-79
[4] Guérin-Dubiard C,Pasco M,Hietanen A.Hen egg white fractionation by ion-exchange chromatography [J].Journal of Chromatography A,2005(6):58-67
[5] Thomas Croguennec,Françoise Nau,Stéphane Pezennec,et al.Twostep chromatographic procedure for the preparation of hen egg white ovotransferrin[J].Eur Food Res Technol,2001,212(15):296-301
[6] Ko K Y,Ahn D U.An Economic and Simple Purification Procedure for the Large-Scale Production of Ovotransferrin from Egg White[J].Poultry Science,2008(87):1441-1450
[7] C Guérin-Dubiard,M Pasco,A Hietanen.Hen egg white fractionation by ion-exchange chromatography[J].Journal of Chromatography A,2005,1090(1-2):58-67
[8] Hirofumi Kurokawa, Bunzo Mikami, Masaaki Hirose. Crystal Structure of Diferric Hen Ovotransferrin at 2.4ÅResolution[J].J Mol Biol,1995,254(2):196-207
