红景天苷对自然衰老小鼠模型的抗衰老作用研究
2012-01-24申佳佳苑隆国李电东王真
申佳佳,苑隆国,李电东,王真
红景天(Rhodiola rosea L.)具有抗缺氧、抗疲劳、抗血乳酸含量增加等作用,而红景天苷(salidroside,SAL)作为红景天中重要有效成分,也具有多种药理作用,包括保护神经系统及心血管系统、调节机体代谢、增加机体免疫系统功能以及干预衰老等[1]。有报道证实红景天及其提取成分能降低正常小鼠经诱导剂诱导产生氧化应激反应后其体内过氧化脂质(lipid peroxidation,LPO)和脂褐素的含量,并且提高超氧化物歧化酶(superoside dismutase,SOD)及谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)活性[2-4],我们以前的研究发现红景天苷对人胚肺二倍体成纤维细胞具有良好的干预衰老和抗氧化效应[5],但红景天苷对自然衰老小鼠体内的抗氧化效应究竟如何,目前报道较少。本文通过给自然衰老小鼠口服一定剂量的红景天苷,测定其对动物体内不同器官组织的抗氧化酶活性及过氧化脂质和脂褐素水平的影响,以进一步探索红景天苷体内干预衰老的可能作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 16 月龄 ICR 雌性小鼠,体重33 ~ 45 g,购自北京大学医学部实验动物中心,许可证号:SCXK(京)2006-0008。
1.1.2 主要试剂 人参皂苷(ginsenoside,GS)购自吉林大自然生物技术公司;红景天苷购自中国食品药品检定研究院;邻苯三酚、三羟甲基氨基甲烷、硫代巴比妥酸、四乙氧基丙烷均为美国 Sigma公司产品;其他试剂为国产分析纯。
1.1.3 主要仪器及设备 DU800 型紫外分光光度计为美国 Beckman 公司产品; RF-5000 型荧光分光光度计为日本岛津公司产品;Centrifuge 5424型台式高速离心机为德国 Eppendorf 公司产品;Mikro 200R 型冰冻高速离心机为德国贺力士公司产品;漩涡振荡器为天津泰普公司产品;恒温水浴为上海荣华仪器公司产品。
1.2 方法
1.2.1 自然衰老小鼠分组及给药情况 48 只自然衰老小鼠随机分为 4 组,即对照组、两个不同剂量红景天苷(0.2 g/kg 和 1.0 g/kg)给药组和人参皂苷阳性药物组(0.2 g/kg)。对照组灌以同体积生理盐水,连续灌胃 60 d。
1.2.2 组织匀浆制备 灌胃 60 d 后,摘眼球取足够量血清,然后脱颈椎处死小鼠,迅速取出小鼠的相应脏器,每种组织称取一定量,在匀浆器中用生理盐水分别制成 5% 组织匀浆生理盐水混悬液,离心后取上清,进行生化指标测定[6-8]。
1.2.3 血清或组织中 SOD 活性的测定 SOD是体内重要的抗氧化酶之一,能清除超氧负离子自由基,从而保护机体细胞和组织免受自由基的损害,延缓机体衰老过程。在老龄生物体内也发现SOD 等抗氧化酶活性较低[9]。我们前期研究证明红景天苷的毒性剂量大于 5 g/kg。本实验选用 0.2 g/kg及 1.0 g/kg 作为红景天苷给药剂量,同时设人参皂苷(0.2 g/kg)阳性药物组。
血清样本 20 μl(发生溶血的样本不计入结果)或组织匀浆上清 10 ~ 40 μl,测定 SOD 活性。
SOD 标准抑制曲线制作:将 SOD 标准品用磷酸盐缓冲液配制成 750 U/ml 的溶液,稀释 50 倍至 15 U/ml,使用分光光度计在 530 nm 波长下测定不同量的 SOD 标准液 OD 值,计算百分抑制率,以百分抑制率为纵坐标,以 SOD 活性单位U/ml 为横坐标作标准曲线。每毫升反应液中 SOD抑制率达到 50% 时所对应的 SOD 量为一个单位。
SOD 百分抑制率 =(对照管 OD 值 - 测定管 OD 值)/对照管 OD 值 × 100%,
SOD 活性(U/ml)= SOD 百分抑制率 × 12 ×样品稀释倍数/取液量。
1.2.4 血清或组织中 LPO 生成水平测定 LPO是氧自由基与多聚不饱和脂肪酸反应的产物,随年龄的增加而增高。它可作为衰老的一个定量指标,也可以用于评价机体的生命活力。LPO 经过氧化分解后形成丙二醛(malondialdehyde,MDA),MDA含量即代表 LPO 水平。MDA 在酸性条件下与硫代巴比妥酸反应,生成 MDA-TBA 复合物,呈粉红色,可采用分光光度法在 532 nm 波长下检测。四乙氧基丙烷与过氧化脂质在同一条件下能进行化学反应产生丙二醛。因此,可用四乙氧基丙烷作为标准物质。
血样:血清用量 0.1 ml,不加稀释,发生溶血的样本不计入结果。
组织样本:取脏器 200 mg,生理盐水冲洗、拭干、准确称重、剪碎,置匀浆器中,加入 0.2 mol/L磷酸盐缓冲液,20 000 r/min 匀浆 10 s,间歇 30 s,反复 3 次,制成 5% 匀浆,845 × g 离心 5 ~10 min,取上清待测。
LPO 含量(nmol 每克组织或血清)=(样品管 OD 值 - 空白管 OD 值)× 40 /(四乙氧基丙烷 OD 值 - 空白管 OD 值)× 0.1 × 1000
1.2.5 组织中脂褐素水平测定 脂褐素是某些细胞质内形成的不溶性颗粒,其含量一般随年龄的增长而增多,是衰老过程中具有特征性的物质之一。脂褐素作为膜脂质和蛋白质过氧化后的一种复合产物,可反映细胞的过氧化程度,甚至可推断细胞衰老的程度。
每只小鼠取相应组织 200 mg,加入氯仿-甲醇(2:1)混合溶液 4 ml,在 45 ℃ 水浴中以2500 r/min 速度匀浆 1 min,制成 5% 匀浆。随后加入 4 ml 蒸馏水,剧烈振荡 1 min,845 × g 离心10 min 后样品分为 3 层,小心吸去水相,穿过中层将下层氯仿-甲醇液取出。向氯仿甲醇提取液中加入甲醇 0.2 ml,轻轻振荡均匀,置紫外灯下照射30 s 后测定荧光强度。以硫酸奎宁(0.1 μg/ml)为标准对照,在狭缝 4.4 nm、灵敏度 3.6 ng/ml、激发波长 360 nm、发射波长 450 nm、荧光强度约为55 ~ 60 U 条件下测定样品荧光强度。氯仿甲醇混合液为空白对照。
脂褐素含量(µg 每克组织)= A × B × C,其中:
A =(样品荧光强度 -空白荧光强度)/硫酸奎宁荧光强度;
B = 硫酸奎宁浓度(0.1 μg/ml);
C = 匀浆体积/样品重量。
1.2.6 血清或组织中 GSH-Px 活性测定 GSH-Px是机体中重要的一种抗氧化酶,能间接减少体内过氧化脂质的形成。该酶活性也随增龄降低。
组织上清液制备:取适量所需脏器,冰浴剪碎,加冷 0.2 mol/L 磷酸缓冲液,以 20 000 r/min 匀浆10 s,间歇为 30 s,反复 3 次,制成 5% 组织匀浆。4 ℃,6630 × g 离心 10 min,取上清待测。
谷胱甘肽(GSH)标准曲线制作:取 1.0 mmol/L GSH 溶液 0、0.2、0.4、0.6、0.8、1.0 ml,分别置于10 ml 小容量瓶中,各加入偏磷酸沉淀剂 8 ml,用双蒸水稀释至 10 ml 刻度,即得浓度为 0、20、40、60、80、100 μmol/L 的 GSH 标准液。取上述不同浓度标准液各 2 ml,放入试管中,加入 0.32 mol/L磷酸氢二钠 2.5 ml,比色前加入 DTNB 显色液0.5 ml,5 min 内于 423 nm 波长测定 OD 值,以双蒸水调零点。以 GSH 含量(μmol/L)为横坐标,OD423值为纵坐标,即可制作标准曲线并得到回归方程。
血清 GSH-Px 活性计算:规定每毫升血清每分钟扣除非酶反应的 log[GSH] 降低后,使 log[GSH]每降低 1 为一个酶活单位。GSH-Px 活性单位(U/ml)= log[非酶管 OD 值 - 空白管 OD 值]-log[样品管 OD 值 - 空白管 OD 值]/ 0.012。
组织 GSH-Px 活性计算:规定每毫克组织蛋白每分钟扣除非酶反应,使 GSH 浓度降低 1 μmol/L为一个酶活单位。GSH-Px 活性单位(U 每毫克蛋白)=(非酶管 OD - 样品管 OD)× A × 5 / 3 × 样品蛋白含量,其中,A = GSH 标准曲线斜率。
1.3 统计学方法
2 结果
2.1 红景天苷对自然衰老小鼠多种器官组织 SOD活性的影响
通过检测不同给药组自然衰老小鼠体内血清、心脏、肝脏、肾脏和大脑等器官组织的 SOD 含量的变化发现,高剂量红景天苷给药组自然衰老小鼠的血清、心脏、肝脏和肾脏组织中的 SOD 活性均比未加药对照组显著升高(图 1)。
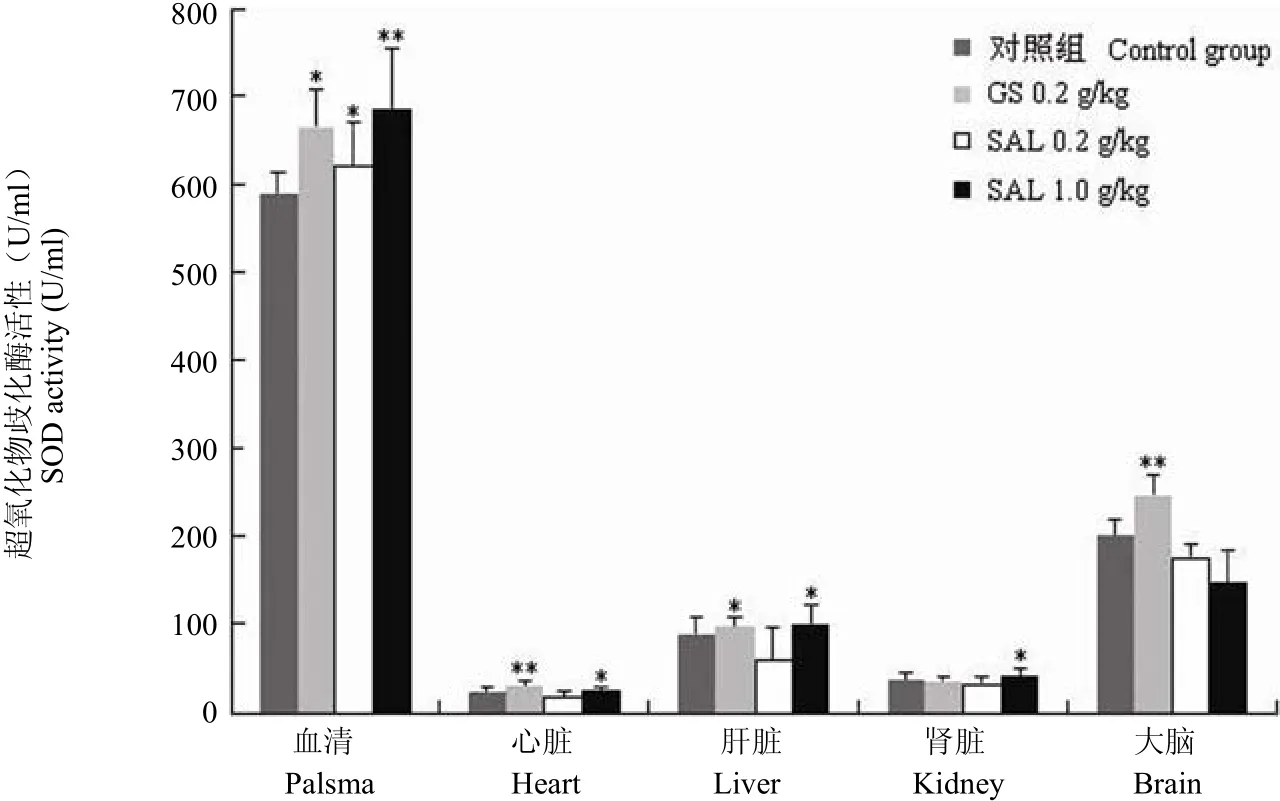
图 1 不同组别老年小鼠血清、心脏、肝脏、肾脏及大脑中 SOD 的活性(与对照组相比,*P < 0.05;**P < 0.01)Figure 1 The activity of SOD in the palsma, heart, liver, kidney and brain of the aged mice (*P < 0.05; **P < 0.01 vs control)
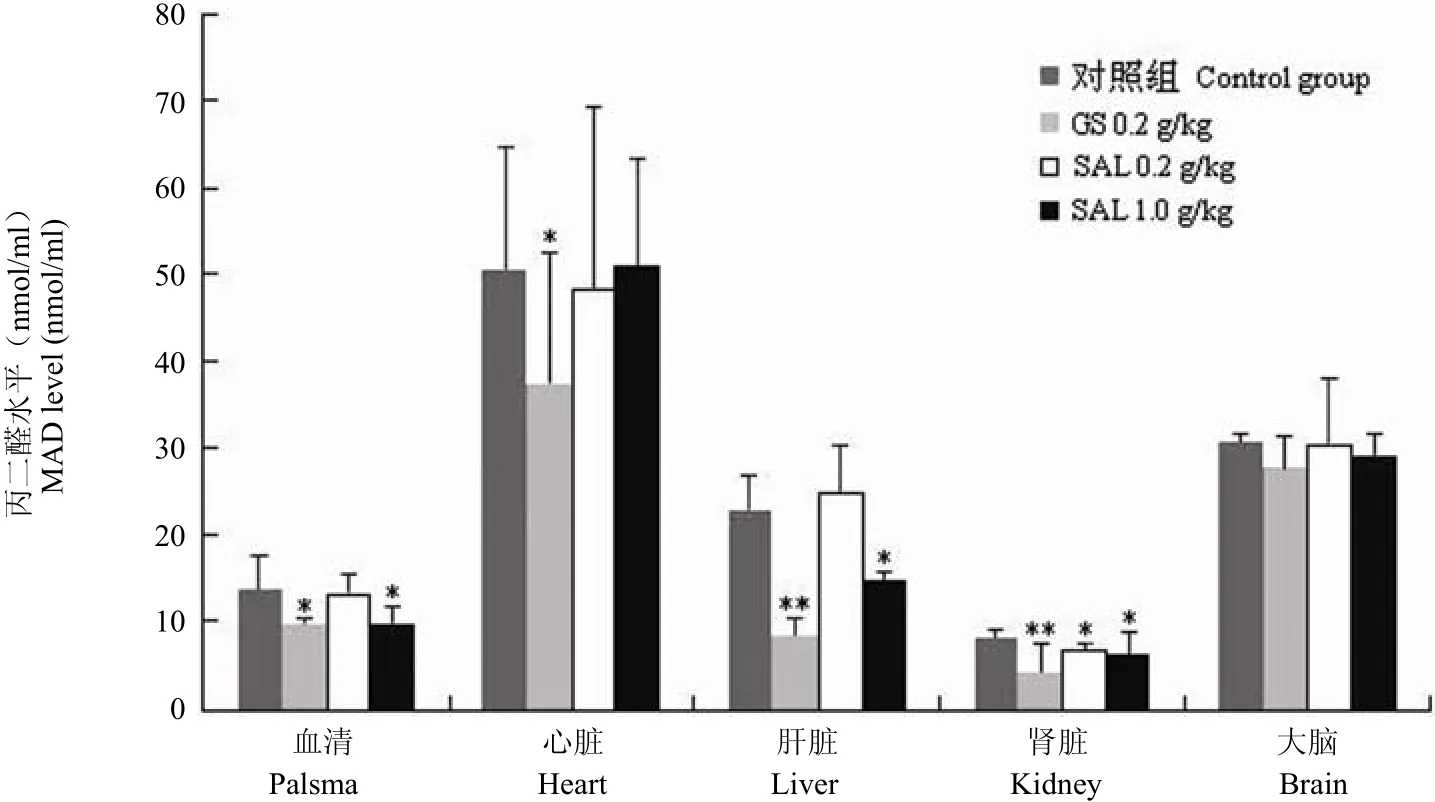
图 2 不同组别老年小鼠血清、心脏、肝脏、肾脏及大脑中 MAD 水平(与对照组相比,*P < 0.05;**P < 0.01)Figure 2 MAD level in the palsma, heart, liver, kidney and brain of the aged mice (*P < 0.05; **P < 0.01 vs control)
2.2 红景天苷对自然衰老小鼠多种器官组织 LPO生成的影响
由图 2 的结果可以看出,与人参皂苷类似,高剂量红景天苷给药组小鼠的血清、肝脏、肾脏MDA 含量与未加药组相比显著下降(P < 0.05),其大脑组织 MDA 水平也出现一定下降,心脏变化则不明显。
2.3 红景天苷对自然衰老小鼠多种器官组织脂褐素含量的影响
由图 3 可以看出,高剂量红景天苷给药组和人参皂苷组小鼠的脂褐素含量在肝脏、肾脏及大脑组织中与未加药组相比均降低,其中人参皂苷组动物肝脏中的脂褐素水平降低最为显著(P < 0.01),而高剂量红景天苷给药组动物的大脑中脂褐素含量降低最显著(P < 0.05)。
2.4 红景天苷对自然衰老小鼠体内多种器官组织GSH-Px 活性的影响
由图 4 结果可见,与未加药组相比,人参皂苷组动物血清、心脏和肝脏的 GSH-Px 活性均显著升高,而高剂量红景天苷给药组在这 3 种器官组织的 GSH-Px 活性变化不明显。但在肾脏和大脑组织中,高剂量红景天苷给药组的 GSH-Px 活性均优于人参皂苷组以及未加药对照组。
3 讨论
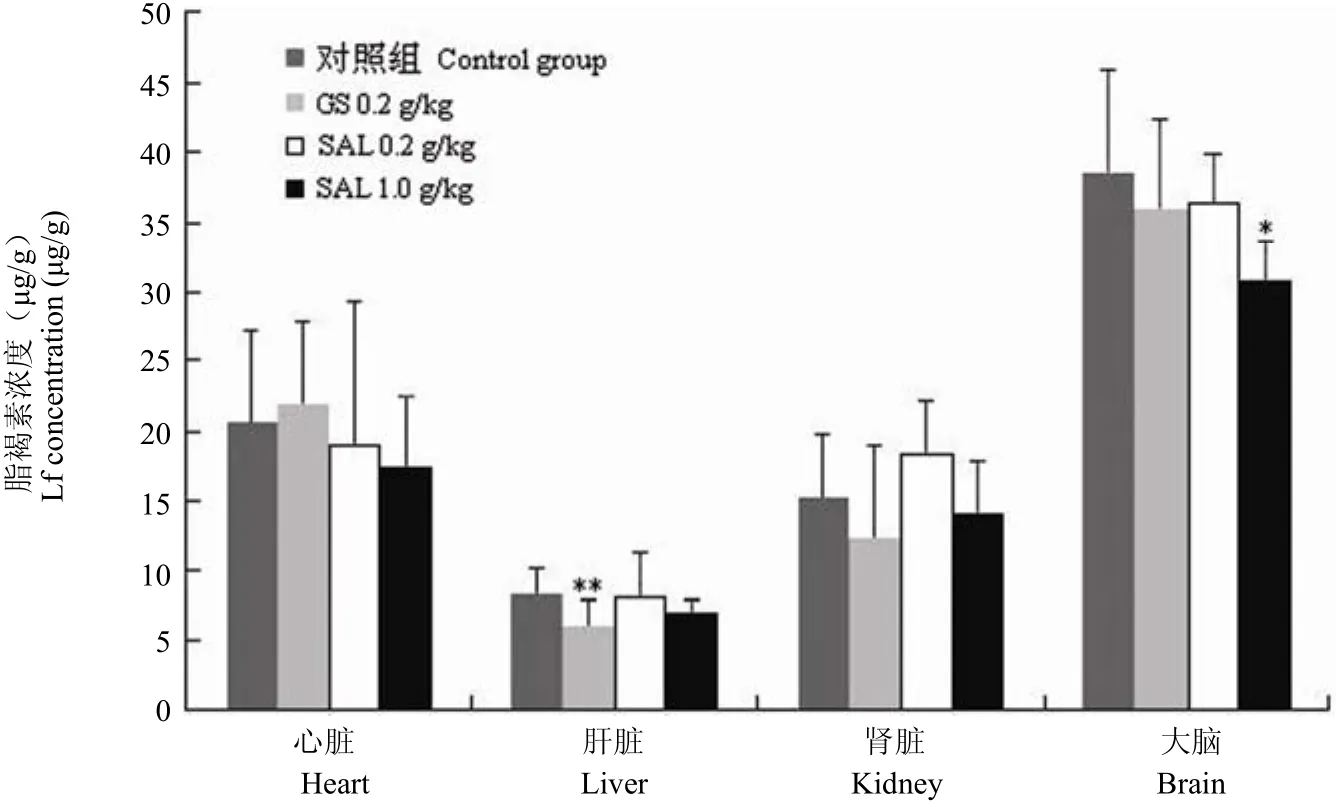
图 3 不同组别老年小鼠心脏、肝脏、肾脏及大脑中脂褐素(Lf)的水平(与对照组相比,*P < 0.05;**P < 0.01)Figure 3 The concentration of lipofascin (Lf) in the heart, liver, kidney and brain of the aged mice (*P < 0.05; **P < 0.01 vs control)
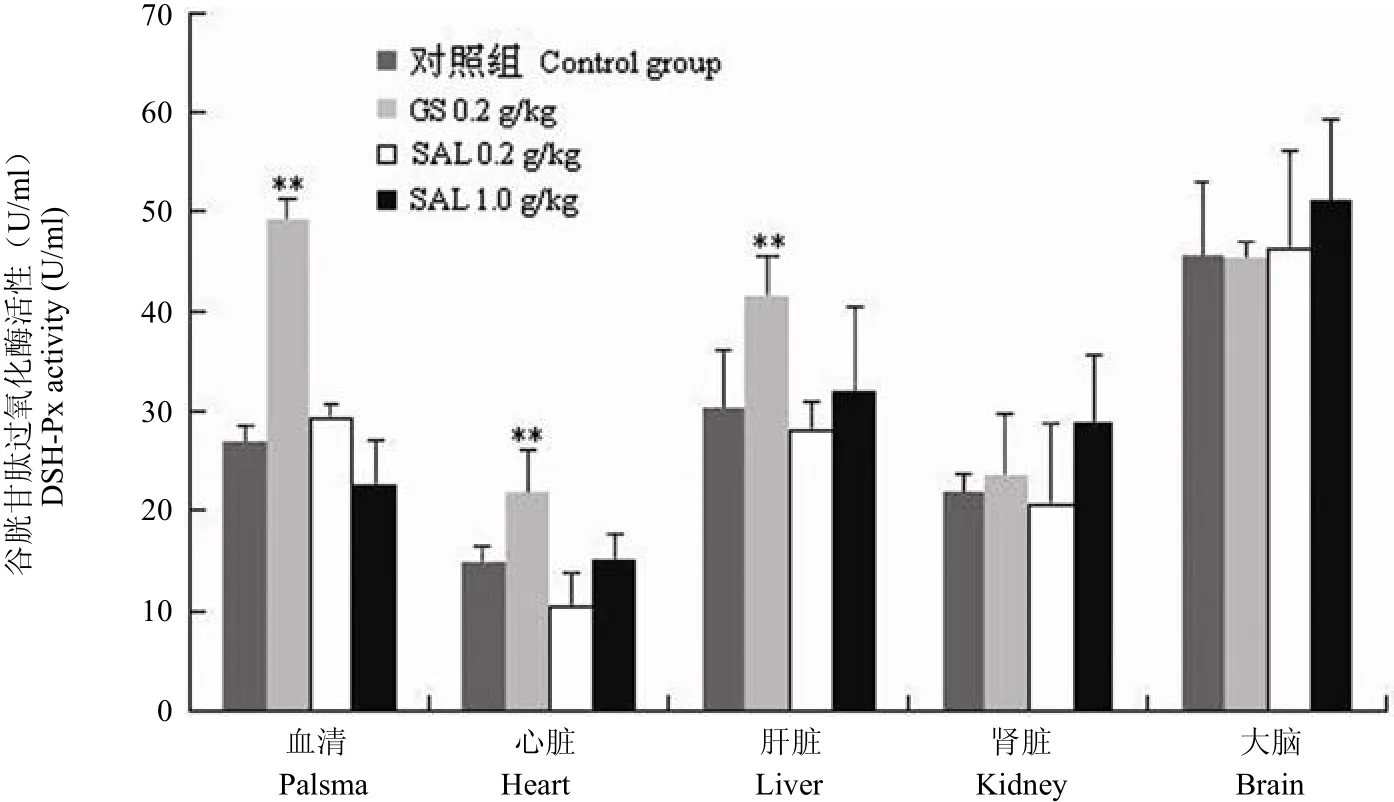
图 4 不同组别老年小鼠血清、心脏、肝脏、肾脏及大脑中 GSH-Px 的活性(与对照组相比,*P < 0.05;**P < 0.01)Figure 4 The activity of GSH-Px in the palsma, heart, liver, kidney and brain of the aged mice (*P < 0.05; **P < 0.01 vs control)
衰老是生理功能的时间依赖性衰退,其与机体内各种物质代谢功能缺陷的逐渐积累有关。研究人员认为,线粒体呼吸作用的副产物活性氧自由基所引起的过氧化反应是引起各种物质代谢通路损伤乃至衰老的重要原因之一[10]。活性氧自由基是一类高度活性物质,可直接或间接发挥其氧化剂的作用,氧化细胞膜上的不饱和脂肪酸形成 LPO,进一步形成脂褐素。脂质过氧化产物、脂褐素可造成功能蛋白损伤、DNA 复制功能减弱以及 RNA 合成受阻,破坏细胞的正常结构,排挤细胞器,从而引起细胞衰老和死亡[11]。已有研究证实,一些抗氧化酶如 SOD、GSH-Px 等能清除超氧负离子自由基,从而保护机体细胞和组织不受自由基的损害,延缓机体衰老过程,这些抗氧化酶的增龄性失活可能是由于编码抗氧化酶的基因及抗氧化酶自身受到自由基的化学损伤所引起[12]。
现代药理实验表明,红景天具有抗缺氧,抗疲劳,抗血乳酸含量增加的作用[13]。红景天苷及红景天苷样化合物是红景天的主要活性成分,其中红景天苷被认为是红景天保健功效的重要成分,该成分含量的高低是评价该属植物药用价值的重要指标之一。已有研究表明,红景天苷可以激活能量代谢中的某些酶或者辅酶,提高组织对能量的利用率,延长供氧时限,有效提高骨骼肌的应激能力,减少代谢产物的堆积[14]。此外,红景天苷具有抗自由基、抑制脂质过氧化的作用,能阻断氧自由基导致的生物膜脂质过氧化反应及其引发的链式反应,保护细胞结构和功能[15]。本实验室以前的研究发现,在 D-半乳糖诱导的衰老小鼠模型中,红景天苷通过增强小鼠的运动能力、延长小鼠的记忆延迟时间、促进淋巴细胞有丝分裂及白介素-2 的合成来逆转 D-半乳糖诱导的衰老作用[16];而在过氧化氢诱导早熟性衰老的人胚肺二倍体成纤维细胞中,红景天苷通过改变细胞衰老样表型、细胞周期及细胞内相关分子的表达同样可以逆转氧化剂诱导产生的衰老相关表型[5]。本实验室进一步利用自然衰老小鼠模型研究了红景天苷的抗衰老作用,证实了红景天苷可以提高自然衰老小鼠体内不同器官、组织的 SOD 和GSH-Px 活性,降低自然衰老小鼠各器官、组织中的 LPO 及脂褐素水平;其效应在多个器官、组织中与常用抗衰老药物人参皂苷类似。由此猜测,通过提高机体内源性抗氧化酶活性、降低体内过氧化物水平而延缓衰老,可能是红景天苷的主要作用机制。
综上,本研究利用自然衰老小鼠模型进一步证明了红景天苷体内的抗衰老作用,丰富了红景天苷抗衰老的机制,为该药物在临床上的可能应用提供了理论依据。
[1] Ming DS, Hillhouse BJ, Guns ES, et al. Bioactive compounds from Rhodiola rosea (Crassulaceae). Phytother Res, 2005, 19(9):740-743.
[2] Huang SC, Lee FT, Kuo TY, et al. Attenuation of long-term Rhodiola rosea supplementation on exhaustive swimming-evoked oxidative stress in the rat. Chin J Physiol, 2009, 52(5):316-324.
[3] Li F, Tang H, Xiao F, et al. Protective effect of salidroside from Rhodiolae Radix on diabetes-induced oxidative stress in mice.Molecules, 2011, 16(12):9912-9924.
[4] Ma L, Cai DL, Li HX, et al. Protective effects of salidroside on oxidative damage in fatigue mice. J Chin Integr Medicine, 2009, 7(3):237-241. (in Chinese)马莉, 蔡东联, 黎怀星, 等. 红景天苷对疲劳小鼠氧化损伤的保护作用. 中西医结合学报, 2009, 7(3):237-241.
[5] Mao GX, Wang Y, Qiu Q, et al. Salidroside protects human fibroblast cells from premature senescence induced by H(2)O(2) partly through modulating oxidative status. Mech Ageing Dev, 2010, 131(11-12):723-731.
[6] Chen Q. Anti-aging research methodology. Beijing: China Medical Science Press, 1996:608-609. (in Chinese)陈勤. 抗衰老研究实验方法学. 北京: 中国医药技术出版社, 1996:608-609.
[7] Ministry of Health of the People's Republic of China. Inspection and assessment standard for health food. 2003:43-57. (in Chinese)中华人民共和国卫生部. 保健食品检验与评价技术规范. 2003:43-57.
[8] Gao QF, Zhu XY, Wang SS, et al. Research on the pharmacological effects of Kang shuailin. Chin Pharm J, 1994, 29(2):91-94. (in Chinese)高清芳, 朱秀英, 王书声, 等. 中药抗衰灵抗衰老作用的药理学研究. 中国药学杂志, 1994, 29(2):91-94.
[9] Wang Z, Li DD, Liang YY, et al. Activation of astrocytes by advanced glycation end products: cytokines induction and nitric oxide release.Acta Pharmacol Sin, 2002, 23(11):974-980.
[10] Alexeyev MF. Is there more to aging than mitochondrial DNA and reactive oxygen species? FEBS J, 2009, 276(20):5768-5787.
[11] Song X,Bao M, Li D, et al. Advanced glycation in D-galactose induced mouse aging model. Mech Ageing Dev, 1999, 108(3):239-251.
[12] Halliwell B. Reactive oxygen species and the central nervous system.J Neurochem, 1992, 59(5):1609-1623.
[13] Jin YR, Wang L, Sui DY, et al. Antiaging actions of extracta from the stems and leaves of Rhodiola Sachliensis A.Bor (EFSLR). Chin J Gerontol, 2001, 21(3):228-229. (in Chinese)金永日, 王黎, 睢大员, 等. 红景天茎叶提取物的抗衰老作用研究.中国老年学杂志, 2001, 21(3):228-229.
[14] Huang ZY, Fan SD. Study on action mechanism of antifatigue effect of Rhodiola Sachalinesis A.Bor in mouce. J China Med Univ, 1998,27(2):123-125. (in Chinese)黄增艳, 范书铎. 库页红景天对鼠抗疲劳作用机理的实验研究. 中国医科大学学报, 1998, 27(2):123-125.
[15] Wen J, Guo Y, Chang P. Experimental observation on anti-oxidation of Rhodiola sacra extract. Chin J Clin Rehabil, 2005, 9(11):125-127. (in Chinese)文镜, 郭豫, 常平. 红景天提取物抗氧化作用的实验观察. 中医康复研究, 2005, 9(11):125-127.
[16] Mao GX, Deng HB, Yuan LG, et al. Protective role of salidroside against aging in a mouse model induced by D-galactose. Biomed Environ Sci, 2010, 23(2):161-166.
