纯化标签不同融合端的选择对蝎毒肽色谱行为的影响
2012-01-24惠长野邵建华郭妍张希杨学琴王佃鹏
惠长野,邵建华,郭妍,张希,杨学琴,王佃鹏
蝎尾腺分泌的蝎毒具有极大的医学价值,蝎毒的主要活性成分是一类由 28 ~ 76 个氨基酸残基组成的小分子多肽。按其分子的大小,可分为长链和短链两大类。蝎毒素虽然空间结构简单,生理活性却具有多样性,因而一直是研究的热点[1-2]。本实验以东亚钳蝎抗癫痫肽(anti-epilepsy peptide,AEP,GI:37999913)为模型,在实现 rAEP 原核可溶表达的基础上,结合肽链构象预测 His tag 在重组肽不同末端融合时的空间屏蔽效应,并构建相应的表达载体进行验证。为类似活性多肽的重组表达提供借鉴,以满足这类具有药用潜质的多肽的开发需求。
1 材料与方法
1.1 材料
1.1.1 表达载体及试剂 大肠杆菌 BL21(DE3)为本室保存;非融合表达质粒 pTrx 为沈阳药科大学生化教研室构建[3];Pyrobest DNA 聚合酶、限制性内切酶 Nco I、EcoR I 及 T4 DNA 连接酶为日本 TaKaRa 公司产品;引物均由上海生工生物工程公司合成;LB 培养基成分购自英国 Oxoid 公司;金属离子螯合柱 HisTrap FF为瑞典 Amersham 公司产品。
1.1.2 实验动物 昆明种小白鼠(SPF 级),雄性,体重 20 ~ 25 g,购自沈阳药科大学实验动物中心,合格证号:辽实合字 033 号。实验前,以颗粒状基础饲料饲喂 1 周以适应环境。
1.2 方法
1.2.1 AEP 生物信息学分析 Genbank 中搜索AEP 成熟肽同源序列并进行比对分析,根据 PDB库中收录的同源序列空间结构,用 WHAT-IF 软件对 AEP 进行建模。
1.2.2 pTrx-His-AEP 及 pTrx-AEP-His 表达载体的构建 以东亚钳蝎尾腺 cDNA 库为模板,根据Genbank 中 AEP 成熟肽序列设计引物见表 1。上游引物 P1 中,下划线为 Nco I 酶切位点,6 个组氨酸编码序列加粗显示,下游引物 P2 带有 EcoR I位点及终止密码子,PCR 产物经 Nco I 及 EcoR I双酶切,插入经过同样双酶切的 pTrx 中构建成纯化标签 N端融合的表达载体 pTrx-His-AEP,编码重组肽为 Met-Gly-His6-AEP,重组质粒转录翻译区见图 1。纯化标签 C 端融合的表达载体 pTrx-AEPHis 构建方法同上,下游引物 P4 中引入 6 个组氨酸的编码序列,编码重组肽为 AEP-His6。
1.2.3 rAEP 的表达、纯化 携带有重组质粒的BL21(DE3)接种至含卡那霉素 40 μg/ml 的 LB液体培养基中,37 ℃ 培养至 OD600= 0.6,加入终浓度为 0.4 mmol/L 的 IPTG 诱导培养 4 h 后,离心收集菌体,超声破碎后的上清液上样至用起始缓冲液平衡好的 HisTrap FF 柱。非变性条件下纯化选用降低 pH 结合 NH4Cl 竞争洗脱,同时考察8 mol/L 尿素变性条件下的洗脱情况。

表 1 AEP 扩增用引物Table 1 Primers used in this study
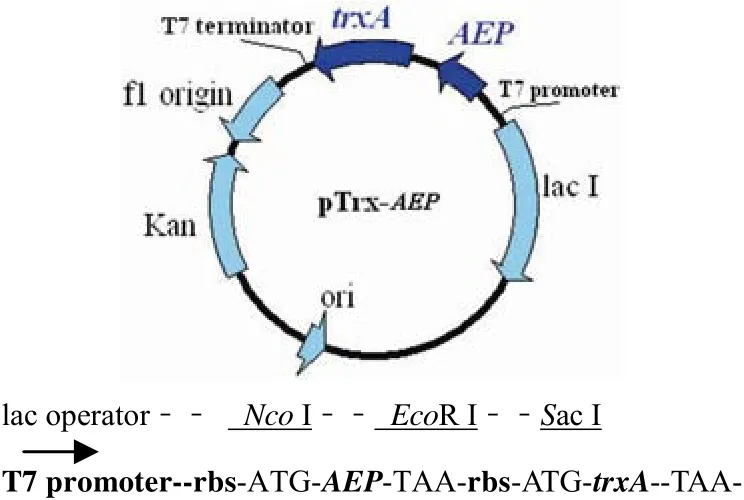
图 1 重组质粒克隆/表达区Figure 1 pTrx-AEP cloning/expression region
1.2.4 rAEP 生物活性测定 采用硫代氨基脲致小鼠神经兴奋模型[4]。取体重 20 ~ 25 g 雄性昆明种小鼠 40 只,随机分为 4 组,按 2.0 mg/kg皮下注射 rAEP,以等容生理盐水为阴性对照、4.0 mg/kg 苯巴比妥钠为阳性对照,于给药 20 min后,腹腔注射硫代氨基脲 11.0 mg/kg,记录 120 min内试验动物奔跑型转至强直型惊厥发作潜伏时间,以相对阴性对照组的惊厥发作潜伏时间延长率为活性指标。
2 结果
2.1 AEP 序列分析及同源建模
AEP 与蝎毒素中昆虫抑制性神经毒素的同源性最高(图 2)。Cys3 与 Cys6、Cys4 与 Cys7、Cys1 与 Cys8、Cys2 与 Cys5 配对成 4 个二硫键,在此基础上形成一个保守的结构域(knottin fold),该结构对这类肽的生物活性和热稳定性都十分重要[5]。
AEP 建模的平面截图见图 3。AEP 空间结构与大部分长链蝎神经毒素相似,由一段 α 螺旋和三段反向平行的 β 片层构成一个紧密的疏水核心,而 C 端为无规则卷曲,肽链相对比较延伸。

图 2 AEP 与抑制性昆虫毒素的序列比对分析Figure 2 Amino acid sequence comparison of AEP and depressant insect toxins
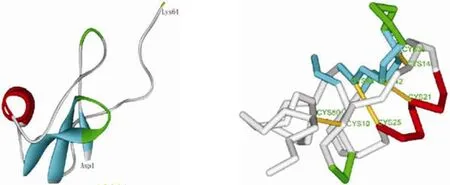
图 3 AEP 的空间结构及二硫键配对(红色:α 螺旋;蓝色:β 片层;绿色:β 转角;黄色:二硫键)Figure 3 Three-dimension structure and disulfide bonds of AEP (Red: helix; Blue: beta strand; Green: bend; Yellow: disulfide bond)
2.2 pTrx-His-AEP 及 pTrx-AEP-His 表达载体的构建
从空间结构可以看出,AEP 的 N 端依次为βαββ 形成了一个紧密结构(knottin fold),His tag融合于 N 端,容易被疏水核心所屏蔽。而 C 端肽链延伸出来,His tag 置于 C 端利于其与镍离子结合。为此我们构建了 His tag 不同末端融合的表达载体,重组质粒经双酶切后,在 250 bp 处出现目的条带(图 4A),测序分析显示与预期相符。His tag体积小,并不影响 rAEP 的表达,不同末端融合的情况下,TrxA 和 rAEP 都得到高效可溶性表达,表达量相近(图 4B)。
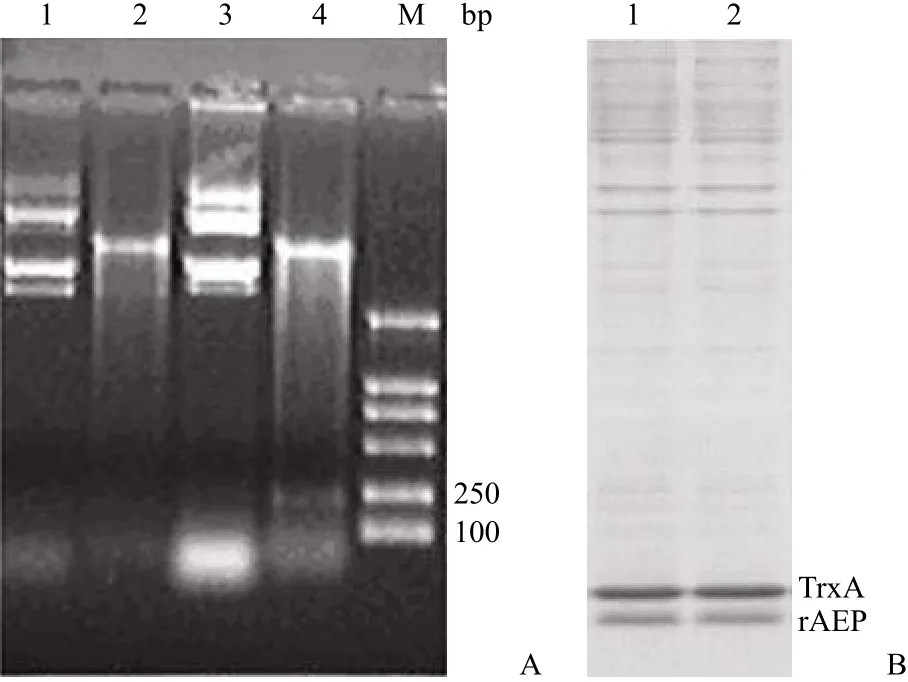
图 4 重组质粒 pTrx-AEP 的构建Figure 4 Construction of recombinant plasmid pTrx-AEP
2.3 Met-Gly-His6-AEP 与 AEP-His6 纯化结果对比
离心富集诱导后菌体,起始缓冲液(50 mmol/L Tris-HCl,pH 8.0)重悬,超声破碎后,高速离心(17800 × g,30 min,4 ℃)取上清。上样至起始缓冲液平衡好的 HisTrap FF,再平衡至基线稳定。改变 pH 洗脱,随着 pH 的降低,His tag 与金属离子螯合柱的结合能力降低,溶液洗脱能力增强。每次换用不同 pH 值溶液时,清洗至基线稳定,且流出液 pH 恒定。pH 6.0 ~ 7.0 采用 25 mmol/L PBS 作为缓冲体系,pH 4.0 ~ 5.0 采用 25 mmol/L NaAc-HAc 缓冲体系。变性条件下的洗脱,为在各溶液体系中引入 8 mol/L 尿素。
2.3.1 Met-Gly-His6-AEP 纯化结果 非变性条件下,各 pH 值缓冲液洗脱组分电泳分析结果见图 5A。降低 pH 减弱 rAEP 与 HisTrap FF 的结合力,rAEP 电泳条带在 6.5 kD 附近,少有菌体蛋白干扰。可见 rAEP 在各洗脱峰中都存在,很难得到电泳纯样品。随后洗脱液中引入了强变性剂8 mol/L 尿素,高浓度尿素的加入不破坏二硫键,但可以解除次级键对肽链构象的约束,使肽链得到充分延伸,利于 His tag 的暴露。实验结果(图 5B)也证实了这点,rAEP 与填料结合力增强,含有0.4 mol/L NH4Cl 的 pH 4.0 缓冲液洗脱峰达到了电泳纯,但清洗除杂步骤还是伴随有 rAEP 的损失,最终每升发酵液经纯化后获得纯度大于 95%样品约为 0.8 mg。
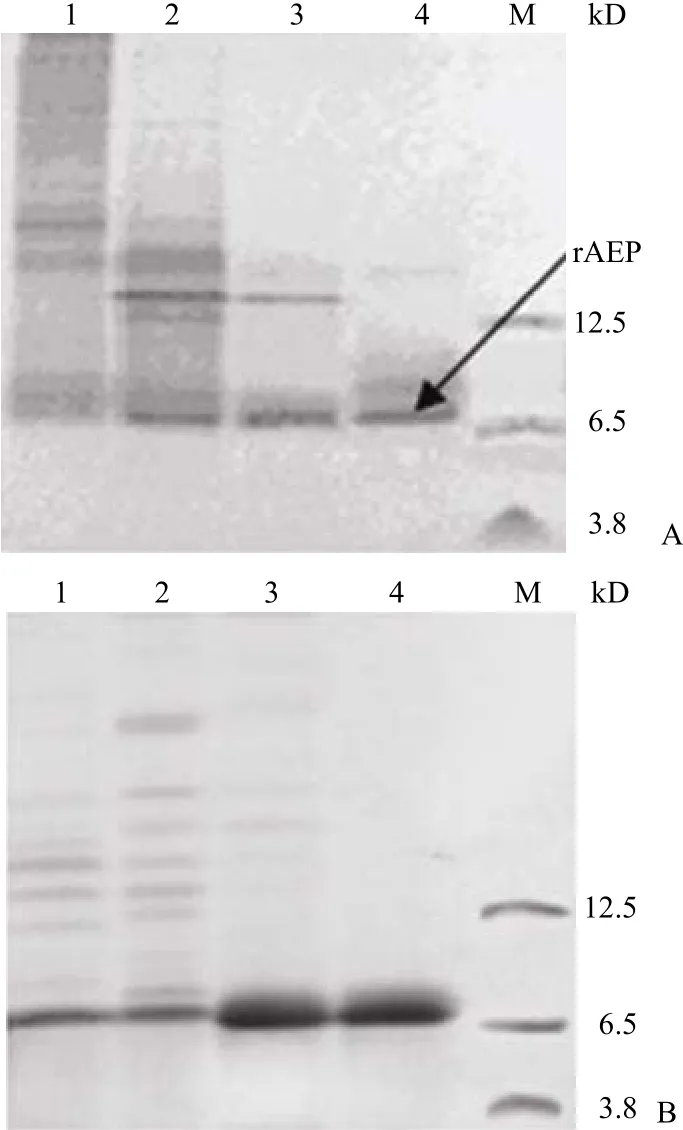
图 5 Met-Gly-His6-AEP 纯化过程中收集组份的 17.5%Tris-Tricine SDS-PAGE 分析Figure 5 17.5% Tris-Tricine SDS-PAGE for purification of Met-Gly-His6-AEP
2.3.2 AEP-His6纯化结果 根据空间结构推测His tag C 端融合有利于其更好地暴露,实验结果很好地证明了这点,非变性条件下图 6A,rAEP 在pH 降为 4.0 时都没被洗脱,随后加入 0.2 mol/L NH4Cl 才被洗脱,但纯度不高。图 6B 为 8 mol/L尿素存在下的洗脱结果,变性条件下 His tag 暴露更加充分,利于用更苛刻的条件除杂质,0.4 mol/L NH4Cl 洗脱峰达到了电泳纯。更重要的是洗涤步骤几乎没有 rAEP 的损失,每升发酵液经纯化后获得纯度大于 95% 样品量提高为 3.3 mg。
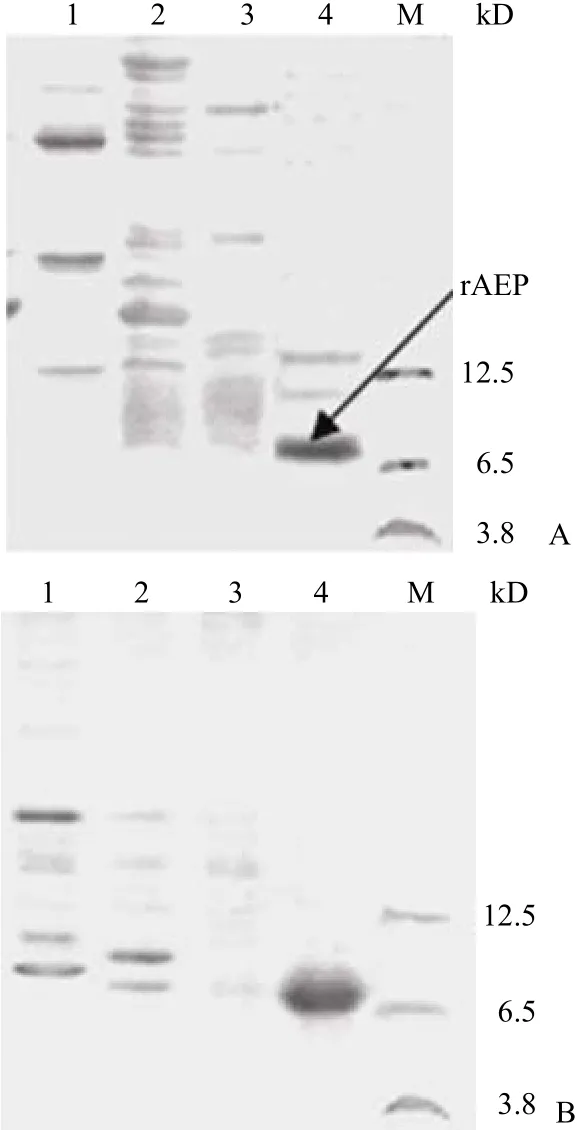
图 6 AEP-His6 纯化过程中收集组份的 17.5% Tris-Tricine SDS-PAGE 分析Figure 6 17.5% Tris-Tricine SDS-PAGE for purification of AEP-His6
2.4 Met-Gly-His6-AEP 与 AEP-His6 抗小鼠神经兴奋活性
在硫代氨基脲致小鼠神经兴奋模型中,两者均表现出抗神经兴奋作用(图 7)。AEP-His6使小鼠惊厥大发作潜伏时间延长 47.7%,显著高于 Met-Gly-His6-AEP 组(26.6%)及阳性对照药苯巴比妥钠组(28.4%)。推测与肽链 C 端延伸出 knottin fold 结构域,His tag 对活性中心构象影响小有关。
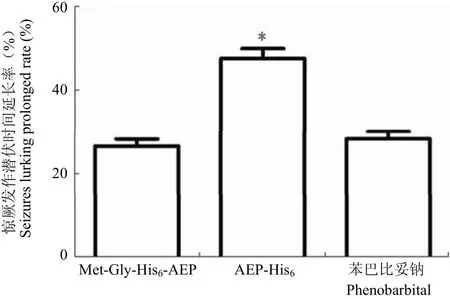
图 7 rAEP 抗小鼠神经兴奋活性[结果以惊厥发作潜伏时间延长率±s 表示,AEP-His6 组延长率显著高于 Met-Gly-His6-AEP 及苯巴比妥钠组(*P < 0.01)]Figure 7 Anti-neuroexcitatory activity of rAEP in mouse model. [The error bars represent the standard deviation of the mean, *P < 0.01 by unpaired t test, significantly different from phenobarbital group. There was no statistically significant difference between Met-Gly-His6-AEP and phenobarbital groups (P > 0.05)]
3 讨论
AEP 与蝎昆虫抑制性神经毒素高度同源,它们都作用于 Na+通道,是 Na+通道抑制剂。这类长链蝎毒素大多由一个螺旋(极少数是两个螺旋)、两段或三段反向平行的 β 折叠组成一个紧密的结构核心,二硫键对核心结构起着加固作用,亲水残基的侧链暴露在溶液中,是分子具有不同特异性的结构基础[5-6]。
在过量共表达硫氧还蛋白 TrxA 的情况下,营造胞质内氧化态势利于二硫键的形成,AEP 这类富含二硫键的活性肽得到了可溶性表达[3,7]。蝎毒肽具有分子量小、结构简单及生物活性强的特点,这些毒素分子正在成为新药开发及设计的模板。肽链末端极短肽段的去除对生物活性影响都很显著,额外加入的肽段对空间结构及活性中心结构域的形成影响显著[8]。重组表达时不宜选择过大的融合标签,His tag 被广泛用作小分子活性肽的亲合标签。结合分子构象,考虑 His tag 融合端的选择对后序纯化及生物活性的影响,对各类小分子活性肽的重组表达都具有借鉴意义。
[1] Rodríguez de la Vega RC, SchwartzZ EF, Possani LD. Mining on scorpion venom biodiversity. Toxicon, 2010, 56(7):1155-1161.
[2] Chippaux JP. Emerging options for the management of scorpion stings.Drug Des Devel Ther, 2012, 6:165-173.
[3] Shao JH, Hui CY, Cai QF, et al. The purification, gene clone and functional expression of scorpion anti-nociception peptide SAPIII.“Yiling Medicine Cup” 8th Nationol Youth Pharmacy Workers Academic Conference, 2006: 202-206. (in Chinese)
邵建华, 惠长野, 蔡启峰, 等. 东亚钳蝎镇痛活性肽SAPIII的分离纯化、基因克隆与功能表达//“以岭医药杯”第八届全国青年药学工作者最新科研成果交流会论文集, 2006:202-206.
[4] Zhang JH, Hua ZC, Xu Z, et al. Expression of anti-neuroexcitation peptide (ANEP) of scorpion Buthus martensii Karsch in Escherichia coli. Prep Biochem Biotechnol, 2001, 31(1):49-57.
[5] Zhu J, Wang J, Cheng MS, et al. Dinucleotides docking to scorpion polypeptide toxins: a molecular modeling method for protein functional site recognition. Biochem Biophys Res Commun, 2009,378(2):157-161.
[6] Jung S, Dingley AJ, Augustin R, et al. Hydramacin-1, structure and antibacterial activity of a protein from the basal metazoan Hydra.J Biol Chem, 2009, 284(3):1896-1905.
[7] Stewart EJ, Aslund F, Beckwith J. Disulfide bond formation in the Escherichia coli cytoplasm: an in vivo role reversal for the thioredoxins. EMBO J, 1998, 17(19):5543-5550.
[8] Possani LD, Becerril B, Delepierre M, et al. Scorpion toxins specific for Na+-channels. Eur J Biochem, 1999, 264(2):287-300.
