人细胞角蛋白19片段单克隆抗体的制备和鉴定
2012-01-24刘红刘宾李瑞娟杨萌萌李鹏聪张鑫孙旭东杨铁生
刘红,刘宾,李瑞娟,杨萌萌,李鹏聪,张鑫,孙旭东,杨铁生
细胞角蛋白(cytokeratin,CYK)是形成上皮细胞骨架的主要结构蛋白,具有保持上皮细胞完整性的作用[1]。根据等电点和分子量不同,CYK 可以分为 I 型和 II 型,I 型 CYK 属于酸性蛋白,包括 CYK-9 ~ CYK-23,II 型 CYK 属于碱性蛋白,包括 CYK-1 ~ CYK-8[2]。I 型 CYK 中的 CYK-19广泛分布在正常组织表面的层状或鳞状上皮细胞,分子量约为 40 kD[3]。
CYFRA21-1 是 CYK-19 被半胱天冬酶 3 裂解后,从细胞中释放出来时形成的可溶性片段[4],在非小细胞肺癌(non-small cell lung cancer,NSCLC)、头颈鳞细胞癌、口腔鳞状上皮细胞癌等鳞细胞癌中,或者乳腺癌、肝癌、肺癌和胰腺内分泌肿瘤等转移癌类中都会高表达[5-9],具有很好的血清诊断学价值,已被作为肿瘤细胞在血液和骨髓中循环的标志物,同时也是预后诊断的重要标志物[10-11]。目前,临床上应用的人血清 CYFRA21-1 免疫检测试剂盒中的抗体主要为进口产品,而具有高结合能力的特异抗体的制备是免疫检测方法成功建立的关键[12],也是影响检测成本的重要因素。因此,CYFRA21-1特异 mAb 单克隆抗体的制备,对免疫检测方法的建立和检测成本的控制具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 血清样本 血清样本共计 134 份,其中男性 74 份,女性 60 份,年龄在 20 ~ 92 岁,全部为本院门诊及住院患者样本。
1.1.2 实验动物 6 周龄,雌性 BALB/c 小鼠购自北京维通利华实验动物技术有限公司。
1.1.3 主要试剂和仪器 CYFRA21-1 化学发光法定量检测试剂盒为北京源德生物医学工程有限公司产品;CYFRA21-1 重组蛋白购于德国 Progen公司;碱性磷酸酶标记的山羊抗鼠和辣根过氧物酶标记的山羊抗鼠 IgG 购自北京鼎国昌盛生物技术有限公司;BCIP/NBT 底物显色试剂盒、可溶性单组分 TMB 显色试剂盒购于北京天根生物技术有限公司;蛋白预染和普通 Marker 均购于北京全式金生物技术有限公司;丙烯酰胺、甲叉双丙烯酰胺购于 Genview 公司(北京);0.45 μm PVDF 膜购于北京华美转导科技有限公司;完全弗氏佐剂、不完全弗氏佐剂、抗 Ig 亚型分析试剂盒(ISO1 型)购自 Sigma 公司;HAT、100 × HT、PEG 4000、RPMI-1640、IMDM 购于美国 Gibco 公司;HItrap Protein G 购自美国 Parmacia Biotech 公司;其他试剂均为国产分析纯;小鼠骨髓瘤细胞(SP2/0)为本实验室保存。
MPC-1 型微孔单光子计数仪为北京源德生物医学工程有限公司产品;蛋白电泳仪、半干转膜仪、680 型酶标仪为美国 Bio-Rad 产品;5417R 型高速冷冻离心机为德国 Eppendorf 公司产品。
1.2 方法
1.2.1 间接 ELISA CYFRA21-1 蛋白溶于0.05 mol/L pH 9.6 的 Na2CO3包被液,终浓度5 μg/ml,100 μl/孔包被微孔板,4 ℃ 过夜;弃去包被液,每孔加入含有 1% 酪蛋白的 0.02 mol/L 的PBS(pH 7.4)封闭液 300 μl,2 ~ 8 ℃ 封闭 12 ~18 h;弃去封闭液,用 0.02 mol/L PBST 洗板 3 次,拍干,常温抽干 12 ~ 18 h 后,置于密封袋中,2 ~8 ℃ 保存;直接或者用 PBST 将待测样品(血清、腹水或者细胞上清)稀释后,每孔 100 μl,37 ℃ 温育 1.5 h,PBST 洗板 5 次,拍干;用 PBST 将 HRP标记的山羊抗属 IgG 按 1:5000 倍稀释,100 μl/孔,37 ℃ 温育 1 h,PBST 洗板 5 次,拍干;TMB 显色,20 min 后,用 2 mol/L 的硫酸 50 μl/孔终止显色反应,450 nm 下测定各孔 OD 值。1.2.2 抗体制备
1.2.2.1 小鼠免疫 8 只 BLAB/c 小鼠,进行尾部采血,收集血清分别用间接 ELISA 测定小鼠血清的免疫前效价;将 CYFRA21-1 用等体积的弗氏完全佐剂混匀充分乳化,50 μg/只,背部皮下多点注射小鼠,进行初免;每间隔 3 周进行 1 次加强免疫,共计 2 次,每次 CYFRA21-1 都与等体积弗氏不完全佐剂混匀乳化,免疫量为 25 μg/只,免疫方法为背部皮下多点注射;间隔 10 d 后,对 8 只小鼠分别进行尾部采血,收集血清,通过间接ELISA 测定免疫后小鼠血清效价。
1.2.2.2 细胞融合 选取 3 次免疫后血清效价最高的小鼠,将 CYFRA21-1 溶于 PBS,按50 μg/只进行脾脏终加强免疫;3 d 后脱颈杀死加强免疫的小鼠,无菌取脾,收集脾淋巴细胞,与 SP2/0细胞在 PEG 4000 作用下进行融合;用含 1% HAT的完全 RPMI-1640 培养液进行培养筛选,于融合后的第 3、6 天进行换液处理;融合后第 7 ~ 14 天改用 HT 培养液,第 14 天后采用完全培养液;融合后第 8 天采用有限稀释法对阳性克隆进行连续筛选,待细胞集落生长至孔底 1/3 时,吸取上清用间接 ELISA 方法筛选,阳性克隆率达到 100%时,正式建株;用 ISO1 鼠 mAb 亚类检测试剂盒,按照说明书,检测制备杂交瘤细胞分泌抗体的亚型;对阳性杂交瘤细胞进行扩大培养,并液氮冷冻保存。
1.2.2.3 腹水 mAb 的制备及纯化 6 周龄雌性BALB/c 小鼠,每只腹腔注射 0.5 ml 灭菌石蜡油,每株抗体准备 2 只小鼠;7 d 后取生长良好杂交瘤细胞重悬于无血清培养基中,每只小鼠腹腔接种1 × 106个细胞;7 ~ 14 d 后,小鼠腹腔明显增大时,采集腹水;采用饱和硫酸铵法,利用 protein G 亲和柱,纯化效价较高的腹水;0.02 mol/L 的 PBS(pH 7.4)对洗脱液进行透析,将纯化好的抗体保存在PBS 中,SDS-PAGE 检测 mAb 纯度;Bradford 法测定 mAb 浓度。
1.2.3 mAb 的特性鉴定
1.2.3.1 mAb 效价测定 用已建立间接 ELISA方法测定制备的 mAb 效价。
1.2.3.2 Western blot 将 CYFRA21-1 重组蛋白溶于 0.02 mol/L 的 PBS(pH 7.4)中,制备 12% 的浓缩胶和 5% 分离胶,按 15 μg/孔上样,进行SDS-PAGE;分离浓缩胶和分离胶,15 V 电压下,电转 40 min,将分离胶上蛋白转移到 PVDF 膜;PVDF 膜浸泡在含 0.1% Tween-20 和 5% BSA 的20 mmol/L TBS 缓冲液(pH 7.4)中,4 ℃ 封闭过夜;用含 0.1% Tween-20 的 TBS 缓冲液(pH 7.4)洗膜,每次 10 min,共 4 次;用含 1% BSA 和0.1% Tween-20 的 TBS 缓冲液将纯化好的 mAb分别稀释 10 000 倍,室温浸泡 PVDF 膜 2 h 后,重复洗膜过程;用含 1% BSA 的 TBS-T 缓冲液将碱性磷酸酶标记的山羊抗鼠稀释 5000 倍作为二抗,室温浸泡 PVDF 膜 2 h 后,重复洗膜过程;加入显色底物,显色 5 min 后,用蒸馏水终止反应。
1.2.3.3 竞争 ELISA CYFRA21-1 蛋白溶于0.05 mol/L pH 9.6 的 Na2CO3包被液,终浓度50 μg/ml,100 μl/孔包被微孔板,4 ℃ 过夜;弃去包被液,每孔加入含有 1% 酪蛋白的 0.02 mol/L的 PBS(pH 7.4)封闭液 300 μl,2 ~ 8 ℃ 封闭 12 ~18 h;弃去封闭液,用 0.02 mol/L PBST 洗板 3 次,拍干,常温抽干 12 ~ 18 h 后,置于密封袋中,2 ~8 ℃ 保存;用 PBST 将待制备的 CYFRA21-1 单抗稀释至终浓度 3 μg/ml,取 50 μl 待测校准品或血清样品与 50 μl 稀释好的 mAb 共同加入 96 孔板,充分混匀,37 ℃ 温育 0.5 h,PBST 洗板 5 次,拍干;用 PBST 将 HRP 标记的山羊抗鼠 IgG 按1:5000 倍稀释,100 μl/孔,37 ℃ 温育 1 h,PBST洗板 5 次,拍干;TMB 显色,20 min 后,用 2 mol/L的硫酸 5 μl/孔终止显色反应,450 nm 下测定各孔OD 值,计算样品浓度值。
1.2.3.4 人血清 CYFRA21-1 检测 严格按照北京源德生物医学工程有限公司的 CYFRA21-1 化学发光检测试剂盒操作说明书进行。
2 结果
2.1 小鼠血清效价
如图 1 所示,将经过 3 次免疫之后,8 只小鼠血清效价都有了明显提高;以 P/N(阳性孔吸光值/阴性对照孔吸光值)≥ 2.1 为判断是否具有免疫活性的标准,1 号小鼠血清稀释 64 × 103倍,2 号小鼠血清稀释 128 × 103倍,3 号稀释 16 × 103倍,4、5 和 6 号血清稀释 512 × 103倍,7 和 8 号稀释 256 × 103倍后仍具有免疫活性;其中,4 号小鼠在 3 只血清免疫活性最高的小鼠中,在相同稀释倍数下,其 OD450吸光值最高,因此选取 4 号小鼠进行杂交瘤细胞建株。
2.2 杂交瘤细胞株的建立
将杂交瘤细胞株上清从 1:2000 开始进行倍比稀释,用间接 ELISA 方法检测,以 P/N(阳性孔吸光值/阴性对照孔吸光值)≥ 2.1 为判断是否为阳性细胞株的判断标准,共有 5 株杂交瘤细胞能持续稳定分泌 CYFRA21-1 的 mAb,其中 3F1、2G8、12G7 和 4H12 上清稀释 2048 × 103倍,1D10 上清稀释 1024 × 103倍后,都仍具有免疫活性(表 1)。经抗体亚型检测试剂盒检测,上清效价较高的 3F1、2G8、12G7 和 4H12 4 株杂交瘤细胞中,2G8、12G7 两株细胞系分泌抗体都为IgG1,轻链都为 κ,将这两株细胞分泌抗体分别命名为 2G8 和 12G7。
2.3 mAb 纯化和效价
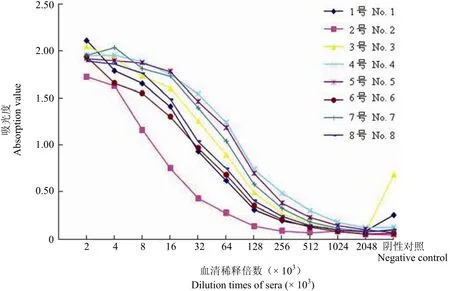
图 1 小鼠血清效价Figure 1 The titers of mice sera
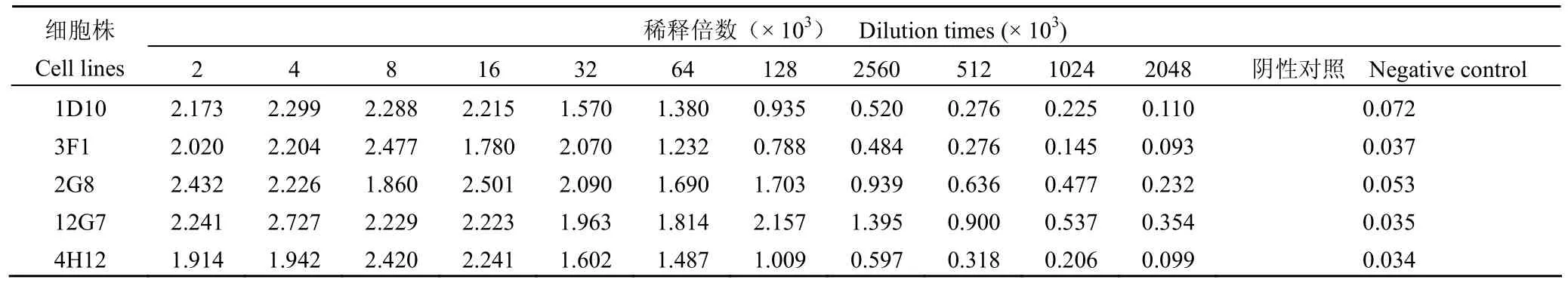
表 1 阳性杂交瘤细胞Table 1 The positive hybridoma cell
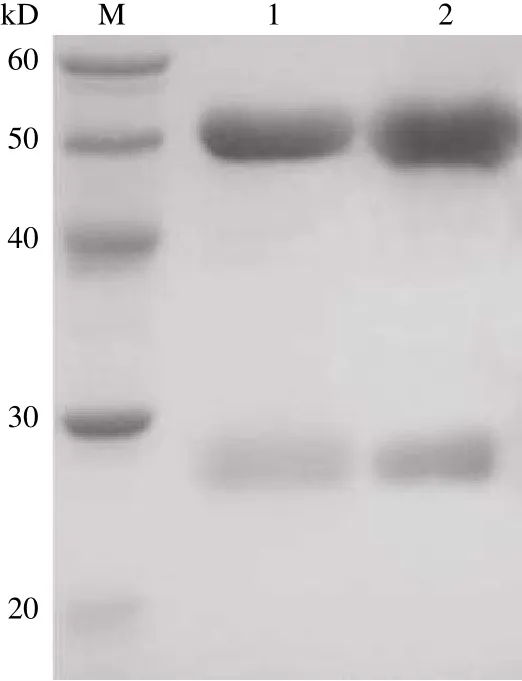
图 2 mAb 纯化Figure 2 Purification of mAb
如图 2 所示,SDS-PAGE 检测纯化后的 2G8和 12G7 两株抗体纯度都高于 95%,重链分子量约为 50 kD,轻链分子量约为 27 kD,符合理论分子量;经 Bradford 法检测,2G8 浓度为 1.2 mg/ml,12G7 浓度为 2.0 mg/ml。
用建立的间接 ELISA 方法检测,以 P/N(阳性孔吸光值/阴性对照孔吸光值)≥ 2.1 为判断阳性的标准,2G8 在稀释 1024 × 103倍时仍具有免疫活性,12G7 在稀释 2048 × 103倍时仍具有免疫活性,效价分别为 1 × 10-6和 5 × 10-7(图 3)。
2.4 mAb 特异性
Western blot 结果表明(图 4),2G8 和 12G7都能准确识别 CYFRA21-1 蛋白,产生一条分子量稍大于 30 kD 的条带,符合理论分子量大小。
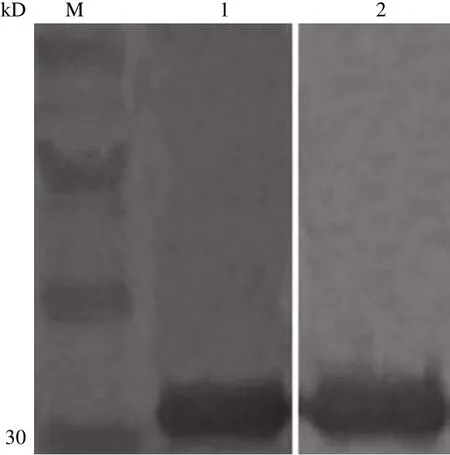
图 4 Western blot分析结果Figure 4 Analysis result of western blot
人绒毛促性腺激素(human chorionic gonadotropin,HCG)、人促卵泡激素(follicle stimulating hormone,FSH)和人促黄体生成素(luteotropic hormone,LH)是存在于血清中的CYFRA21-1 主要类似物,用含有 1% 酪蛋白、5‰Proclin-300 的 0.01 mol/L PBS(pH 7.4)作为稀释液,经竞争 ELISA 检测显示,2G8 和 12G7 与这3 种类似物交叉反应率最高只有 0.77%(表 2),表明 2G8 和 12G7 具有很高的特异性,能特异识别 CYFRA21-1,而不会与血清中其他类似物产生明显交叉反应。
2.5 人血清 CYFRA21-1 检测
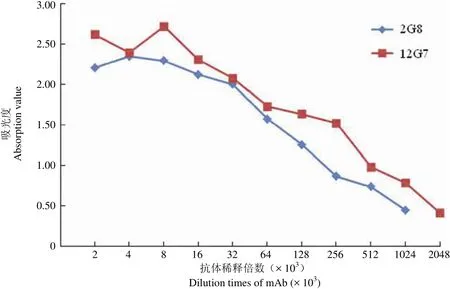
图 3 2G8 和 12G7 效价Figure 3 The titers of 2G8 and 12G7
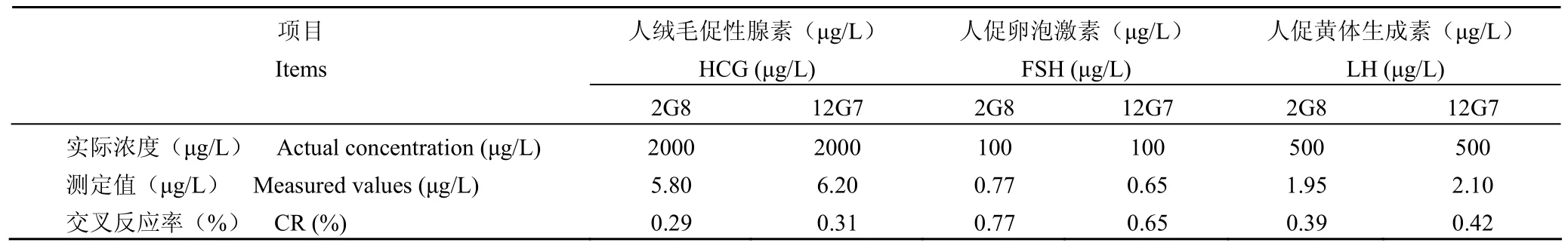
表 2 与类似物的交叉反应率Table 2 Cross reactivity (CR) with analogues
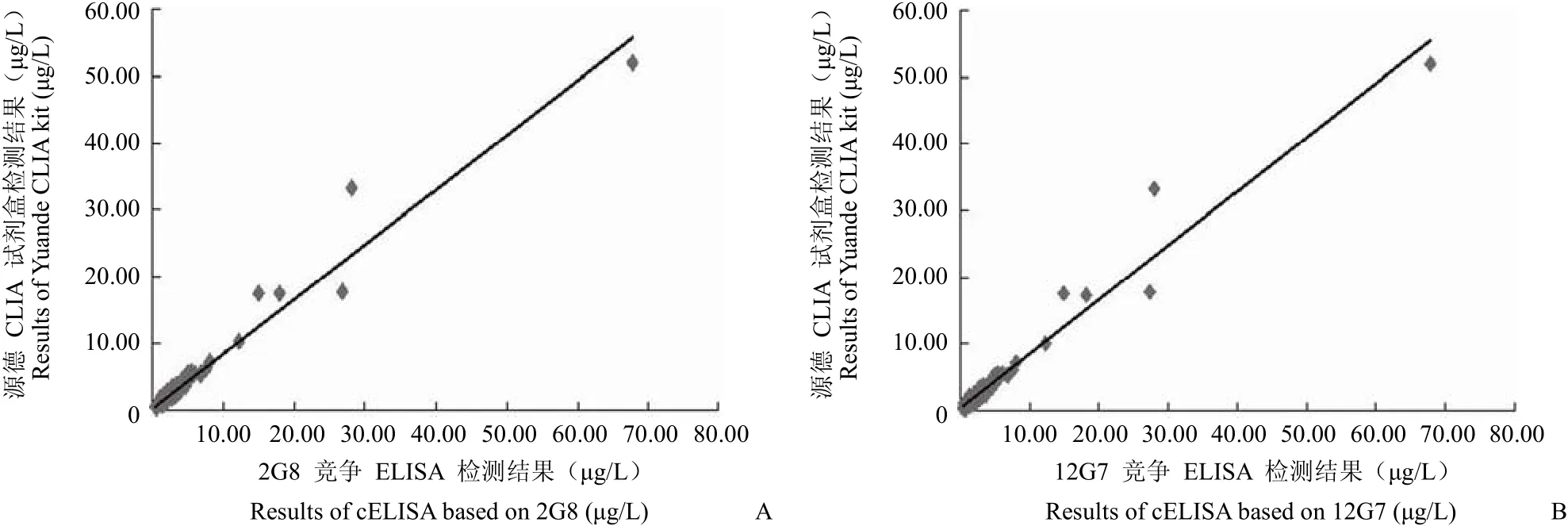
图 5 相关性分析Figure 5 The correlation analysis
用利用 2G8 和 12G7 建立的竞争 ELISA 检测方法,对来自本院的 134 份血清样本进行检测,将其结果与北京源德生物医学工程有限公司的CLIA 检测试剂盒检测结果分别比较发现,检测结果之间没有显著差异(F = 0.0908 < F临界值= 3.0183,P = 0.9132 > 0.05),线性关系分别为 y = 0.8167 x +0.3755(r = 0.9772)(图 5A)和 y = 0.8142 x +0.3655(r = 0.9770)(图 5B)。
3 讨论
癌症已经成为危害人类健康的首要疾病之一,但如果能准确诊断,并在预后对病情发展进行有效监控,能显著改善患者的生活质量,并延长患者寿命。CYFRA21-1 是 CYK-19 的可溶性片段,存在于肺癌、食管癌等上皮细胞起源的肿瘤细胞中,能被释放进入血液,是 NSCLC 的最敏感肿瘤标志物,并且与癌变程度有关,已被作为多种肿瘤诊断和预后监测标志物[10]。目前,CYFR21-1 的临床检测方法基本都是基于免疫检测平台,因此其特异mAb 的制备具有重要的实际应用价值。
1992 年,Pujol 等[4]就采用杂交瘤技术,制备出 BM19.21 和 KS19.1 两株 mAb,并被配对使用建立了 CYFRA21-1 的免疫测定方法,能够特异识别血清中的 CYFRA21-1。至今,临床上已有多种细胞角蛋白的特异 mAb 被应用到细胞角蛋白可溶性片段的免疫检测上[13]。国内有多种CYFRA21-1 免疫检测试剂盒被商品化,但所用抗体都为国外进口产品,增加了试剂盒成本。本研究通过杂交瘤技术,制备出了 2G8 和 12G7 两株CYFRA2 的 mAb,都属于轻链为 κ 的 IgG1,效价分别为 1 × 10-6和 5 × 10-7,能从血清样本中特异识别 CYFRA21-1,并且经 protein G 纯化后,纯度都高于 95%,浓度也分别达到 1.2 mg/ml 和2.0 mg/ml,利用这两种 mAb 通过竞争 ELISA 对134 份血清样本的检测结果与北京源德生物医学工程有限公司的 CYFRA21-1 化学发光定量检测试剂盒的检测结果有很好的相关性,表明这两种mAb 能代替进口 CYFRA21-1,用于 CYFRA21-1免疫诊断试剂盒完全国产化,及其生物学特性的深入研究。
[1] Alix-Panabières C, Vendrell JP, Slijper M, et al. Full-length cytokeratin-19 is released by human tumor cells: a potential role in metastatic progression of breast cancer. Breast Cancer Res, 2009,11(3):R39.
[2] Coulombe PA, Omary MB. 'Hard' and 'soft' principles defining the structure, function and regulation of keratin intermediate filaments.Curr Opin Cell Biol, 2002, 14(1):110-122.
[3] Yamamoto K, Oka M, Hayashi H, et al. CYFRA 21-1 is a useful marker for esophageal squamous cell carcinoma. Cancer, 1997, 79(9):1647-1655.
[4] Pujol JL, Grenier J, Daures JP, et al. Serum fragment of cytokeratin subunit 19 measured by CYFRA 21-1 immunoradiometric assay as a marker of lung cancer. Cancer Res, 1993, 53(1):61-66.
[5] Wang J, Zhang N, Li B, et al. Decline of serum CYFRA21-1 during chemoradiotherapy of NSCLC: a probable predictive factor for tumor response. Tumour Biol, 2011, 32(4):689-695.
[6] Tjensvoll K, Oltedal S, Farmen RK, et al. Disseminated tumor cells in bone marrow assessed by TWIST1, cytokeratin 19, and mammaglobin A mRNA predict clinical outcome in operable breast cancer patients.Clin Breast Cancer, 2010, 10(5):378-384.
[7] Bambang IF, Lu D, Li H, et al. Cytokeratin 19 regulates endoplasmic reticulum stress and inhibits ERp29 expression via p38 MAPK/XBP-1 signaling in breast cancer cells. Exp Cell Res, 2009, 315(11):1964-1974.
[8] Flores-Fernández JM, Herrera-López EJ, Sánchez-Llamas F, et al.Development of an optimized multi-biomarker panel for the detection of lung cancer based on principal component analysis and artificial neural network modeling. Expert Syst Appl, 2012, 39(12):10851- 10856.
[9] Chung GE, Lee JH, Yoon JH, et al. Prognostic implications of tumor vascularity and its relationship to cytokeratin 19 expression in patients with hepatocellular carcinoma. Abdom Imaging, 2012, 37(3):439-446.[10] Patel JL, Erickson JA, Roberts WL, et al. Performance characteristics of an automated assay for the quantitation of CYFRA 21-1 in human serum. Clin Biochem, 2010, 43(18):1449-1452.
[11] Vilardell F, Novell A, Martin J, et al. Importance of assessing CK19 immunostaining in core biopsies in patients subjected to sentinel node study by OSNA. Virchows Arch, 2012, 460(6):569-575.
[12] Singh MK, Srivastava S, Raghava G, et al. HaptenDB: a comprehensive database of haptens, carrier proteins and anti-hapten antibodies. Bioinformatics, 2006, 22(2):253-255.
[13] Rakha EA, El-Sayed ME, Green AR, et al. Prognostic markers in triple-negative breast cancer. Cancer, 2007, 109(1):25-32.
