采用三硝基苯磺酸法测定乳基婴幼儿配方奶粉中的有效赖氨酸*
2012-01-12李君艳仇凯钟其顶于晓瑾丁福强熊正河张泽生
李君艳,仇凯,钟其顶,于晓瑾,丁福强,熊正河,张泽生
1(天津科技大学食品工程与生物技术学院,天津,300457)2(中国食品发酵工业研究院,北京,100027)3(全国食品发酵标准化中心,北京,100027)
赖氨酸是人体的必需氨基酸之一,对提高婴幼儿智力,中枢神经和周围神经系统发育有重要作用[1]。婴儿配方奶粉的蛋白质含量在0.45~0.70 g/100 kJ,碳水化合物含量在2.2 g~3.3 g/100 kJ,脂肪含量在1.05 ~1.40 g/100 kJ[2];较大婴儿和幼儿配方食品中蛋白质含量为0.7~1.2 g/100 kJ,脂肪含量为0.7~1.4 g/100 kJ[3]。赖氨酸有2 个氨基——α-氨基和 ε-氨基,其结构式见图1。其中ε-氨基在婴幼儿配方奶粉加工过程(杀菌、喷雾干燥等)和贮藏过程中能与奶粉中还原糖等成分发生美拉德反应,形成Amadori产物(乳果糖基赖氨酸),这种物质不易被蛋白水解酶作用,影响消化,从而使部分赖氨酸变为无效赖氨酸,无法被机体有效利用[4]。有效赖氨酸不足时,可能对婴幼儿的健康造成危害[5],因此,婴幼儿配方奶粉中的有效赖氨酸才具有生理意义。
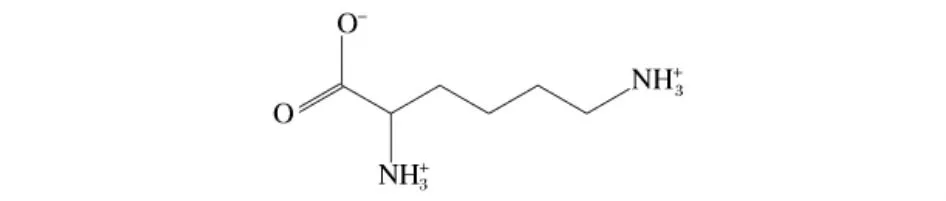
图1 赖氨酸结构式
测定有效赖氨酸的方法主要有色谱方法和化学方法。色谱方法能够摆脱机制干扰,而且线性和重复性都比较好,但需时间长而且要有专门的设备[6]。化学方法主要有FDNB(2,4-二硝基氟苯)法和TNBS(三硝基苯磺酸)法。采用FDNB法测定动物蛋白时,其有效赖氨酸的含量与蛋白质的生物价有很好的相关性。但该方法不能直接测定糖类或者还原糖含量较高的食品,因为这些物质可以与有效赖氨酸形成干扰产物,从而高估有效赖氨酸的含量。另外,在酸解过程中ε-DNP-赖氨酸的损失可能会导致低估有效赖氨酸含量。此外,FDNB方法周期较长,所用的试剂FDNB对身体有害。
蛋白质中赖氨酸的游离ε-氨基在碱性条件下与三硝基苯磺酸(TNBS)反应,生成三硝基苯蛋白质。用浓盐酸水解以后得到ε-三硝基苯赖氨酸。用乙醚萃取除去苦味酸和过量的TNBS等,在波长415 nm下测定吸光度。用标准L-赖氨酸与三硝基苯磺酸反应生成α,ε-二硝基苯赖氨酸,在酸水解时可生成ε-TNP 赖氨酸,反应如图 2[7]。

图2 TNBS与蛋白质反应
TNBS法测定含有葡萄糖、乳糖以及淀粉等含糖物质中的有效赖氨酸时,由于糖类物质的存在,会发生美拉德反应褐变以及碳化,影响测定的准确性。一方面由于碳化所产生物质的产生取决于糖类的数量,还有可能会形成黑色沉淀。这些有色物质不能用乙醚萃取除去,导致影响测定结果[8]。本文通过提纯分离婴幼儿配方奶粉中的蛋白质,减少糖类对测定结果的影响,并考察了乙醚萃取量、水解时间以及样品液与TNBS反应时间等因素对婴幼儿配方奶粉中有效赖氨酸含量测定的影响。
1 材料与方法
1.1 实验材料与仪器设备
1.1.1 实验材料
婴幼儿配方奶粉:市售以及厂家提供,其中国内0~6月龄段样品5种品牌,6~12月龄段样品5种,12~24月龄段样品5种品牌,国外0~6月龄段样品2种品牌。
1.1.2 主要试剂及配制
主要试剂:赖氨酸标准品(纯度≥99.0%,北京索莱宝科技有限公司);5%三硝基苯磺酸(简称TNBS,Sigma-Aldrich);三氯乙酸(分析纯,天津市福晨化学试剂厂);氢氧化钠、碳酸氢钠、浓盐酸、乙醚(北京化工厂),均为分析纯。
主要试剂配制:
(1)0.15 g/mL三氯乙酸(TCA)溶液:准确称取TCA 15g,用蒸馏水定容至100 mL。
(2)0.1%三硝基苯磺酸(TNBS):0.5 mL 5%TNBS用蒸馏水定容至25 mL。
(3)赖氨酸标准溶液:准确称取L-赖氨酸标准品10 mg用0.25%氢氧化钠溶液溶解并定容至25 mL。
1.1.3 仪器设备
UV-2450紫外分光光度计TCC-240A,SHIMADZU Corporation;分析天平 AB204-N,TOLE DO;天平XS205,METTLER TOLEDO;水浴锅 Thermostar-95,浙江省轻工业研究所;涡旋振荡器WH-861,太仓市科教器材厂;Sigma-3K15台式冷冻离心机,Sigma;HC-3518高速离心机,安徽中科中佳科学仪器有限公司;电热恒温干燥箱,上海一恒科学仪器有限公司。
1.2 试验方法
1.2.1 样品前处理
准确称取奶粉样品1.0 g(精确到0.1 mg)3份,用5 mL水溶解,4℃,4 000 r/min离心10 min。取下层清液1 mL,加入1 mL蒸馏水,8 mL 0.15 g/mL TCA溶液,涡旋混匀2 min,静置15 min,5 000 r/min离心15 min,沉淀即为蛋白质。将沉淀用0.25%氢氧化钠溶液定容至10 mL,4℃冰箱贮存备用。
1.2.2 样品测定
移取0.3 mL样品提取液于具塞螺纹管中,加入0.7 mL蒸馏水,然后加入1 mL 4%NaHCO3溶液,40℃水浴10 min,冷却至室温,加入1 mL 0.1%TNBS溶液,40℃水浴2 h,取出冷却至室温,加入3 mL浓HCl摇匀封管,于烘箱中110℃水解2 h,取出冷却至室温,加蒸馏水定容至10 mL,涡旋振荡混合均匀。取3 mL水解液于10 mL离心管中,加入4 mL乙醚萃取,涡旋振荡1 min,静置分层,用吸管除去乙醚层,再用4 mL乙醚萃取1次,用吸管吸至离液面2 mm处,60℃水浴除去残留的乙醚,415 nm测定吸光值。同时做样品空白,在加入TNBS溶液之前加入3 mL浓HCl,其他实验步骤与上述步骤相同[7,9-11]。
1.2.3 标准曲线的绘制
分别吸取蒸馏水1 mL(标准品空白)、50、100、200、300、350、400 μL 标准赖氨酸溶液于具塞螺纹管中,除空白,依次加入 950、900、800、700、650、600 μL 0.25%NaOH溶液,其他操作同1.2.2。以吸光度为纵坐标,赖氨酸浓度mg/mL为横坐标,绘制标准曲线。
1.3 蛋白质的测定
采用GB 5009.5-2010食品中蛋白质的测定方法。
2 结果与讨论
2.1 前处理方法优化
由于三氯乙酸和卡氏试剂是效果较好的蛋白沉淀剂,因此分别采用三氯乙酸(TCA)和卡氏试剂对样品进行前处理[11-13],并进行加标实验,计算加标回收率。
采用TCA沉淀法:准确称取奶粉样品0.2 g(精确到0.1 mg),用2 mL水溶解,加入8 mL 0.15 g/mL TCA溶液,4℃ 4 000 r/min离心15 min,沉淀即为蛋白质。将沉淀用10 mL 0.25%NaOH溶解,得蛋白质溶液。
卡氏试剂法:准确称取奶粉样品0.2 g,用0.9 mL水溶解,加入1 mL乙腈混匀,加入50 μL CarrezI(亚铁氰化钾80 mmol/L)混匀,再加入50 μLCarrezII(硫酸锌250 mmol/L)混匀,4℃,4 000 r/min离心15 min,沉淀即为蛋白质。将沉淀用 10 mL 0.25%NaOH溶解,得蛋白质溶液。
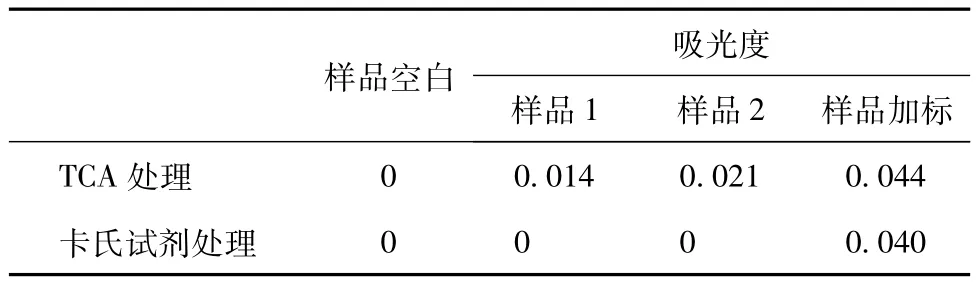
表1 两种前处理方法结果

表2 TCA处理的样品加标回收率
表2结果可知,使用卡氏试剂处理的样品中并未测到样品中含有的赖氨酸,推测可能在前处理过程中对赖氨酸造成了损伤,可见卡氏试剂并不适合样品中赖氨酸的测定。采用TCA处理的样品其回收率为86%。因此采用15%TCA对样品进行前处理。
采用SDS-PAGE方法对TCA沉淀蛋白以及上清液分别进行分析。按1.2.1平行处理2份样品,分别得到样品沉淀和上清液。分别称取3 mg样品沉淀,溶于1 mL不连续电泳样品缓冲液(0.08 mol/L Tris-HCl,pH 6.8),上清液与缓冲液体积比1∶1。采用不连续聚丙烯酰胺凝胶电泳(SDS-PAGE),浓缩胶浓度为5%,分离胶浓度为15%,电泳上样量为10 μL,浓缩胶电压50 V,分离胶电压120 V(溴酚蓝距离边界1 cm停止),电泳结束后胶片固定1h,考马斯亮蓝R250染色,40℃摇床染色4 h,染色结束后脱色至背景色无色,凝胶成像仪拍照,最后利用Bio-Rad Quantity One和SPSS统计分析软件进行电泳图谱分析[4]。由图3可见,上清液中未见蛋白质,因此利用15%浓度的TCA可以完全沉淀蛋白质。
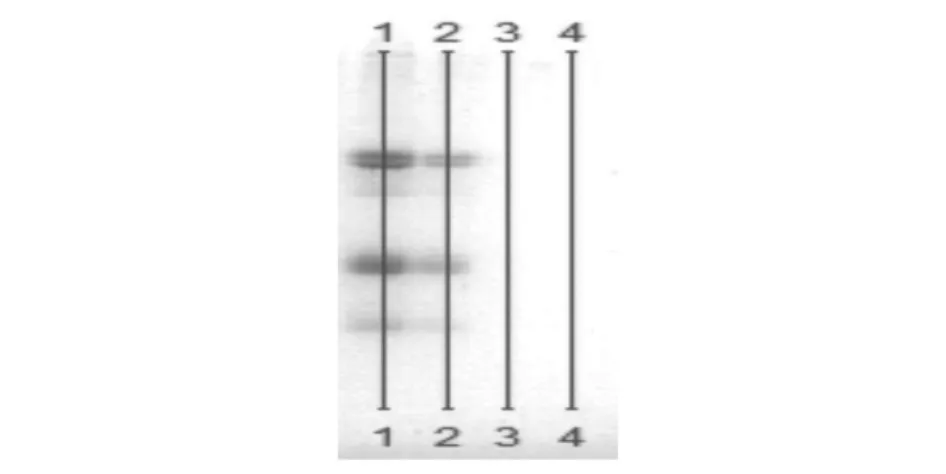
图3 SDS-PAGE分析TCA沉淀蛋白以及上清液

表3 除去大部分脂肪后样品的回收率
由于样品中含有较高含量的脂肪,干扰结果的测定,因此前处理过程中使用4 000 r/min,4℃,离心10 min除去样品中含有的大部分脂肪,并进行回收率测定实验,回收率在85% ~120%。
2.2 参数优化
2.2.1 乙醚用量对吸光度的影响
用乙醚萃取的可溶性有色物质,包括过量的TNBS、α-TNP赖氨酸,以及水解过程中产生的苦味酸等。它们均为黄色物质,影响ε-TNP赖氨酸的测定,而且ε-TNP赖氨酸和ε-TNP肽均不溶于乙醚,只存在于水相中,因此采用乙醚作为萃取溶剂。由图2可知,随乙醚量的增加,萃取越彻底;当乙醚量为4、5、6 mL时吸光值达到最低且趋于平稳,选择最佳乙醚量为4 mL。
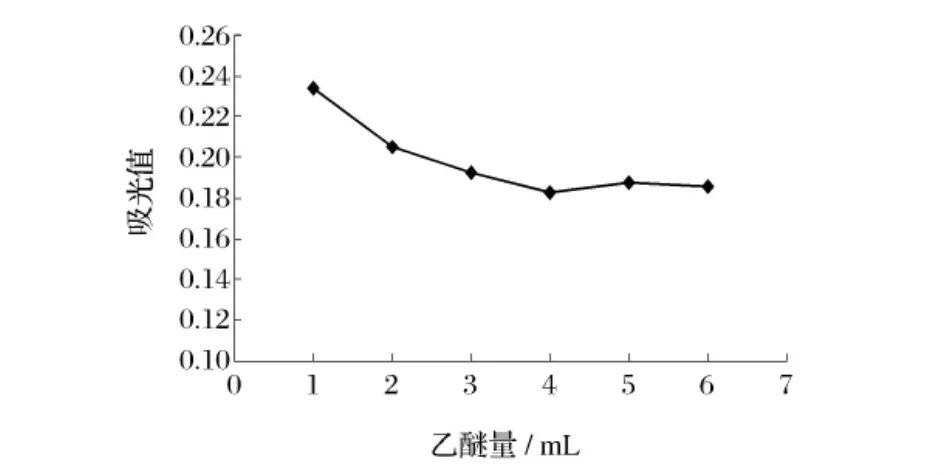
图4 乙醚萃取量对有效赖氨酸吸光度的影响
2.2.2 水解时间对吸光度的影响
选择乙醚萃取量为4 mL,其他条件保持不变,改变样品在烘箱中的水解时间 30、60、90、120、150、180 min,415 nm测定吸光值。由图3可见,在反应初始阶段,溶液的吸光度随着时间的增加逐渐升高,水解120 min吸光值达到最大,反应时间超过120 min以后吸光值基本保持不变。在不影响吸光度的前提下,选择最佳水解时间为120 min。

图5 水解时间对有效赖氨酸吸光度的影响
2.2.3 样品液与TNBS反应时间对吸光度的影响
根据上述优化条件,其他条件保持不变,改变与样品液与TNBS的反应时间,分别在30、60、90、120、150 min测定样品的吸光值。
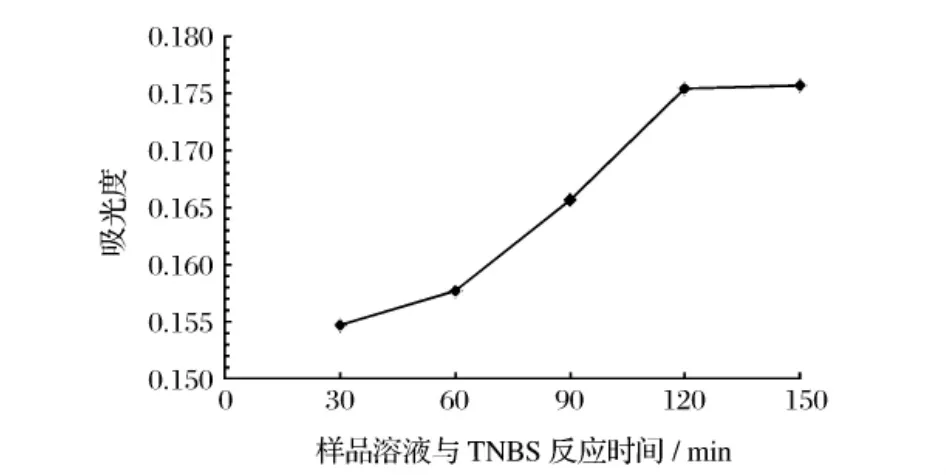
图6 样品液与TNBS反应时间对吸光度的影响
由图6可知,在反应的初始阶段,吸光值随样品液与TNBS反应时间的增加而升高,当反应时间为120 min时,吸光值达到最大120 min以后,吸光值基本保持不变。选用样品液与TNBS最佳反应时间为120 min。
2.3 方法的线性、检出限和定量限
在赖氨酸浓度为0.02~0.12 mg/mL内,线性良好,相关系数R2=0.999 3。检出限为3.72 μg/mL,定量限为 10.23 μg/mL。

图7 赖氨酸标准曲线
2.4 方法回收率以及重复性
用空白样品加标的方法计算回收率以及精密度。对同一样品分别进行3个水平的加标,每个水平做3份平行,添加水平分别为为 0.024 48、0.048 96、0.073 44 mg/mL,平行测定3次,在相同的条件下测定吸光值。可知,当加标量在0.024 48~0.073 44 mg/mL时,样品加标回收率在86% ~115%,精密度相对标准偏差RSD在0.17% ~2.34%,样品重复性相对标准偏差RSD为1.55%~5.57%。因此该方法可以用于测定婴幼儿配方奶粉中有效赖氨酸的含量。
2.5 样品测定
采集国内外市场以及商家提供的不同品牌的婴幼儿配方奶粉17个,对其有效赖氨酸含量进行测定,结果见表1。WHO/FAO(世界卫生组织和粮农组织)推荐婴儿有效赖氨酸需求模式为0.5岁婴儿:57 mg/g蛋白质;1~2岁婴幼儿:52 mg/g蛋白质。膳食中氨基酸含量过高或过低均会影响蛋白质的营养质量[15]。表1样品数据分析显示,国内不同月龄婴幼儿配方食品中有效赖氨酸均符合低限要求,某些样品中有效赖氨酸的含量达96 mg/g蛋白质。正常膳食中大量加入一种氨基酸可导致动物进食量下降与严重的生长障碍,而大量的赖氨酸会导致脑中异亮氨酸、亮氨酸以及精氨酸耗竭[15]。
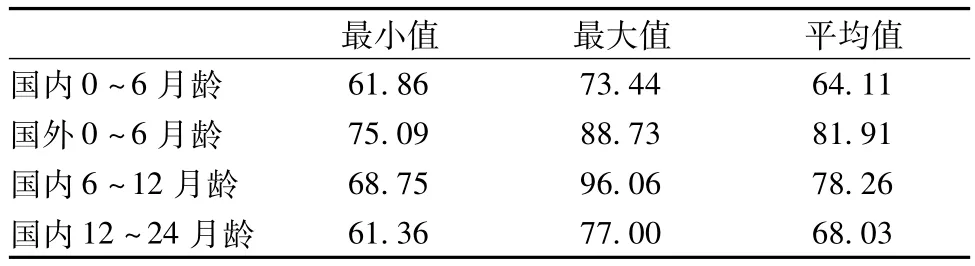
表4 国内外婴幼儿配方奶粉中的有效赖氨酸含量 mg/g蛋白质
3 结论
本文建立了婴幼儿配方奶粉中有效赖氨酸测定方法——三硝基苯磺酸法,采用蛋白质提纯法降低糖类对有效赖氨酸含量的影响;通过单因素试验,得到最佳乙醚萃取量为4 mL,水解时间为2 h,TNBS孵化时间为2 h。该法线性范围0.02~0.12 mg/mL,检测限为3.72 μg/mL ,定量限为10.23 μg/mL,重复性良好,RSD为1.55% ~5.57%,回收率为86% ~115%。对市场抽样分析显示,国内不同月龄婴幼儿配方食品中有效赖氨酸均符合WHO/FAO标准低限要求,某些样品中有效赖氨酸的含量达96 mg/g蛋白质。
[1] Mauron J.The Maillard reaction in food;a critical review from the nutritional standpoint.[J].Progress in Food &Nutrition Science,1981,5(1 -6):5.
[2] GB 10765-2010.食品安全国家标准婴儿配方食品[S].
[3] GB 10767-2010.食品安全国家标准较大婴儿和幼儿配方食品[S].
[4] Moughan P J,Rutherfurd S M.Available Lysine in Foods:A Brief Historical Overview[J].Journal of AOAC International,2008,91(4):901 - 906.
[5] El S N,Kavas A.Available lysine in dried milk after processing[J].International Journal of Food Sciences and Nutrition,1997,48(2):109 -111.
[6] Hurrell R F,Finot P A,Ford J E.Storage of milk powders under adverse conditions[J].British Journal of Nutrition,1983,49(3):343 -354.
[7] Hall R J,Trinder N,Givens D I.Observations on the use of 2,4,6-trinitrobenzenesulphonic acid for the determination of available lysine in animal protein concentrates[J].Analyst,1973,98(1 170):673 - 686.
[8] Hall R J,Henderson K.Communications.An improvement in the determination of available lysine in carbohydrate-rich samples[J].Analyst,1979,104(1 244):1 097-1 100.
[9] Eklund A.On the determination of available lysine in casein and rapeseed protein concentrates using 2,4,6-trinitrobenzenesulphonic acid(TNBS)as a reagent for free epsilon amino group of lysine[J].Analytical Biochemistry,1976,70(2):434 -439.
[10] Obi I U.Application of the 2,4,6-trinitrobenzene-1-sulfonic acid(TNBS)method for determination of available lysine in maize seed[J].Agricultural and Biological Chemistry,1982,46(1):15 -20.
[11] Yun J J,Barbano D M,Kindstedt P S,et al.Mozzarella Cheese:impact of whey pH at draining on chemical composition,proteolysis,and functional properties1[J].Journal of Dairy Science,1995,78(1):1 -7.
[12] Chavez-Servin J L,Castellote A I,Lopez-Sabater M C.Analysis of mono-and disaccharides in milk-based formulae by high-performance liquid chromatography with refractive index detection[J].Journal of Chromatography A,2004,1 043(2):211-215.
[13] Cataldi T R I,Angelotti M,Bianco G.Determination of mono-and disaccharides in milk and milk products by high-performanceanion-exchange chromatography with pulsed amperometric detection[J].Analytica Chimica Acta,2003,485(1):43 -49.
[14] 郭尧君.SDS电泳技术的实验考虑及最新进展[J].生物化学与生物物理进展,1991,18(1):32-37.
[15] 朱圣陶,吴坤.蛋白质营养价值评价——氨基酸比值系数法[J].营养学报,1988,10(2):187-190.
