麦芽糊精摩尔质量分布对β-环糊精合成的影响*
2011-12-18靳蓉顾正彪洪雁程力李兆丰
靳蓉,顾正彪,洪雁,程力,李兆丰
1(江南大学食品科学与技术国家重点实验室,江苏无锡,214122) 2(江南大学食品学院,江苏 无 锡,214122)
麦芽糊精摩尔质量分布对β-环糊精合成的影响*
靳蓉1,2,顾正彪1,2,洪雁2,程力2,李兆丰2
1(江南大学食品科学与技术国家重点实验室,江苏无锡,214122) 2(江南大学食品学院,江苏 无 锡,214122)
环 糊精是一类广泛应用于食品、医药、化工、农业等领域的环状低聚糖。文中研究了以麦芽糊精为底物,其摩尔质量分布对β-环糊精(β-CD)合成的影响。通过GPC分析,运用Sephacryl 200-HR和Sephacryl 400-HR2种凝胶分析麦芽糊精的摩尔质量分布,通过高效液相色谱法(HPLC)分析其小分子糖组成。结果表明:不同葡萄糖值(DE值)的麦芽糊精具有明显不同的分子组成,随着DE值升高,麦芽糊精分子的分支化程度逐步升高,分子链长减小,小分子糖含量呈上升趋势;生产工艺不同可引起DE值相近的麦芽糊精出现摩尔质量分布的较大差异;麦芽糊精分子组成可影响β-CD的合成,应用适当链长的底物在一定程度上可促进环化反应,链长过长易引起歧化反应,而链长过短则会导致β-CD因耦合反应而降解;β-CD的转化率随麦芽糊精分子分支化程度的升高而降低,重均摩尔质量约在(MW)43 053~18 793 g/mol左右且分支较少的线性麦芽糊精分子可认为是环化反应的最适底物。
环 糊精,环糊精葡萄糖基转移酶,麦芽糊精,分子摩尔质量分布
环糊精(cyclodextrin,CD)是D-吡喃葡萄糖基通过以α-1,4糖苷键连接而成的环状低聚糖,其中常见的是聚合度(DP 值)为 6,7 和 8 的 α-,β-和 γ-CD[1]。由于具有内疏水外亲水的结构特征,这种独特的分子结构可以使它通过范德华力、疏水作用力以及主客体分子之间的空间匹配效应,与一些电荷、极性、结构、性质相匹配的客体分子或基团形成超分子包合物,因而被广泛应用于食品、农业、化工等领域[2]。目前,CD主要是由环糊精葡萄糖基转移酶(CGTase,EC2.4.1.19)作用于淀粉等底物,通过环化反应而得到,同时该酶还可发生耦合、歧化、水解等三类反应,反应产物除 α-、β-和 γ-CD 外,主要有葡萄糖、麦芽糖、麦芽三糖及其他糊精等多种物质[3]。
β-CD合成的底物主要是淀粉,但实际生产中应用的高浓度的淀粉在糊化后黏度较大,不易搅拌均匀,故在生产开始阶段均使用液化酶对淀粉糊进行降解以降低其黏度。但液化时所产生的小分子糖会促进CD的耦合及歧化反应,引起CD转化率的降低[4-5]。研究者就解决该问题进行了大量的研究,Yano等[6]人通过控制淀粉水解程度来提高CD转化率。Masanobu等人[7]选用CGTas作为液化酶以减少淀粉的降解程度,增加CD的转化率[6]。但淀粉液化后的分子组成及其对CD合成的影响则未见报道。研究证明[8-10],淀粉液化程度的不同可引起淀粉液化产物摩尔质量分布的明显差异。不同液化工艺条件及水解酶也会使得液化产物的分子组成发生变化。这种因淀粉液化工艺不同而造成的液化产物分子组成差异可能会对β-CD转化率产生一定影响。本研究选用具有不同DE值的麦芽糊精作为底物合成β-CD,研究其摩尔质量组成及其分子分布对CD转化率的影响。
1 材料与方法
1.1 实验材料
麦芽糊精(DE3.84、DE5.01、DE13.5),罗盖特(中国)精细化工有限公司提供;麦芽糊精(DE5.80、DE15.0),长春大成新资源集团有限公司提供;玉米淀粉,山东诸城兴贸玉米开发有限公司提供;高温α-淀粉酶(GC262 SP),杰能科(中国)生物工程有限公司提供;环糊精葡萄糖基转移酶,曲阜市天利药用辅料有限公司提供;β-CD标准品,Sigma-Aldrich公司提供;Dextran standard(Mw5 220、Mw23 800、Mw,48 600、Mw70 000、Mw180 000):Sigma-Aldrich公司提供;Sephacryl 200-HR、Sephacryl 400-HR 凝 胶,Sigma-Aldrich公司提供。
实验所用试剂均为分析纯。
1.2 实验仪器
UV-2000型分光光度计,尤尼柯(上海)仪器有限公司;DSHZ-300多用水浴恒温振荡器,江苏太仓试验设备厂;旋转式恒温振荡器,太仓市实验设备厂;16×1 200 mm系列层析柱,上海沪西仪器厂;SBS-160数控计滴自动部分收集器,上海沪西仪器厂;BT100-2J恒流泵,保定兰格恒流泵公司;Waters 600高效液相色谱系统:美国Waters公司;Sugarpak色谱柱,美国Waters公司;Waters2410示差折光检测器,美国Waters公司。
1.3 实验方法
1.3.1 β-CD含量测定[11]
分别移取 1 mL质量浓度为 0.05、0.10、0.15、0.20 mg/mL的β-CD标准溶液于试管中,各加入3.5 mL 0.3 mol/L NaOH溶液和0.5 mL 2 g/L酚酞溶液,混匀,室温下静置20 min,在553 nm下测定溶液吸光度,绘制标准曲线。
测定样品时,将样品稀释100倍,准确移取稀释液1 mL,加入3.5 mL 0.3 mol/L NaOH溶液和0.5 mL 2 g/L酚酞溶液,混匀,室温下静置20 min,在553 nm下测定溶液吸光度,通过标准曲线计算β-CD含量。
1.3.2 CGTase酶活性测定[12]
准确吸取1.0 mL质量分数4%可溶性淀粉溶液(称取一定量可溶性淀粉,溶于pH值8.5,0.2 mol/L甘氨酸-NaOH缓冲液)于试管中,加入酶液0.1 mL,振荡,于40℃下反应10 min后煮沸灭活。以预先灭活的酶液为对照组,测定β-CD的含量。
一个酶活单位定义为在上述条件下每分钟生成1 μmol β-CD所需的酶量(β-CD摩尔质量以1 135 g/mol计)。测得本研究中使用的CGTase的酶活为3 U/mL。
1.3.3 不同DE值底物对β-CD合成的影响
分别称取一定量不同DE值麦芽糊精样品,溶于pH值8.5,0.2 mol/L甘氨酸-NaOH缓冲液,配制成质量分数5%溶液,并加入适量的CGTase,置于40℃的摇床中120 r/min反应12 h,沸水浴20 min灭酶,按照1.3.1中方法测定β-CD的含量。
1.3.4 不同液化条件制备所得的麦芽糊精对β-CD合成的影响
配制质量分数为5%~20% 的淀粉浆溶液,加入适量高温α-淀粉酶,于pH值6.2、95℃下反应一定时间,制得DE值约为5的麦芽糊精,通过调节pH值终止反应。
调节制得的麦芽糊精溶液质量分数至5%,pH值至8.5,加入适量CGTase,置于40℃的摇床中120 r/min反应12 h,沸水浴20 min灭酶,按照1.3.1中方法测定β-CD的含量。
1.3.5 凝胶过滤色谱(GPC)测定麦芽糊精摩尔质量分布
1.3.5.1 样品处理
配制2.5 mg/mL的麦芽糊精溶液,于3 000 r/min下离心10 min,取上清液备用。
1.3.5.2 色谱条件
固定相:Sephacryl 200-HR(摩尔质量范围:1×103~8×104);Sephacryl 400-HR(摩尔质量范围:1×104~2×106);层析柱:16 mm ×1,200 mm 玻璃层析柱;上样量:2 mL(2.5 mg/mL);流动相:0.04%叠氮钠溶液;洗脱速度:11.2 mL/h;收集时间15 min。
1.3.5.3 分子摩尔质量测定工作曲线的绘制
将 Dextran standard Mw5 220、Mw23 800、Mw、48 600、Mw70 000和Mw180 000)按照上述条件分别在Sephacryl 200-HR和Sephacryl 400-HR上进行测定,得到对应的洗脱时间值t,以样品分子摩尔质量的对数值lgM为纵坐标,洗脱时间t为横坐标,作图计算得到Sephacryl 200-HR上的工作曲线:lgM=6.428-0.004 t(R2=0.996)和Sephacryl 400-HR上的工作曲线:lgM=6.059-0.002t(R2=0.973)。
1.3.5.4 测定方法
总糖:苯酚-硫酸法,1 mL样品与1 mL质量分数5%苯酚混合,在振荡时加入5 mL浓H2SO4,冷却至室温后于490 nm测定吸光度[13]。
分支化程度的测定:取1 mL样品与1 mL碘液混合,分别于波长525、640 nm下测定游离I2含量和结合碘含量。A525,间接表示不与碘复合的分支化程度较高的支链分子量,A640,间接表示直链淀粉量。故A640/A525可间接表示组分中支链与直链分子的比例,即多糖分子的分支化程度。若A640/A525大于1.5可认为是线性分子[14]。
1.3.6 高效液相色谱(HPLC)测定麦芽糊精小分子糖[15]
1.3.6.1 样品处理
配制5 mg/mL不同 DE值麦芽糊精溶液,于3 000 r/min下离心10 min取上清液上样。
1.3.6.2 洗脱条件
柱温:85 ℃,进样量:10 μL,流动相:纯水,流速:0.4 mL/h。
2 结果与讨论
2.1 不同DE值的麦芽糊精对β-CD转化率的影响
以 DE值分别为DE3.84(R1)、DE5.01(R2)、DE5.84(C1)、DE13.5(R3)和 DE15.0(C2)的麦芽糊精作为底物合成β-CD,转化率如图1所示。由图1可知,高β-CD转化率的样品均具有较低的DE值,β-CD合成底物的最适DE值为5左右。但对比2种具有此DE值的样品C1和R2,C1却明显具有较高的β-CD转化率。

图1 以不同麦芽糊精作为底物合成β-CD的转化率
2.2 不同液化条件制备所得的麦芽糊精对β-CD转化率的影响
由2.1中图1可以看出,β-CD合成底物的最适DE值为5左右,但来源不同的麦芽糊精却具有差异较大的β-CD转化率,而产生这一差异的原因可能是由于2种样品的生产过程中的液化条件存在差异。为研究不同液化条件对麦芽糊精分子摩尔质量组成及β-CD转化率的影响,并进一步验证麦芽糊精分子组成与β-CD转化率的关系,本实验采用不同液化条件制备得到一系列DE值约为5左右的麦芽糊精,分别为 DE5.01(P1)、DE5.75(P2)、DE5.27(P3)、DE5.26(P4)和DE5.08(P5)。以其作为底物合成β-CD,其结果如图2所示。

图2 以不同液化条件制备所得DE值相近的麦芽糊精合成β-CD的转化率
可以看出,以上DE值约为5的样品表现出了不同的β-CD转化率。特别是P1与P5、P3与P4的DE值几乎相同,但β-CD转化率则存在较大区别。因而可以推断,液化条件的不同可能会通过改变麦芽糊精的分子摩尔组成,进而影响β-CD的合成。
2.3 Sephacryl 200-HR测定不同DE值麦芽糊精摩尔质量分布
为了考察不同样品的摩尔质量分布,将不同DE值的麦芽糊精分别上样分析,结果如图3、图4所示。通过工作曲线计算得到各主要洗脱峰的分子摩尔质量如表1所示。

图3 R1、R2和C1在Sephacryl 200-HR上的洗脱曲线

表1 麦芽糊精在Sephacryl 200-HR上洗脱曲线各组分的摩尔质量
由图3可见,样品R1、R2及C1的主要组分均在空体积处流出,表明以上3种低DE值样品中存在大量摩尔质量较高(>Mw79 000 g/mol)的大分子多糖,采用Sephacryl 200-HR为固定相无法实现完全的分级分离,因而,必须使用分离范围更大的凝胶进行进一步洗脱。此外,R1和C2均具有一摩尔质量较小的洗脱峰,分别约为Mw4 345 g/mol和Mw547g/mol。这表明低DE值麦芽糊精并非均由摩尔质量分布均匀的大分子构成,而是存在一定量的小分子糖组分。与低DE值样品类似,DE值大于10的2样品R3和C2的主要组分为稍后流出的摩尔质量较低的多糖,摩尔质量分别为Mw3 784 g/mol和Mw1 439 g/mol。
不同DE值的麦芽糊精在Sephacryl 200-HR上各洗脱组分的分支化程度如图5所示。随着DE值的升高,样品的分支化程度逐渐升高。这是由于随着淀粉水解程度的增加,淀粉形成分支较多的短链分子片段。如图5所示,C1的线性程度明显高于其余样品,根据GPC分析推断其主要成分为分支较少的线性长链多糖。

图4 R3和C2在Sephacryl 200-HR上的洗脱曲线
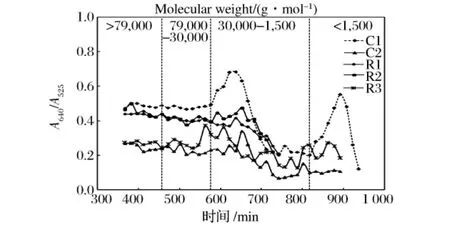
图5 R1、R2、R3、C1和 C2的分支化程度曲线
2.4 Sephacryl 400-HR测定不同DE值麦芽糊精摩尔质量分布
由于在Sephacryl 200-HR上不能充分反应C1、R1、R2的大分子组分的分布,因而以Sephacryl 400-HR为固定相,得到洗脱曲线(图6)。通过工作曲线计算得到各洗脱峰的摩尔质量如表2所示。
C2包括2个主要洗脱峰:支链较长的大分子组分(Mw43 053 g/mol)和分支程度较高的小分子组分(Mw14 256 g/mol)。R1和R2的洗脱曲线中均具有较多大分子组分(>Mw150 000 g/mol)。由于两者的生产工艺条件及水解酶种类相同,因而其分子组成较为类似,主要由摩尔质量Mw60 000~20 000 g/mol的多糖构成。但R2的DE值较高,水解程度较大,因此比R1多一个摩尔质量约为Mw43 053 g/mol的较大洗脱峰。

图6 R1、R2和C1在Sephacryl 400-HR上的洗脱曲线

表2 麦芽糊精在Sephacryl 400-HR上洗脱曲线各组分的摩尔质量
2.5 Sephacryl 400-HR测定不同液化条件制备所得DE值相近的麦芽糊精摩尔质量分布
以Sephacryl 400-HR对不同液化条件制备所得DE值相近的麦芽糊精进行分析,结果如图7、图8所示。通过工作曲线计算得到各洗脱峰的摩尔质量如表3所示。

图7 P1、P2和P3在Sephacryl 400-HR上的洗脱曲线

图8 P4和P5在Sephacryl 400-HR上的洗脱曲线
如图1所示,P1~P5虽具有相近的DE值,但其分子摩尔质量分布则并不完全相同,由于液化条件的不同,即使DE值几乎相同(P1与 P5、P3与 P4),其分子摩尔质量分布也存在着较大差异。P2的洗脱曲线较为集中,主要由摩尔质量为Mw30 479~18 793 g/mol的分子链长适中的组分构成。P4和P5的洗脱曲线中则出现了摩尔质量较大的洗脱峰(>Mw69 823 g/mol),而且两者的分子摩尔质量分布较为分散,同时具有一定量摩尔质量分别为Mw11 588 g/mol和Mw18 793 g/mol的短链分子组分。P1和P3的分子摩尔质量整体偏小,含有较多具有相对较小分子摩尔质量(<Mw16 368 g/mol)的组分。由此可见,液化工艺的不同,会引起麦芽糊精的分子摩尔质量分布出现较为明显的区别。

表3 淀粉水解物在Sephacryl 400-HR上洗脱曲线各组分的摩尔质量
2.6 HPLC分析麦芽糊精小分子糖组分
由于麦芽糊精中摩尔质量较小的组分在GPC中很难充分分离,因而使用HPLC对其进行分析,分析结果如表4所示。
从表4中可看出,随着DE值的增大,样品中的单糖、二糖及五糖以下等小分子糖组分明显增多,而大分子组分则逐渐减少。C2和R3具有明显较高的小分子糖含量,占总糖含量的15%左右。而其余低DE值样品的小分子糖组分均不足5%,且其中单糖和二糖含量极少,仅存在较少的三至五糖。
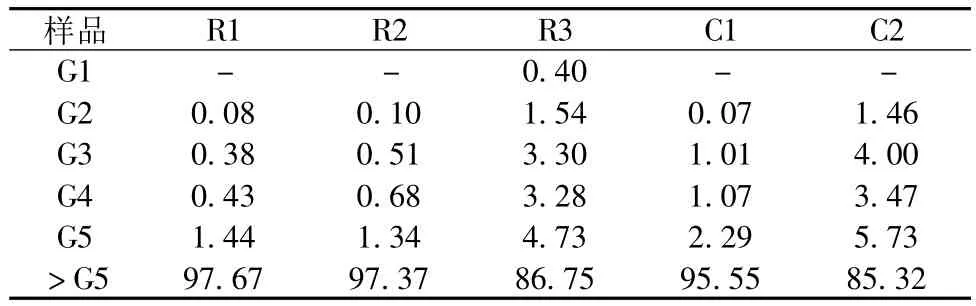
表4 不同DE值麦芽糊精的小分子糖组分
2.7 麦芽糊精的摩尔质量分布对β-CD合成的影响
由GPC及HPLC分析结果可知,低DE值样品C2和R3含有较多低摩尔质量组分。当有适量的单糖或二糖受体作为共生底物存在于反应体系中时,CGTase将催化发生分子间转糖基反应,将β-CD或线性麦芽低聚糖转化为单糖和二糖[10],因此C2和R3中高比例的低摩尔质量组分可抑制CGTase的环化反应,同时促进其催化合成较多麦芽低聚糖,从而降低β-CD的转化率。
由图1可知,DE值接近的R2和C1的β-CD转化率差异较大。GPC分析显示,R2和C1具有明显不同的分子分布。相对于同样具有大分子组分的R1、R2而言,C1中主要组分的分子摩尔质量较小(Mw43 053~14 256 g/mol),但明显高于2种高DE值样品C2和R3。曾有报道[10],具有一定分子链长的底物有助于促进环化反应的进行。因而主要由短链多糖构成的C2和R3表现出较低的β-CD转化率。R1、R2主要由链长过长的大分子多糖构成,反应初期主要发生歧化反应,当底物链长到达合适程度后,环化反应方可占据主导[11]。而且歧化反应中产生的小分子多糖由于链长过短不仅不适于进行环化反应,而且会通过耦合反应引起β-CD的降解。C1中的大部分组分分子链长适中,较适宜环化反应的进行,且避免了其他分子间转糖基反应对β-CD合成的干扰,从而可获得较高的β-CD转化率。
通过使用不同液化条件制备一系列DE值约为5的样品,并对其分子摩尔质量分布和β-CD转化率进行分析,同样获得类似的结论。结合图2和图7、图8可以看出,由于其主要组分与C1类似,分子链长适中(Mw30 479~18 793 g/mol),P2具有5个样品中最高的β-CD转化率。与其他样品相比含量较多低分子摩尔质量短链分子组分使得P1和P3的β-CD转化率较低。而具有部分链长较长组分的P4和P5的β-CD转化率虽高于P1和P3,但与P2相比仍出现了一定程度的降低,与之前链长过长分子不利于β-CD合成的推论相符。因而结合C1的分子摩尔质量分布可推断,合成β-CD的最适底物的分子摩尔质量应在Mw43 053~18 793 g/mol左右。而P1与 P5、P3与P4的分子摩尔质量分布存在的明显区别,也说明液化条件的选择会对DE值相同的麦芽糊精的分子组成产生明显影响,从而进一步影响β-CD的合成。
底物分子的分支化程度也是β-CD合成的影响因素之一,结合图1和图5可知,具有高β-CD转化率的样品同时也具有较低的分支化程度。合成CD时,CGTAse随机断开直链淀粉中的α-D-(1,4)-糖苷键,并将切下的链长适中的糖链自身非还原端与还原端相连,环化形成CD[3]。在分子摩尔质量相同的条件下,分支较少的样品具有较长的侧链及内链长度,有利于CGTase切割获得合适链长的分子片段进行环化。而高分支麦芽糊精则由于侧链及内链较短,易被切割形成大量无法进行环化的极限糊精,而且切下的短链小分子糖亦不利于β-CD合成。因此,分子摩尔质量适中且分支较少的麦芽糊精分子应当为β-CD合成的最适底物。
3 结论
不同DE值的麦芽糊精具有明显不同的分子组成,随着DE值升高,麦芽糊精分子的分支化程度升高,分子链长减小,而小分子糖含量则呈上升趋势。DE值相近的麦芽糊精由于液化条件不同也可具有差异较大的摩尔质量分布。麦芽糊精分子组成可影响β-CD的合成。应用适当链长的麦芽糊精可以促进环化反应,链长过长易引起歧化反应,而过短的链长会导致β-CD因耦合反应而降解。分子摩尔质量约为43 053~18 793 g/mol左右的麦芽糊精分子可作为环化反应的最适底物。β-CD的转化率随麦芽糊精分子分支化程度的升高而降低。
[1] 许波,黄遵锡,陈宝英,等.环状糊精葡萄糖基转移酶的研究进展[J].食品科学,2007,28(11):600-604.
[2] Mimi Sakinah AM,Ismailb AF,Osman Hassand AW,et al.Influence of starch pretreatment on yield of cyclodextrins and performance of ultrafiltration membranes[J].Desalination,2009,239:317-333.
[3] 王月明,孙万刚,张斌,等.环糊精及环糊精葡萄糖基转移酶特性研究[J].安徽农业科学,2007,35(27):8430 -8431,8434.
[4] Tae-Jong Kim,Bong-Chan Kim,Hyun-Soo Lee.Production of cyclodextrin using raw corn starch without a pretreatment[J].Enzyme and Microbial Technology,1997,20(7):506-509.
[5] Tae-Jong Kim,Bong-Chan Kim,Hyun-Soo Lee.Production of cyclodextrins using moderately heat-treated cornstarch[J].Enzyme and Microbial Technology,1995,17(12):1 057-1 061.
[6] Yano M,Miyauchi T,Hitatka H.Process of produducing cycolodextrins[P],Japanese patent,46 -2380B,1971.
[7] Masanobu K,Masamitsu M,Nobuyuki N,et al.Process for producing cyclodextrins[P],Japanese patent.52 -25043A,1977.
[8] Aboubacar A,Hamaker B R,Low molecular weight soluble starch and its relationship with sorghum couscous stickiness[J].Journal of Cereal Science,2000,31:119 -126.
[9] Aboubacar F,Bouguerand P E,Normand V V.Maltodextrin molecular weight dirlvibution in fluence on the glass transition temperature and viscosity in aqueous solutions[J].Carbothydrate Polymers,2004,58:323 -334.
[10] 金征宇,徐学明,陈寒青,等.碳水化合物化学原理与应用[M].北京:化学工业出版社,2007.
[11] Anuj Goel,Sanjay N Nene.Modifications in the phenolphthalein method for spectrophotometric estimation of beta cyclodextrin[J].Starch,1995,47(10):399-400.
[12] Laxman S Savergave,Santosh S Dhule,Vitthal Jogdand,et al.Production and single step purification of cyclodextrin glycosyltransferase from alkalophilic Bacillus firmus by ion exchange chromatography[J].Biochemical Engineering Journal,2008,39(3):510 -515.
[13] Michel Dubois,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,1956,28(3):350-356.
[14] 徐良增,许时婴,杨瑞金.低DE值麦芽糊精组分分析[J].粮食与油脂,2000(7):41-43.
[15] 陈玲,黄立新,温其标.麦芽糊精糖分的色谱法测定技术[J].粮食与饲料工业,1999(7):45-46.
The Molecular Weight Distribution of Maltodextrins and Its Relation to the Synthesis of Cyclodextrins
Jin Rong1,2,Gu Zheng-biao1,2,Hong Yan2,Cheng Li2,Li Zhao-feng2
1(The State Key Laboratory of Food Science & technology,Wuxi 214122,China)2(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The molecular weight distribution of maltodextrins and its relation to the synthesis of cyclodextrinsCyclodextrins(CDs)are cyclic oligosaccharides with a wide range of application in food,pharmaceutical,cosmetic and agricultural industries.In this work,we studied the influence of molecular weight distribution of starch degradations on the synthesis of β-CD.The molecular weight distribution of starch degradations were analyzed by GPC on both Sephacryl 200-HR and Sephacryl 400-HR column.The oligosaccharides in starch degradation were analyzed by HPLC.With the increasing of DE,the contents of low weight polysaccharides with higher multiple branching degree increased.Maltodextrins,which were prepared by different methods,had significantly different molecular weight distribution even if they had similar dextrose equivalent value(DE).In general,the conversion rate of β-CD decreased with DE increasing.The best condition for the substrate is the average molecular weight between 43 053~18 793 g/mol and less branch Maltodextrains.Similar DE with different processing methods can shift molecular weight distribution greatly.The different component of Maltodextrains can affect β-CD production.Starch degradations with appropriate molecular weight and higher linear degree are better for the synthesis of β-CD.
cyclodextrin,cyclodextrin glucanotransferase,maltodextrin,molecular weight distribution
硕士研究生(洪雁副教授为通讯作者)
*国家“863”计划项目(2006AA10Z335);中央高校基本科研业务费专项资金资助(JUSRP20911)和博导类基金(批准号:20100093110001)
2010-09-15,改回日期:2010-11-30
