2-甲硫基-4-羟基-5-嘧啶甲酸甲酯的合成
2011-12-08彦许响生
张 彦许响生
(1.浙江工业大学化学工程与材料学院,杭州 310014;2.衢州学院,浙江 衢州 324000)
研究与开发
2-甲硫基-4-羟基-5-嘧啶甲酸甲酯的合成
张 彦1,2许响生1
(1.浙江工业大学化学工程与材料学院,杭州 310014;2.衢州学院,浙江 衢州 324000)
以甲氧亚甲基丙二酸二甲酯为原始料,与甲基异硫脲反应制得2-甲硫基-4-羟基-5-嘧啶甲酸甲酯,考察了各反应条件的影响,确立了较佳的工艺参数。结果表明,甲氧亚甲基丙二酸二甲酯、甲基异硫脲硫酸盐与氢氧化钠的摩尔投料比为1:1.1:3.3,溶剂乙醇与水体积比为1:1,在室温下反应3 h,用稀盐酸调pH至2~3,收率达52.9%。产物经1H NMR和MS表征证明结构正确。
甲基异硫脲;2-甲硫基-4-羟基-5-嘧啶甲酸甲酯;合成
嘧啶衍生物广泛存在于生物体及自然界中,其结构特性和生物活性,在生理、药理上都有重要作用[1-3]。作为反应前体,是药物合成中有用的药效团,很多药物分子都是通过嘧啶化合物衍生而来[4]。
嘧啶类物质根据嘧啶环上连接的基团不同和连接方式不同,可大致分为6类:单取代嘧啶、2取代嘧啶、3取代嘧啶、4取代嘧啶、吡啶并嘧啶和噻唑并嘧啶[5]。2位取代4-羟基-5-嘧啶甲酸乙酯含有多种官能团,可以在多个部位进行衍生;而2、4位取代的2-甲硫基-4-羟基-5-嘧啶甲酸甲酯同样含有多种官能团,可衍生出许多化合物,此类化合物可作为农药、医药合成的重要中间体[6]。文献[7]中用甲基异硫脲代替尿素与乙氧亚甲基丙二酸二乙酯反应,效果较好。
本研究用甲氧亚甲基丙二酸二甲酯与甲基异硫脲硫酸盐反应合成2-甲硫基-4-羟基-5-嘧啶甲酸甲酯。
1 实验部分
1.1 合成路线
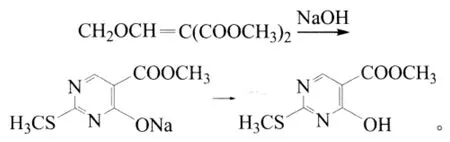
1.2 仪器与试剂
仪器:XT-4双目体视显微熔点仪,AV-300核磁共振仪,HP5989B质谱仪。
试剂:甲氧亚甲基丙二酸二甲酯(C7H9O5)、甲基异硫脲硫酸盐(C2H6N2S·1/2H2SO4)、氢氧化钠等,均为分析纯。
1.3 实验步骤
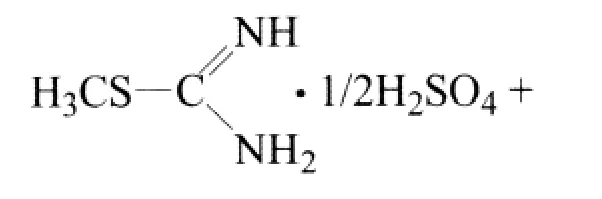
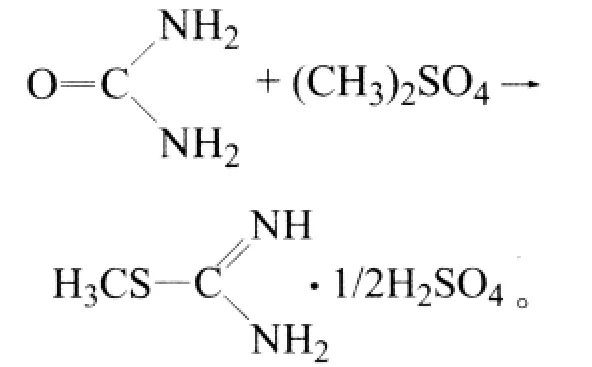
1.3.1 甲基异硫脲硫酸盐的制备
甲基异硫脲硫酸盐可方便地从硫脲甲基化制得,收率可达94%[8]。反应式如下:
1.3.2 2-甲硫基-4-羟基-5-嘧啶甲酸甲酯的制备
在配有电动搅拌、温度计和回流冷凝管的250 mL四口烧瓶装置,加入17.4 g(0.1 mol)的甲氧亚甲基丙二酸二甲酯、30.6 g(0.11 mol)甲基异硫脲硫酸盐和60 mL乙醇,启动搅拌。将13.2 g(0.33 mol)氢氧化钠溶于60 mL水中,缓慢滴加,在室温下继续反应3 h。用质量分数20%的稀盐酸调pH至2~3,真空抽滤,滤饼用冰水淋洗数次,在80℃干燥至恒量。最后得白色固体10.6 g,收率52.9%,熔点208~210℃。
广州古代皇家园林遗址,具有非常高的文化价值,应重视其遗址的保护工作。一是保护南越国皇家园林遗产,重点保护南越王宫以及东部宫苑,拓展其作为研究岭南地区秦汉时代园林艺术的宝贵文化价值。二是保护和拓展南汉国皇家园林遗产资源,重点保护现存的药洲遗址,恢复古时文人酬唱之盛景。通过开发和利用,拓展广州古代皇家园林遗产文化的内容。通过构建广州古代皇家园林遗址公园,增加古代园林的文化内容与景观,从而丰实广州古代的文化内容。通过建设广州皇家园林遗址公园,丰富广州的遗址性公园景观,增强岭南园林的景观资源,使其成为旅游资源的重要组成部分,从而推动社会经济的发展,为广州城市的经济注入源源不断的来源。
1HNMR (DMSO-d6)δ:2.5(3H,s,—SCH3),3.7(3H,s,—OCH3),8.4(1H,s,N=CH),13.3(1H,br s,—OH)。MS图中分子离子峰为200,与预期产物2-甲硫基-4-羟基-5-嘧啶甲酸甲酯的相对分子质量一致。
2 结果与讨论
分别考察了加料速度、投料比、反应时间及后处理对反应的影响。
2.1 加料速度对反应的影响
实验中,先将NaOH溶于水中,待冷却至室温后,缓慢滴加入甲氧亚甲基丙二酸二甲酯及甲基异硫脲硫酸盐的反应液中,因体系是放热反应,故不能将NaOH溶液直接快速加入到反应体系中,否则将产生大的白色结块物,影响反应收率。
2.2 投料比对收率的影响
投料比对反应收率有一定的影响,结果如表1所示。

表1 甲氧亚甲基丙二酸二甲酯与甲基异硫脲摩尔比对反应的影响Tab 1 The influence of the ratio on the product yield
从表1可以看出,甲氧亚甲基丙二酸二甲酯与甲基异硫脲的摩尔比为1:1.1时,收率达到52.9%。再增加投料比,收率提高不明显,投料比较低时,反应不完全。
2.3 反应时间对收率的影响
时间对反应结果有较大的影响,实验数据见表2。
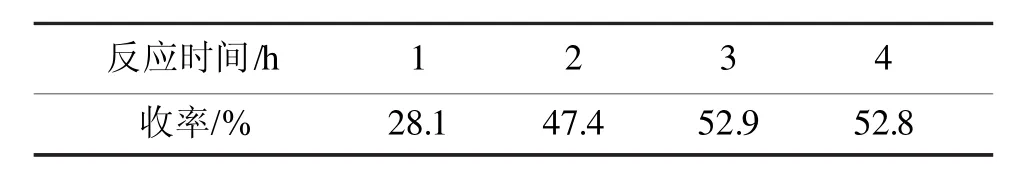
表2 反应时间对反应收率的影响Tab 2 The influence of reaction time on product yield
从表2可以看出,随着反应时间的增加,收率有所增加,当反应时间达3 h后,体系反应较完全;再延长反应时间,收率提高不明显。考虑收率及效率,反应时间选择3 h为佳。
2.4 后处理方式对反应的影响
反应后溶液中NaOH过量,2-甲硫基-4-羟基-5-嘧啶甲酸甲酯与NaOH生成相应的钠盐,溶解度大,须用盐酸酸化,将pH调到2~3,大量2-甲硫基-4-羟基-5-嘧啶甲酸甲酯从溶液中析出,通过洗涤抽滤就可以得到纯度较好的产物。pH调到5~6也有较多固体析出,但收率不及pH为2~3时高。反应后处理pH调至2~3为宜。
3 结论
本研究以甲氧亚甲基丙二酸二甲酯与甲基异硫脲硫酸盐反应合成2-甲硫基-4-羟基-5-嘧啶甲酸甲酯。优化的工艺参数:甲氧亚甲基丙二酸二甲酯与甲基异硫脲硫酸盐与氢氧化钠的摩尔投料比为1:1.1:3.3,溶剂乙醇与水体积比为1:1,在室温下反应3 h,用质量分数20%的稀盐酸调pH至2~3,收率为52.9%。
该路线具有操作步骤简单、反应条件温和、后处理方便及能耗少等优点,具有较好的应用前景。
[1]Jaink S,Chitrets,Minyar P B.Biological and medicinal significance of pyrimidines[J].Curr Sci,2006,90(6):793-803.
[2]唐除痴,李煜昶,陈彬,等.农药化学[M].天津:南开大学出版社,1998.
[3]Storet,Isabelle.Method for preparing scenting compositions and scented products,and resulting products:US,6458757[P].2002-01-14.
[4]Lagojia M I.Pyrimidine as constituent of natural biologically active compound-ds[J].Chem.Biodiver-sity,2005,2(1):1-50.
[5]袁丹,容如斌.嘧啶类化合物的研究进展[J].化学与生物工程,2008,25(6):13-17.
[6]黄统辉,张爱东,邓灵福.4-羟基-5-嘧啶甲酸乙酯衍生物的合成[J].化学试剂,2009,31(7):541-542,547.
[7]奚绍祁,陈启槐,赵桂芝.吡哌酸(pipemidic acid)的合成[J].沈阳药学院学报,1984,1(3):244-247.
[8]Shildneck P R.S-Methyl isothiourea sulfate[J].Org Syn,1932,2:411-415.
Synthesis of 2-methylthio-4-hydroxyl-5-pyrimidine Methyl Formate
Zhang Yan1,2,Xu Xiangsheng1
(1.College of Chemical Engineering and Materials,Zhejiang University of Technology,Hangzhou 310014;2.Quzhou College,Quzhou,Zhejiang 324000)
Using dimthyl methoxymethylenemalonateand 2-methyl-2-thiopseudourea as raw material to get 2-methylthio-4-hydroxyl-5-pyrimidine methyl formate.The influence of reaction conditions was investigated.The result showed that the molar ratio dimthyl methoxymethylenemalonate:2-methyl-2-thiopseudourea:sodium hydroxide was 1:1.1:3.3,the volume of ethanol:water was 1:1,then reacted at room temperature for 3 hours,used hydrochloric acid to adjust pH to 2~3,the yield was 52.9%.The products are confirmed by1H NMR and MS.
2-methyl-2-thiopseudourea;2-methylthio-4-hydroxyl-5-pyrimidine;methyl formate;synthesis
TQ254.1
ADOI10.3969/j.issn.1006-6829.2011.05.006
2011-05-13
