吡非尼酮对单侧输尿管梗阻大鼠肾小管间质纤维化的影响
2011-12-08李娣昕曾红兵纪春阳梁萍萍位红兰
李娣昕,曾红兵,纪春阳,梁萍萍,位红兰
(1.成都市第五人民医院肾内科,611130;2.华中科技大学同济医学院附属同济医院肾内科,武汉 430030)
肾小管间质纤维化(tubulointerstitial fibrosis,TIF)是多种肾脏疾病发展至终末期肾衰竭的共同通路,是反映肾功能下降严重程度和判断预后最重要的指标。因而,对其发生、发展的机制及其防治的研究有着重要的临床意义。吡非尼酮(pirfenidone,PFD)是目前经实验证实的少数可延缓甚至逆转纤维化的药物之一。实验证实[1-2],PFD能够延缓单侧输尿管梗阻(unilateral ureteral obstruction,UUO)模型大鼠TIF,但其机制尚未完全明了。笔者从肾小管上皮细胞(renal tublar epithelial cells,RTC)凋亡的角度初步探讨 PFD对UUO模型大鼠TIF的作用及可能的机制。
1 材料与方法
1.1 动物模型与分组 雌性Wistar大鼠35只[由华中科技大学同济医学院动物实验中心提供,许可证编号:SCSK(鄂)2004-2007,体质量 130 ~150 g],适应性饲养1周后随机分为3组:假手术组(7只),模型组(14只),治疗组(14只)。模型组及治疗组行左侧输尿管结扎术后关闭腹腔。假手术组仅分离左侧输尿管,不结扎即关闭腹腔。各组大鼠均正常进食、饮水,治疗组从手术前1 d至手术后14 d给予PFD(上海睿星基因技术有限公司提供,纯度 >99%,250 mg·kg-1·d-1,剂量参考文献[3],用1%羧甲基纤维素钠溶液制成悬液)灌胃,其他组每日灌服等容积1%羧甲基纤维素钠溶液。
1.2 标本留取 假手术组于手术后14 d处死;模型组和治疗组于手术后7及14 d各处死一半大鼠。剖腹后先取下腔静脉血(每只约5 mL),用于生化检测。各组均取左侧肾脏皮质组织,取约200 mg置于-80℃冰箱保存,其余置4%多聚甲醛中固定约36 h。常规制成切片厚约4μm。
1.3 检测指标及方法
1.3.1 生化分析 下腔静脉血经1 500 r·min-1(r=10 cm)离心5 min后取血清,采用全自动生化分析仪,检测血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr),钾离子(K+)和钠离子(Na+)。
1.3.2 病理学检测及纤维化评估 组织切片常规行过碘酸希夫染色(periodic acid-Schift stain,PAS)、Masson染色。应用病理图集采集和分析系统软件(HMIA2000型),在高倍镜下每个标本随机选取10个不含肾小球和大血管的肾皮质视野,纤维化阳性面积占统计场总面积的百分比作为肾小管间质的纤维化指数(%),求和,取平均值。
1.3.3 肾小管上皮细胞凋亡及结果评估 应用TUNEL碱性磷酸酶标记的原位细胞凋亡检测试剂盒(德国罗氏),按试剂盒说明进行操作。不加酶的标记溶液代替TUNEL反应混合物作阴性对照,实验室既往证实阳性结果作为阳性对照。细胞核呈棕黄色至黄褐色者为阳性细胞,应用病理图集采集和分析系统软件,在高倍镜下对每个标本随机选取10个互不重叠的皮质视野(避开肾小球及大血管),计数肾小管上皮细胞(根据凋亡细胞所处位置及该位置已知细胞组成来区分),以阳性细胞数与总细胞数的比值作为凋亡指数(%)。
1.3.4 免疫组化测原位 半胱氨酸天门冬氨酸蛋白酶(Caspase)-3蛋白表达及肾小管上皮细胞阳性评估试剂均购于武汉博士德生物工程有限公司,按说明书进行操作。磷酸盐缓冲溶液代替一抗作为阴性对照,实验室既往证实阳性结果作为阳性对照。细胞质呈黄褐色、细胞核蓝色或参杂少许黄褐色为阳性细胞。结果评估同上。
1.3.5 组织匀浆制作、比色法测丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)MDA、SOD、考马斯亮兰蛋白测定试剂盒均购自南京建成生物工程研究所。应用预冷的0.9%氯化钠溶液裂解肾组织,制成10%和1%匀浆,比色法分别测定肾组织MDA含量及总SOD活性,按试剂盒说明书操作。
1.4 统计学方法 所有数据均以均数±标准差(x±s)表示,采用SPSS13.0统计软件,组间均数比较采用单因素方差分析,均数间的两两比较用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 生化分析 各组大鼠在BUN、Scr、K+和Na+指标上无明显差异。
2.2 病理学改变 假手术组肾脏病理改变不明显;模型组可见不同程度肾小管扩张或萎缩,间质明显趋向纤维化,以14 d时为重;治疗组纤维化程度较模型组明显减轻,详细结果见表1。
2.3 肾小管上皮细胞凋亡改变 假手术组肾小管上皮细胞偶见凋亡;模型组则明显增多,且凋亡指数随病程延长增加;治疗组细胞凋亡明显减轻,与模型组比较7及14 d分别减少53.0%,58.0%,详细结果见表1。TUNEL染色14 d结果见图1。阳性细胞胞核呈黄色至褐色,细胞质不着色。
表1 3组大鼠肾间质纤维化、肾小管上皮细胞凋亡及Caspase-3表达变化Tab.1 Ratio of TIF、apoptosis of RTCs and Caspase-3-positive RTCs of rats in 3 groups %±s
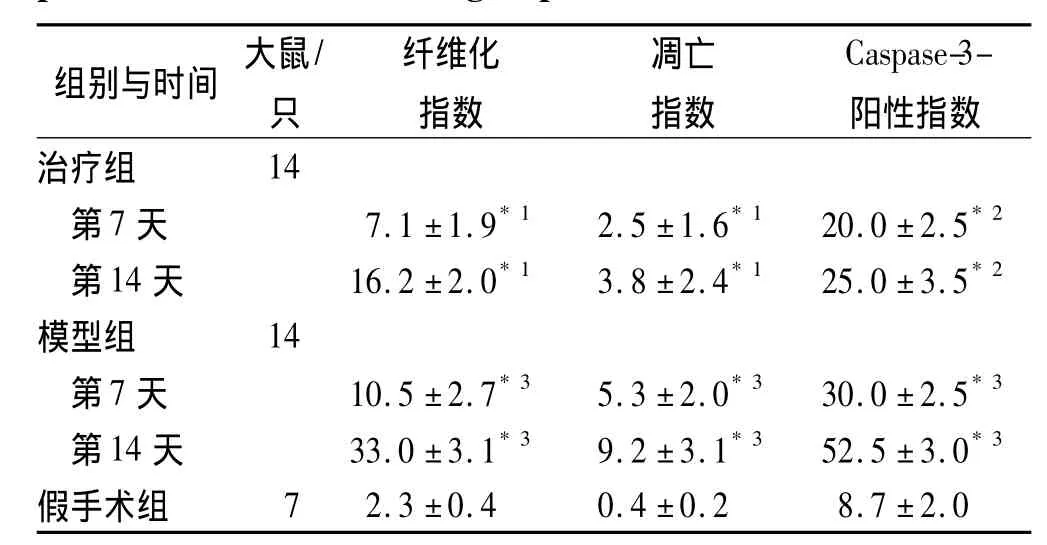
表1 3组大鼠肾间质纤维化、肾小管上皮细胞凋亡及Caspase-3表达变化Tab.1 Ratio of TIF、apoptosis of RTCs and Caspase-3-positive RTCs of rats in 3 groups %±s
与模型组比较,*1 P<0.05,*2 P<0.01;与假手术组比较,*3 P<0.05Compared with model group,*1 P < 0.05,*2 P < 0.01;Compared with sham operation group,*3 P <0.05
组别与时间 大鼠/只纤维化指数凋亡指数Caspase-3-阳性指数治疗组14第7天 7.1±1.9*1 2.5±1.6*1 20.0±2.5*2第14天 16.2±2.0*1 3.8±2.4*1 25.0±3.5*2模型组 14第7天 10.5±2.7*3 5.3±2.0*3 30.0±2.5*3第14天 33.0±3.1*3 9.2±3.1*3 52.5±3.0*3假手术组7 2.3±0.4 0.4±0.2 8.7±2.0
2.4 肾小管上皮细胞Caspase-3表达 在假手术组,Caspase-3表达较少,模型组与之相比明显增加,7及14 d分别增加2.4,5.0倍,而治疗组分别下调33.0%,52.0%,详细结果见表1。14 d染色结果见图2。阳性细胞细胞质呈黄色至褐色,细胞核可呈部分黄色至黄褐色。
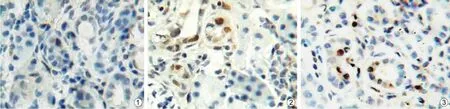
图1 3组大鼠高倍镜下TUNEL阳性的肾小管上皮细胞(×400)①假手术组;②模型组第14天;③治疗组第14天Fig.1 TUNEL-positive RTCs of rats in 3 groups under high power lens(×400)①sham operation group;②UUO model group at day 14;③treatment group at day 14

图2 3组大鼠高倍镜下Caspase-3阳性表达的肾小管上皮细胞(×200)①假手术组;②模型组;③治疗组Fig.2 Caspase-3-positive RTCs of rats in 3 groups under high power lens(×200)①sham operation group;②UUOmodel group;③treatment group
2.5 肾皮质MDA含量及SOD活性 与假手术组比较,模型组MDA含量明显升高,7及14 d时分别升高2.9,0.9倍(P<0.01);与模型组同期相比,治疗组MDA含量7 d时明显下调(P<0.01),但14 d时差异无统计学意义(P>0.05)。
与假手术组比较,模型组SOD活性降低,7及14 d分别降低46.0%,53.0%(P<0.01);但治疗组较模型组同期明显上调,7及14 d分别上调33.0%,38.5%(P <0.01)。见图3,4。
3 讨论
TIF是各种肾脏病进展至终末期的共同通路,也是判断预后的关键指标,延缓TIF的进展是治疗肾脏疾病、改善预后有效方法。UUO模型是研究TIF的理想模型,故本实验选择UUO大鼠作为研究对象。
PFD是一种新型的广谱抗纤维化药,能够防止甚止逆转纤维化的发生和瘢痕形成,它耐受性好,不良反应少见而轻微,这已经在大量的体外和动物实验中得到证实[1],可望成为肾纤维化治疗的新选择[2,4],但机制了解甚少。
TIF是一个多因子多通路共同作用的复杂过程,总体来说,包括正常结构的破坏和异常物质的沉积。肾小管上皮细胞占肾单位的约80%。实验证实,其凋亡在TIF过程中起着重要的作用,它直接参与病理状态下的肾小管萎缩、管腔扩张等变化[5],并可通过分泌白细胞介素、趋化因子等后效应[6-7],作用于其他细胞,参与细胞外基质增多过程。故认为能够抑制TIF凋亡的药物就极可能延缓或逆转肾小管间质纤维化,从而改善肾病患者肾功能及预后[8]。因此,笔者从RTC凋亡的角度,探讨PFD对UUO模型TIF的影响。结果显示UUO模型组与假手术组相比,肾小管上皮细胞凋亡显著增多,尤其在肾小管扩张或萎缩、细胞外基质增多的部位,证实RTC凋亡在TIF中的作用;而治疗组与模型组相比,RTC凋亡明显减少,证实PFD对UUO模型中的RTC凋亡亦有抑制作用。故推断PFD能通过抑制RTC的凋亡从而改善UUO的TIF。
对于PFD抑制凋亡的详细机制,可从Caspase-3和氧化应激两方面进行探讨。一方面,Caspase是执行细胞凋亡的主要酶类,具有蛋白酶的生物学特性,其中Caspase-3参与凋亡过程的终末期,在凋亡病理过程中起着中心作用,对UUO所致的肾小管上皮细胞凋亡同样起着重要的作用。本实验显示在凋亡增多的小管,Caspase-3表达亦呈同样趋势增加,尤其在UUO模型组十分明显;而在治疗组,Caspase-3与RTC凋亡呈同样趋势下降。这不仅证实Caspase-3对RTC凋亡起着重要作用,亦说明PFD能通过抑制Caspase-3的表达从而抑制RTC的凋亡。
另一方面,UUO模型中由于手术张力应激所致的肾血浆流量的下降(肾组织缺血、低氧),巨噬细胞和肾小管上皮细胞活化引起炎症反应等,均能产生大量的反应氧代谢产物(reactive oxygen species,ROS),而活性氧增多是凋亡的线粒体途径的诱因之一,提示UUO手术后氧化应激增强与肾组织细胞凋亡密切相关,CUTTLE等[9]的实验证实了这一点。许多学者也证实抗氧化剂 具有抗凋亡作用[10-12]。本实验显示,UUO模型组肾皮质匀浆中脂质过氧化物的标志物MDA明显升高,提示在UUO手术后有大量的ROS产生;而机体最主要的抗氧化酶SOD的活性在UUO手术后明显减少,这说明ROS的激增与机体对ROS的中和及清除减少有关。而在治疗组,这两方面均得到明显改善。提示PFD能够显著改善氧化应激,从而抑制RTC凋亡。
此外,各组大鼠的生化检测结果差异无统计学意义,说明在2周内UUO模型大鼠的肾功能仍处于代偿,且提示PFD未造成额外的生物学不良反应。
综上所述,PFD能够抑制UUO所致的肾小管上皮细胞凋亡,从而延缓肾间质纤维化,其机制可能与抑制氧化应激所致凋亡及Caspase-3相关的途径有关。本研究为PFD治疗UUO肾间质纤维化提供了另外一条依据。
[1] 薛克营,张浩,陈燕.新型抗纤维化药物吡非尼酮[J].中国新药杂志,2005,14(8):1070-1073.
[2] SHIMIZU T,KURODA T,HATA S,et al.Pirfenidone improves renal function and fibrosis in the postobstructed kidney[J].Kidney Int,1998,54(1):99-109.
[3] SHIHAB F S,BENNETTW M,YIH,et al.Effect of pirfenidone on apoptosis-regulatory genes in chronic cyclosporine nephrotoxicity[J].Transplantation ,2005,79(4):419-426.
[4] HEWITSON T D,KELYNACK K J,TAIT M G,et al.Pirfenidone reduces in vitro rat renal fibroblast activation and mitogenesis[J].JNephrol,2001,14(6):453-460.
[5] TRUONG L D,PETRUSEVSKA G,YANG G,et al.Cell apoptosis and proliferation in experimental chronic obstructive uropathy[J].Kidney Int,1996,50(1):200-207.
[6] HAGIMOTO N,KUWANO K,KAWASAKIM,et al.Induction of interleukin-8 secretion and apoptosis in bronchiolar epithelial cells by Fas ligation[J].Am J Respir Cell Mol Boil,1999,21(3):436-445.
[7] FAOUZIS,BURCKHARDTB E,HANSON JC,etal.Antifas induces hepatic chemokines and promotes inflammation by a NFκB-independent,caspase-3-dependent pathway[J].JBiol Chem,2001,276(52):49077-49082.
[8] DOCHERTY N G,O'SULLIVAN O E,HEALY D A,et al.Evidence that inhibition of tubular cell apoptosis protects against renal damageand development of fibrosis following ureteric obstruction[J].Am J Physiol Renal Physiol,2006,290(1):4-13.
[9] CUTTLE L,ZHANG X J,ENDRE Z H,et al.Bcl-X(L)translocation in renal tubular epithelial cells in vitro protects distal cells from oxidative stress[J].Kidney Int,2001,59(5):1779-1788.
[10] EMANUELE S,CALVARUSO G,LAURICELLA M,et al.Apoptosis induced inhepatoblastoma HepG2cells by the proteasome inhibitor MG132 is associated with hydrogen peroxide production,expression of Bcl-XS and activation of caspase-3[J].Int JOncol,2002,21(4):857-865.
[11] WOO SH,PARK IC,PARK M J,et al.Arsenic trioxide induces apoptosis through a reactive oxygen speciesdependent pathway and loss of mito-chondrial membrane potential in HeLa cells[J].Int JOncol ,2002,21(1):57-63.
[12] TIAN B,LIU J,BITTERMAN P B,et al.Mechanisms ofcytokine induced NO-mediated cardiac fibroblast apoptosis[J].Am J Physiol Heart Circ Physiol ,2002,283(5):1958-1967.
