3-氨基苯硼酸纸片法检测大肠埃希菌高产AmpC酶的探讨*
2011-11-28胡志东徐海茹
李 静 胡志东 田 彬 徐海茹 李 金
AmpC酶又称诱导酶,属于Bush分类中的Ⅰ类酶及分子生物学中的C类酶[1]。AmpC酶多数由染色体介导,部分呈诱导型表达。近年也陆续发现了质粒介导AmpC酶,其耐药基因可在同种或不同种属细菌间广泛传播,使细菌耐药日趋复杂,给临床治疗提出了严峻的挑战,迫切需要临床实验室能快速而准确地检测产AmpC酶的细菌。目前临床实验室标准化委员会(CLSI)尚未确定检测的标准方法,本研究以三维试验和聚合酶链反应(PCR)为参照,与3-氨基苯硼酸(APB)双纸片协同法进行比较,以评价APB双纸片协同法用于临床实验室检测临床分离的大肠埃希菌的可靠性。
1 材料与方法
1.1 菌株来源 收集2010年1月—10月天津医科大学总医院住院患者各类送检标本(包括痰、尿、血、胸水、腹水等),经常规方法进行细菌分离,用Compact全自动微生物分析仪鉴定,选取无重复分离大肠埃希菌44株进行研究。大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853、肺炎克雷伯菌ATCC 700603购自卫生部临检中心。阴沟肠杆菌O29M(染色体介导,AmpC酶持续高产株)、ACT-1质粒介导AmpC酶大肠埃希菌由北京协和医院检验科惠赠。
1.2 主要试剂与仪器 头孢西丁(FOX,30 μg)、头孢他啶(CAZ,30 μg)、头孢噻肟(CTX,30 μg)购自北京天坛药物生物技术开发公司,水解酪蛋白(MH)琼脂粉购自上海伊华医学科技有限公司,APB干粉购自Sigma公司。DNA Marker、PCR扩增试剂购于北京全式金生物技术有限公司,VITEK-2 compact全自动微生物系统及鉴定卡、药敏试验卡购自法国生物梅里埃公司,9700型DNA扩增仪为美国Perkin Elmer公司产品,Gel Doc 2000凝胶成像系统仪为美国Bio-Rad公司产品,水平电泳仪购自北京六一仪器厂。
1.3 方法
1.3.1 APB纸片制备方法 以二甲基亚砜作为溶剂,配成60 g/L的APB溶液,取5 μL上述APB溶液分别加入到直径为6 mm,吸水量为20 μL的无菌空白滤纸上,使每片测试纸片上含有APB 300 μg,待纸片干燥后,至2℃~8℃下保存备用。
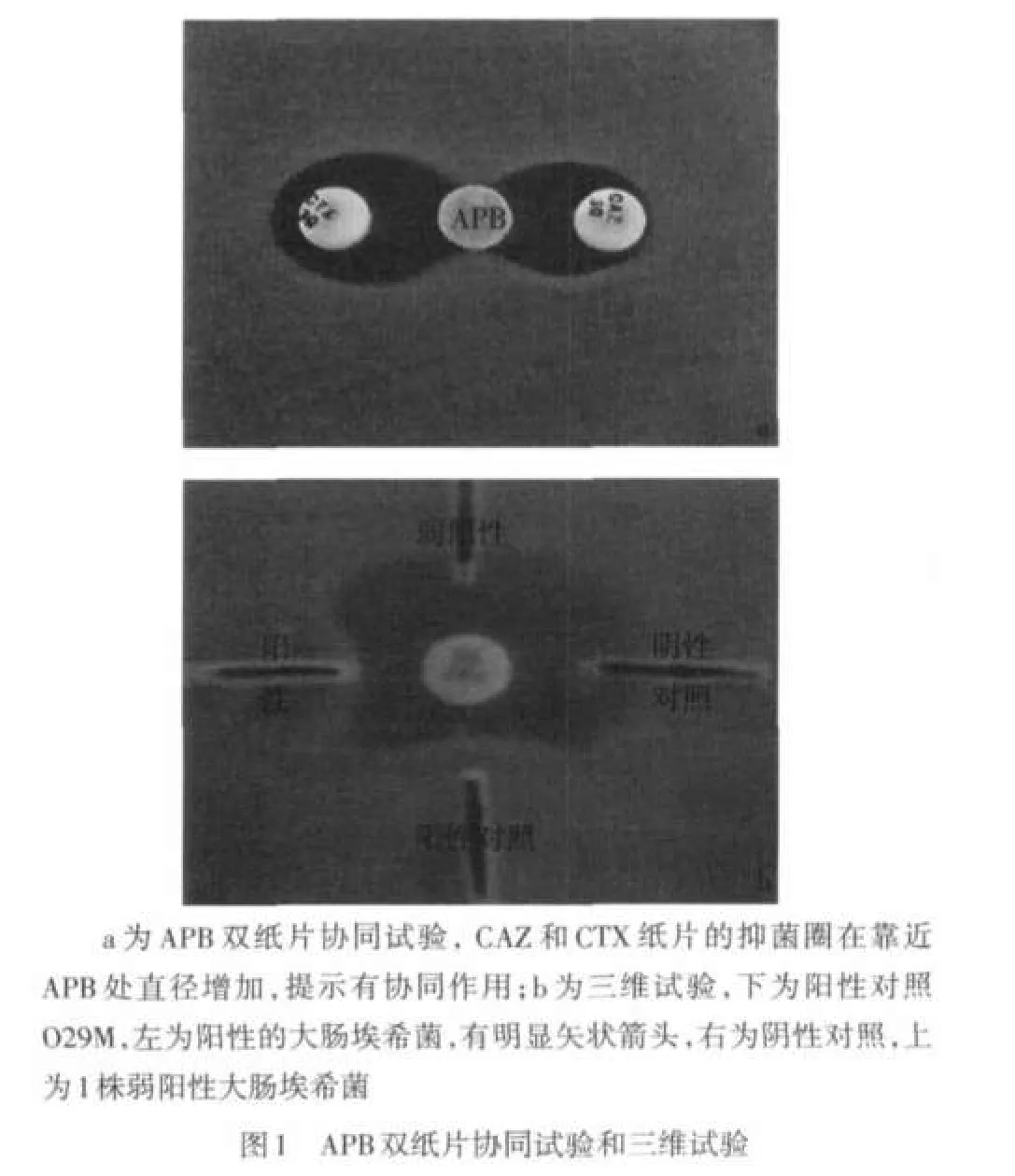
1.3.2 APB双纸片协同试验 参照文献[2]方法,将待测菌株配成0.5麦氏单位的菌液,均匀涂布MH平板,稍干后中央贴APB纸片,在距中央12 mm的位置贴上CAZ、CTX纸片,35℃过夜培养,以APB与任何一种头孢菌素产生协同为阳性,见图1。
1.3.3 三维试验 参照文献[3]进行,以阴沟肠杆菌O29M作为产AmpC酶的阳性对照,以肺炎克雷伯菌ATCC 700603为阴性对照。(1)粗提酶液制备(冻融裂解法):将质控菌和待检菌密涂于1/4MH琼脂平板(平板直径为90 mm)上,35℃孵箱培养24 h后,用灭菌棉棒取下全部菌苔于1 mL灭菌生理盐水中(用1.5 mL离心管),置-70℃低温冰箱反复冻融5次。然后,在4℃条件下,10 000 r/min离心15 min,抽取上清液即为粗提酶液。(2)三维试验:将0.5麦氏单位大肠埃希菌ATCC 25922菌液均匀涂布于MH平板上,取FOX纸片(30 μg/片)置于平板中央,使用刀片在离纸片边缘5 mm处放射状由里向外切割一道狭缝,用微量加样器取30 μL酶粗提液由里向外加入狭缝内,酶液切勿溢出狭缝,将MH平板放入35℃孵箱过夜。若狭缝与抑菌圈处出现扩大的长菌区,则视为三维试验阳性,见图1。
1.3.4 DNA模板的制备 采用煮沸法。将菌株接种在MH平板上孵育18~24 h后,选取数个菌落至1.5 mL离心管中,加入灭菌双蒸水150 μL,煮沸10 min后立即放冰上冷却,于4℃12 000 r/min离心10 min,取上清液作为PCR反应模板立即使用,或-20℃保存备用。
1.3.5 PCR检测AmpC酶基因 参照文献[4]委托上海Sangon公司合成6对AmpC酶基因引物,见表1。PCR反应体系(25 μL):dNTP2 μL、引物各0.5 μL、模板0.5 μL、Taq酶0.25 μL、10×PCR缓冲液2.5 μL、去离子水18.75 μL。PCR条件:94 ℃变性30 s,55℃退火30 s,72℃延伸 1 min,30个循环后72℃延伸7 min。反应结束后取5 μL PCR产物经含溴化乙锭的1.5%琼脂糖凝胶电泳,紫外灯下观察结果,用凝胶成像系统照相保存。

表1 PCR引物序列
1.4 统计学处理 采用配对χ2检验进行各组率的比较,P<0.05为差异有统计学意义。
2 结果
APB双纸片协同试验、三维试验、PCR法检测结果的阳性率分别为70.5%、56.8%和75.0%。APB双纸片协同试验与三维试验的阳性符合率为88.0%,阴性符合率为52.6%,总符合率为72.7%,2种检测方法结果差异无统计学意义,见表2。以PCR结果为金标准,APB双纸片协同试验的灵敏度为90.1%,特异度为90.1%,符合率为90.1%,2种检测方法结果差异无统计学意义,见表2。
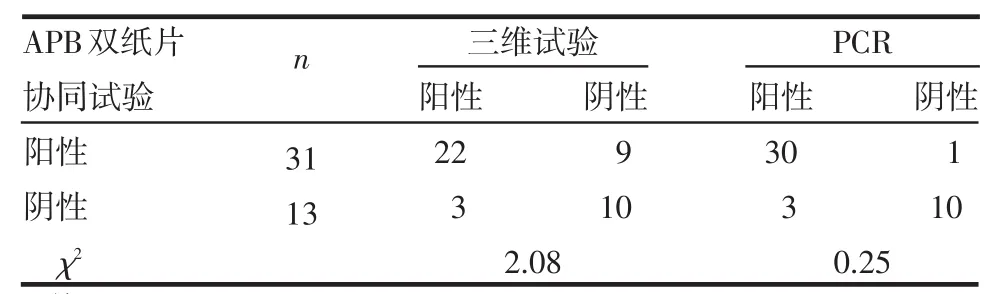
表2 APB双纸片协同试验与三维试验及PCR法比较结果 (株)
3 讨论
产AmpC酶的致病菌因对多种抗生素耐药,给临床抗感染治疗造成了很大的困难,高效的检测方法能协助临床合理用药。AmpC酶是革兰阴性菌产生的临床上最重要的β-内酰胺酶之一,能对第3代头孢菌素、单环类、头霉素类等β-内酰胺类抗生素耐药,其比超广谱β-内酰胺酶具有更宽的底物谱且对酶抑制剂不敏感,已受到广泛的重视[5]。大肠埃希菌是临床上最常见的革兰阴性杆菌病原菌,可以由染色体突变或质粒介导持续高产AmpC酶。
目前,AmpC酶检测尚无统一标准,临床实验室检测AmpC酶存在很多困难。国内外已报道了多种检测AmpC酶的方法,但至今仍未建立起一种筛选和发现AmpC酶的标准的表型检测方法[6]。三维试验是目前公认的质粒AmpC酶或持续高产AmpC酶的经典检测方法,其不受抗生素的诱导作用,准确率较高,结果清晰、易判读;但三维试验操作非常繁琐且费时,另外,酶的种类以及提取酶的量影响对头孢西丁活性的水解,因而难在一般实验室常规使用。分子生物学检测技术虽然能获得准确的检测结果,但操作复杂、费时、成本高,也无法用于常规检验。国内学者沈定霞等[7]提出用APB纸片增强试验检测高产AmpC酶和质粒AmpC酶;日本学者Yagi等[2]提出应用APB双纸片协同试验和增效试验检测大肠埃希菌和肺炎克雷伯菌高产AmpC酶菌株;本研究采用Yagi等[2]提出的APB双纸片协同试验检测大肠埃希菌高产AmpC酶,主要利用APB是AmpC酶抑制剂的原理设计,头孢他啶和头孢噻肟在靠近APB一侧对细菌的抑菌圈直径有扩大来推测该细菌高产AmpC酶[8]。
本研究显示,APB纸片法、三维试验和PCR法分别对44株大肠埃希菌进行AmpC酶检测阳性率分别为70.5%、56.8%、75.0%,高于冯福英等[9]报道的16.7%,这可能与不同地区用药特点、用药水平、所选菌株及菌株数量等有关。三维试验检测阳性的25株菌中22株APB法也阳性,2种方法的阳性符合率为88.0%,3株APB法为阴性,分析其原因可能为:(1)菌株产酶量少,APB法没有破坏细菌菌体使其释放β-内酰胺酶,因而无法检测到。(2)产AmpC酶菌株作用底物为头孢他啶和头孢噻肟以外的底物,造成APB法漏检;9株APB法检测为阳性的菌株,而三维试验检测为阴性,可能因为APB法存在部分假阳性菌株。PCR法检测阳性的33株菌中,其中30株APB法也阳性,APB法的灵敏度为90.1%,特异度为90.1%,3株APB法为阴性,可能因为菌株产酶量少而无法检测到,但也不排除APB法漏检的可能性;1株APB法检测为阳性的菌株,而PCR法检测为阴性,分析其原因可能为:(1)部分菌株为高产AmpC酶菌株,PCR法检测不到。(2)有部分菌株虽然是质粒AmpC酶菌株,可能携带基因为本文所检测的6对引物扩增范围以外的基因,导致PCR检测不到。(3)APB法可能产生部分假阳性菌株。另外,本试验过程中使用含300 μg APB纸片协同法检测细菌产生的AmpC酶,操作简便、快捷、经济、实验结果明确且易于判定,可供参考使用。
致谢:本研究中APB纸片制备部分得到天津金斯坦生物科技有限公司的大力支持和帮助。
[1]Bush K,Jaeoby GA,Medeiros AA.A functional classification scheme for beta-lactamases and its correlation with molecular structure[J].Antimicrob Agents chemother,1995,39(6):1211-1233.
[2]Yagi T,Wachino J,Kurokawa H,et al.Practical methods using boronic acid compounds for identification of class C beta-lactamase-producingKlebsiella pneumoniaeandEscherichia coli[J].J Clin Microbiol,2005,43(6):2551-2558.
[3]陈东科,张志敏,张秀珍.三维法检测β内酰胺酶的影响因素探讨及方法的改进[J].中华检验医学杂志,2003,26(10):600-604.
[4]Perez-Perez FJ,Hanson ND.Detection of plasmid-mediated AmpC beta-lactamase genes in clinical isolates by using multi-plex PCR[J].J Clin Microbiol,2002,40(6):2153-2162.
[5]卢月梅,张阮章,李红林,等.EDTA纸片法检测大肠埃希菌和肺炎克雷伯菌高产AmpC 酶的探讨[J].广东医学,2008,29(8):1327-1328.
[6]Tan TY,Nq LS,He J,et al.Evaluation of screening methods to detect plasmid-mediated AmpC inEscherichia coli,Klebsiella pneumoniae,andProteus mirabilis[J].Antimicrob Agents Chemother,2009,53(1):146-149.
[7]沈定霞,罗燕萍,曹敬荣,等.肺炎克雷伯菌和大肠埃希菌AmpCβ内酰胺酶的表型检测[J].临床检验杂志,2007,25(1):4-6.
[8]Beesley T,Gascoyne N,Knott-Hunziker V,et al.The inhibition of class C beta-lactamases by boronic acids[J].Biochem J,1983,209(1):229-233.
[9]冯福英,兰小鹏,杨湘越,等.大肠埃希菌和肺炎克雷伯菌质粒AmpC酶基因型及流行病学分析[J].中华检验医学杂志,2007,30(3):314-318.
