胶滴肿瘤药敏检测技术在胃癌术后化疗中的应用*
2011-11-28李照晋谭志军张建良
李照晋 谭志军 姜 伟 韩 旭 张建良
胃癌是我国发病率和病死率均很高的恶性肿瘤之一,早期诊断困难,复发和转移率高。化疗在不可切除及术后复发转移的晚期胃癌治疗中占据重要地位。如何在化疗开始前筛选出针对个体的抗癌药,预测个体肿瘤对药物的敏感性,指导临床选择最适化疗方案以提高疗效,已成为胃癌个体化化疗的关键问题。胶滴肿瘤药敏检测(collagen gel droplet culture drug-sensitivity test,CD-DST)技术是一种先进的体外药敏检测方法,在临床治疗和肿瘤相关基础研究应用中已有成功的报道[1]。我院自2006年3月—2008年3月利用CD-DST技术选择化疗方案治疗中晚期胃癌术后化疗患者53例,取得较满意效果。
1 资料与方法
1.1 一般资料 本组共53例,将其中对FOLFOX4方案(奥沙利铂、5-氟尿嘧啶和亚叶酸钙)至少1种药物体外有效者31例作为实验组,男21例,女10例,平均年龄(63.77±9.41)岁,病理类型:腺癌17例,黏液腺癌9例,其他5例。将同期术后未经CD-DST检测而以FOLFOX4方案辅助化疗的35例患者作为标准对照组,男26例,女9例,平均年龄(64.86±9.66)岁,病理类型:腺癌20例,黏液腺癌9例,其他6例。2组年龄(t=0.460)、性别(χ2=0.343)及病理类型(Z=0.115)差异无统计学意义(均P>0.05)。所有患者均经病理诊断证实,卡氏功能状态(KPS)评分≥60分,术后预计生存时间≥12个月。所有患者术前均未行放、化疗,均为术后辅助化疗且无化疗禁忌证。
1.2 主要试剂与仪器 DMEM培养基、胰蛋白酶及胎牛血清(天津灏洋生物制品科技有限公司);鼠尾胶原蛋白Ⅰ型(杭州生友生物技术有限公司);阿霉素、依托泊苷、奥沙利铂(ADM、VP-16、L-OHP,江苏恒瑞制药有限公司);顺铂、5-氟尿嘧啶、丝裂霉素(DDP、5-FU、MMC,山东齐鲁制药有限公司);48孔板(美国Corning公司);倒置显微镜(日本Olympus公司);Image-proplus 6.0图像分析系统(美国Media Cybernetics公司)。
1.3 CD-DST实验 无菌条件下切取新鲜肿瘤标本,剪碎、消化后经筛网过滤,离心后加入培养基获得单细胞悬液。冰浴条件下制备胶原蛋白-细胞混合溶液,接种于48孔细胞培养板。培养24 h后加入抗癌药物,药物测试浓度参考文献[2]:阿霉素0.02 mg/L、依托泊苷0.10 mg/L、顺铂1.00 mg/L、5-氟尿嘧啶0.02 mg/L、丝裂霉素0.03 mg/L、奥沙利铂1.00 mg/L。同时设不加药阴性对照孔,继续培养24 h。中性红染色甲醛固定后,利用倒置显微镜拍照,利用图像分析软件计算肿瘤细胞数量。加药处理组细胞数量与阴性对照组细胞数量的百分比值≤50%则认为药物在体外有效,即肿瘤对该药物敏感。
1.4 治疗方法 2组患者均给予FOLFOX4方案治疗,方法:奥沙利铂85 mg/m2,静脉滴注2 h,第1天;亚叶酸钙200 mg/m2,静脉滴注2 h,第1、2天;氟尿嘧啶400 mg/m2,静脉注射,第1、2天,600 mg/m2持续静脉滴注22 h,第1、2天。每2周重复。所有患者至少接受6周化疗。每次化疗前检查血常规、肝肾功能和心电图,化疗期间每周复查血常规2次,化疗结束后定期复查腹部B超和(或)CT。疗效评定标准:采用回顾性分析法,评价1、3年无病生存率和1、3年总生存率。疾病无病生存时间为自化疗开始至肿瘤病灶出现复发转移或疾病进展的时间间隔。总生存时间为自治疗开始至死亡或末次随访的时间间隔。不良反应按WHO抗癌药物急性与亚急性毒性表现和分度标准[3]观察和判断。
1.5 统计学方法 采用SPSS 16.0统计软件分析,符合正态分布的计量资料以±s表示,行t检验,计数资料以例(%)表示,采用χ2或秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 体外药敏检测结果 53例患者中有8例对6种药物均不敏感,26例(49.1%)只对1种药物敏感,13例(24.5%)对2种药物敏感,4例(7.5%)对3种药物敏感,2例(3.8%)对4种药物敏感。具体为对阿霉素敏感者10例(18.9%)、依托泊苷9例(17.0%)、顺铂12例(22.6%)、5-氟尿嘧啶16例(30.2%)、丝裂霉素7例(13.2%)、奥沙利铂18例(34.0%)。
2.2 2组的生存率比较 实验组的1年和3年无病生存率和总生存率均高于对照组,但只有3年总生存率差异有统计学意义(P<0.05),见表1。
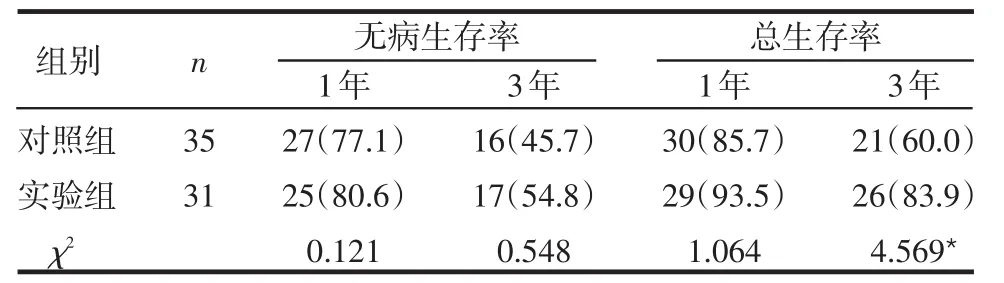
表1 2组的生存率比较 例(%)
2.3 2组的不良反应比较 2组的不良反应类型构成差异均无统计学意义(P>0.05),见表2。
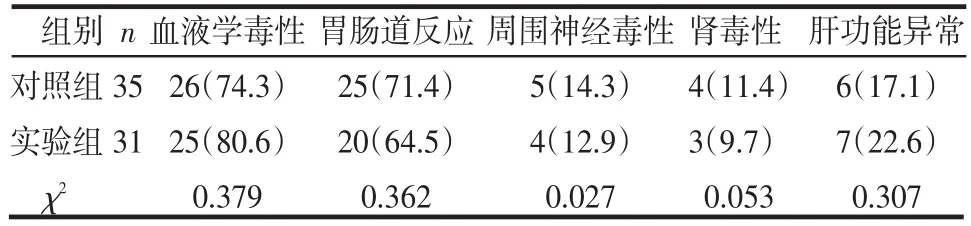
表2 2组的不良反应比较 例(%)
3 讨论
随着个体化治疗成为肿瘤治疗的主导思想,人们相继建立了如软琼脂集落形成实验、四唑蓝比色法等一系列体外药敏试验检测技术,但各自均有一定的局限性。CD-DST相对于其他药敏试验,具有细胞用量少、标本培养成功率高、体外检测结果与临床疗效间存在较好的相关性等优势,对传代胃癌细胞株进行化疗药物敏感性检测取得了较理想的结果[4]。本研究中结果显示多数患者只对单一药物敏感,奥沙利铂和5-氟尿嘧啶的单药敏感率在所测药物中最高,检测结果与实际临床单药治疗有效率基本相符[5]。实验组1、3年生存率均高于对照组,也高于常规治疗的文献报道[6]。其中3年生存率2组差异有统计学意义,实验组患者的远期生存率要高于对照组,表明随着随访时间的延长,2组间疗效的差异更加明显,提示以CD-DST结果为依据选择的化疗方案能明显延长患者生存时间,改善患者预后。2组均无因不良反应而终止治疗者,无治疗相关性死亡,其中不良反应发生率差异无统计学意义,与相关文献报道一致[7],表明CD-DST检测结果与所选化疗方案的不良反应发生率之间无相关性。
CD-DST是目前最先进的体外药敏检测技术,该技术利用胶原凝胶在37℃时形成三维立体结构的特点,在体外模仿了体内肿瘤细胞生长的微环境,使肿瘤细胞能够在与体内环境相似的条件下生长,生长的肿瘤细胞具有与体内相似的细胞形态特点,能够排除成纤维细胞对实验的干扰,在体外对抗癌药物的特异性杀伤作用做出客观评价[8]。在本研究中,经该技术指导的胃癌化疗取得了较为理想的效果,因此该技术可作为临床用药的参考依据,在胃癌个体化治疗中具有一定的指导意义。
[1]Liu J,Chen L.Current status and progress in gastric cancer with liver metastasis[J].Chin Med J(Engl),2011,124(3):445-456.
[2]Komoto C,Nakamura T,Ohmoto N,et al.Three-dimensional,but not two-dimensional,culture results in tumor growth enhancement after exposure to anticancer drugs[J].Kobe J Med Sci,2007,53(6):335-343.
[3]Huang Y,Hagiwara A,Wang W,et al.Local injection of M-CH combined with i.p.hyperthermic hypo-osmolar infusion is an effective therapy in advanced gastric cancer[J].Anticancer Drugs,2002,13(4):431-435.
[4]张建良,谭志军,姜伟.胶滴药敏试验评估不同分化胃癌细胞株对化疗药物敏感性的研究[J].天津医药,2011,39(3):233-235,290.
[5]Mori S,Kunieda K,Sugiyama Y,et al.Prediction of 5-fluorouracil and cisplatin synergism for advanced gastrointestinal cancers using a collagen gel droplet embedded culture[J].Surg Today,2003,33(8):577-583.
[6]Santini D,Graziano F,Catalano V,et al.Weekly oxaliplatin,5-fluorouracil and folinic acid(OXALF)as first-line chemotherapy for elderly patients with advanced gastric cancer:results of a phase II trial[J].BMC Cancer,2006,6:125-132.
[7]Kim YS,Hong J,Sym SJ,et al.Oxaliplatin,5-fluorouracil and leucovorin(FOLFOX-4)combination chemotherapy as a salvage treatment in advanced gastric cancer[J].Cancer Res Treat,2010,42(1):24-29.
[8]Higashiyama M,Oda K,Okami J,et al.Prediction of chemotherapeutic effect on postoperative recurrence by in vitro anticancer drug sensitivity testing in non-small cell lung cancer patients[J].Lung Cancer,2010,68(3):472-477.
