乙型肝炎病毒对树突状细胞表型成熟和功能活化的影响*
2011-11-28孟忠吉张永红柯昌征汤守兵
孟忠吉 张永红 李 东 柯昌征 汤守兵 陈 悦△
1.湖北医药学院附属太和医院感染科 2.生物医学研究所 (湖北十堰,442000)
人体感染HBV后,病毒、人体的免疫应答和肝细胞三者相互作用,共同影响着乙型肝炎的病程进展和转归。其中,宿主免疫状态是决定乙型肝炎临床转归和治疗疗效的最主要因素[1]。研究表明,慢性肝炎患者体内DC免疫指标的下降与HBV感染常同时存在,提示HBV感染慢性化与DC缺陷有关[2]。本研究探讨HBV的病毒粒子和抗原成分对DC细胞成熟和功能的影响,探索HBV相关DC细胞功能缺陷在乙型肝炎慢性化中的地位。
1 材料与方法
1.1 材料 L929细胞和小鼠脑心肌炎病毒 (EMCV)为本室保存。HBV-Met细胞培养上清 (德国杜伊斯堡-埃森大学医学院胃肠肝病科Dr.Wu提供)含HBV病毒粒子和 HBsAg、HBeAg[3]。细菌脂多糖 (LPS)为Invivogen公司产品;重组人粒细胞-单核细胞克隆刺激因子 (rh GM-CSF)和白细胞介素4(rh IL-4),重组人肿瘤坏死因子-α (TNF-α)为Peprotech公司产品;FITC-标记的抗小鼠CD-Ⅱc,PE-标记的抗小鼠MHCII、CD40、CD80、CD86单克隆抗体购自BD公司。
1.2 DC细胞分离培养 小鼠骨髓来源BM-DC的分离参照文献[3]进行。分离C57BL/6小鼠的股骨骨髓细胞,制成细胞悬液,PBS洗3遍后,悬浮于RPMI 1640中,于37℃,5%CO2培养箱中孵育2小时后,弃悬浮细胞,贴壁细胞置于完全DC培养基 (RPMI 1640,10%胎牛血清,100U/ml青霉素,100μg/ml链霉素,10 ng/ml rhIL-4,5 ng/mL rhGM-CSF)。
1.3 DC细胞的成熟 DC细胞培养的第7天,加入1μg/mL的LPS,对照组和实验组在培养基中分别加入HBV-Met细胞培养2天、12天的上清 (HBV-Met d2,HBV-Met d12),于37℃、5%CO2培养箱中培养20小时。分别收集DC细胞和细胞培养上清用于后续检测。
1.4 DC细胞的流式细胞仪检测 收集悬浮的DC细胞,用FACS标记液PBA(PBS+1%BSA+0.02%叠氮钠)调整细胞浓度为5×106/ml,加入离心管,100 μl/管,分别按直接标记法或间接标记法进行标记,流式细胞仪 (FACS calibur,BD公司)检测细胞表面表型。
1.5 病毒保护实验 DC细胞上清中的IFN水平采用病毒保护试验方法检测[4]。L929细胞以5.5×104/孔接种于 96孔板,加入100ul含10%胎牛血清的RPMI-1640培养基,37℃,5%CO2培养24小时,使细胞铺满孔底。弃上清液,加入100ul RPMI-1640,待检测的DC细胞上清液以1∶2到1∶256稀释后加入到96孔板中,继续培养24小时。把EMCV加入到各孔中,37℃,5%CO2再培养24小时。弃培养基,用含0.1%结晶紫的20%乙醇固定染色L929细胞。1个单位的IFN定义为保护50%细胞免受病毒攻击死亡的能力。
1.6 TNF生物活性分析 DC细胞上清中的TNF水平采用生物活性分析方法检测[5]。L929细胞以5.5×104/孔接种于96孔板,加入100ul含10% 胎牛血清的RPMI-1640培养基,37℃,5%CO2培养24小时,使细胞铺满孔底。弃上清液,加入100ul RPMI-1640含有2μg/ml放线菌素D。待检测的DC细胞上清液以1∶2到1∶256稀释后加入到96孔板中,继续培养24小时。弃培养基,用含0.1%结晶紫的20%乙醇固定染色L929细胞。1个单位的TNF定义为杀死50%L929细胞的能力。
2 结果
2.1 HBV抑制成熟DC细胞产生IFN的能力 DC细胞在LPS等刺激下成熟后可以产生高水平的I型干扰素,而在培养基中加入含有HBV病毒粒子和HBsAg、HBeAg等成分的细胞培养上清后 (Smet d12),DC细胞即使同样受到LPS的刺激,IFN的产量也大幅下降 (图1)。

图1 HBV抑制成熟DC细胞产生IFN的能力
2.2 HBV抑制DC细胞表面分子的表达 在DC细胞培养的第7天,DC细胞成熟过程中,使用含HBV的培养基 (Smet d12),则DC细胞成熟障碍,表面分子表达水平受到显著抑制,而正常的DC细胞(Smet d2)成熟后高表达CD40、CD80、CD86和MHC-Ⅱ (图2)。
2.3 HBV抑制成熟DC细胞产生TNF的能力 DC细胞在LPS等刺激下成熟后可以产生高水平的TNF,而在培养基中加入含有HBV病毒粒子和HBsAg、HBeAg等成分的细胞培养上清后 (Smet d12),DC细胞即使同样受到LPS的刺激,TNF的产量也大幅下降 (图3)。
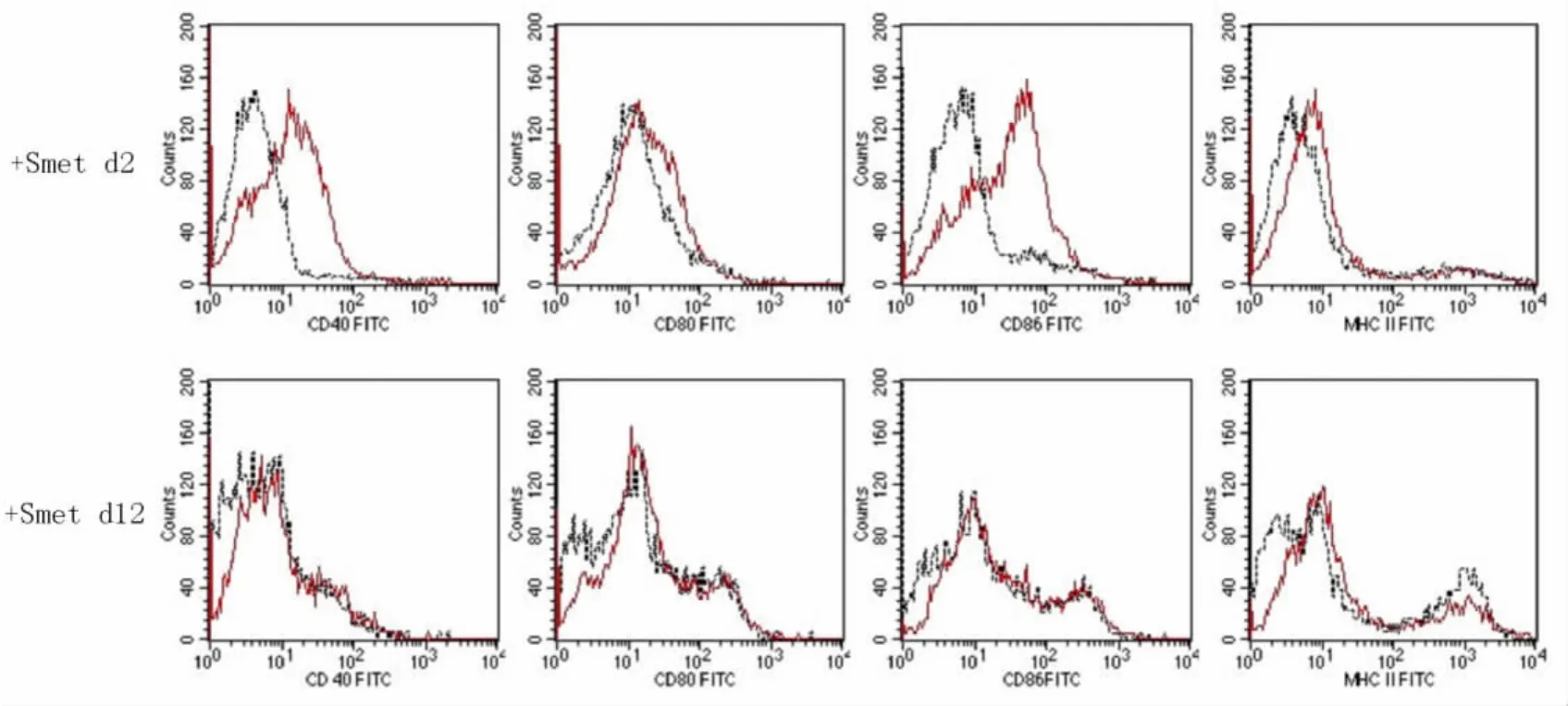
图2 HBV抑制DC细胞表面分子的表达

图3 HBV抑制DC细胞分泌TNF的能力
3 讨论
慢性乙型肝炎患者体内,HBV的抗原成分和病毒粒子直接或间接抑制免疫应答,其中DC细胞数量减少和功能障碍是造成免疫耐受的重要原因。DC是体内功能最强的抗原递呈细胞 (APC),也是唯一能活化初始T细胞的APC,在特异性激活初始T细胞、联结天然免疫和获得性免疫应答中发挥独一无二的作用。DC细胞高表达 Toll样受体 (TLRs)3、4、7、8、9,相应的配体尤其是 TLR3、4、9的配体 Poly(I:C)、LPS和CpG可以激活相应的TLR通路,诱导DC细胞活化,表现为DC细胞共刺激分子CD80、CD86、CD40和成熟标志MHC-I、MHC-II、CD83的表达上调,促进DC细胞分泌TNF、IFN等细胞因子,并且可以诱导自体T细胞活化[4]。DC的成熟在免疫应答中具有重要意义,是激活T细胞、启动免疫应答的必要条件。由于HBV抗原成分抑制DC细胞的成熟和功能活化,导致DC抗原递呈能力低下。本研究结果显示:在DC细胞成熟过程中加入HBV病毒粒子和抗原成分,显著抑制DC细胞表面共刺激分子和成熟标志的上调表达,抑制DC细胞分泌IFN和TNF的能力。提示HBV病毒粒子和抗原成分可以直接抑制DC细胞的表型成熟和功能活化,从而使DC细胞不能有效递呈HBV的抗原给T淋巴细胞,这可能是形成HBV特异性免疫耐受的重要机制。
我们前期的研究显示HBsAg、HBeAg和HBV颗粒均可以不同程度的抑制肝细胞和肝脏非实质细胞以及DC细胞等对于TLR配体的应答能力[5]。另外,HBV DNA多聚酶可以抑制IFN信号通路[6],HBV可通过前C/C蛋白下调IFN可诱导的MxA启动子活性或通过HBx蛋白依赖性的蛋白酶的活性抑制等途径来拮抗宿主的抗病毒效应机制[7],更重要的是,新生期的感染可能造成抗原特异性T细胞的中枢缺失或无能。因此,慢性乙肝患者免疫系统不健全、免疫细胞 (T细胞、DC)应答数量和质量上的不足,加上病毒颗粒和抗原的耐受原作用等因素形成HBV特异性免疫耐受,而这种耐受是导致HBV持续感染和久治不愈的根源。
国内外研究者一直在探索打破HBV特异性免疫耐受的方法,目前正在进行研究的免疫调节治疗包括细胞因子诱导的杀伤细胞 (CIK)[8]、HBV 抗原激活的 DC 疫苗[9]、特异性CTL、HBV多肽疫苗、免疫复合物疫苗等[10],大多还处于临床前研究或临床试验阶段。通过对DC成熟过程的改变来调节机体的免疫功能,可以增强免疫功能,促进慢性乙肝患者病毒控制。我们也开展了DC疫苗和DC-CIK治疗乙型肝炎和肿瘤的临床研究,取得了初步的临床疗效。另一方面,我们前期的研究发现特异性siRNA抑制嗜肝病毒基因表达和复制后,可以显著上调肝细胞免疫应答基因的表达,增强抗病毒天然免疫功能[11]。进一步的研究发现,RNAi介导的WHV mRNA降解产物可能通过活化PKR和TLR-3、7/8信号通路,诱导IFN和炎症因子的产生而活化细胞天然免疫功能。而且,HBV的基因表达和复制被RNAi封闭后,可以解除HBV对于NF-κB、IRF-3以及ERK信号通路的抑制,上调TLR的表达,恢复细胞对于TLR激动剂的反应性[3]。因此,慢性乙型肝炎的治疗应该从抗病毒和调节免疫两个方面入手,一方面封闭病毒蛋白的表达,解除HBV特异性耐受;另一方面激活/恢复天然免疫,辅助增强HBV特异性免疫应答。如何充分上调DC细胞功能,打破机体的免疫耐受,是亟待解决的问题。
[1]TAN AT,KOH S,GOH V,BERTOLETTI A.Understanding the immunopathogenesis of chronic hepatitis B virus:an Asian prospective[J].J Gastroenterol Hepatol,2008;23:833-43.
[2]WANG FS.Clinical immune characterization of hepatitis B virus infection and implications for immune intervention:Progress and challenges[J].Hepatol Res,2007;37 Suppl 3:S339-S346.
[3]WU J,MENG Z,JIANG M,et al.Hepatitis B virus suppresses tolllike receptor-mediated innate immune responses in murine parenchymal and nonparenchymal liver cells [J].Hepatology,2009;49:1132-1140.
[4]WU J,MENG Z,JIANG M,et al.Toll-like receptor-induced innate immune responses in non-parenchymal liver cells are cell type-specific[J].Immunology,2010;129:363-74.
[5]SANTOS BC,STAROBINAS N,BARBUTO JA,et al.Absence of peripheral blood mononuclear cells priming in hemodialysis patients[J].Braz J Med Biol Res,2003;36:219-25.
[6]WU M,XU Y,LIN S,et al.Hepatitis B virus polymerase inhibits the interferon-inducible MyD88 promoter by blocking nuclear translocation of Stat1 [J].J Gen Virol,2007;88:3260-9.
[7]ZHANG Z,PROTZER U,HU Z,et al.Inhibition of cellular proteasome activities enhances hepadnavirus replication in an HBX-dependent manner[J].J Virol,2004;78:4566-72.
[8]SHI M,FU J,SHI F,et al.Transfusion of autologous cytokine-induced killer cells inhibits viral replication in patients with chronic hepatitis B virus infection [J].Clin Immunol,2009;132:43-54.
[9]CHEN M,LI YG,ZHANG DZ,et al.Therapeutic effect of autologous dendritic cell vaccine on patients with chronic hepatitis B:a clinical study[J].World J Gastroenterol,2005;11:1806-8.
[10]XU DZ,ZHAO K,GUO LM,et al.A randomized controlled phase IIb trial of antigen-antibody immunogenic complex therapeutic vaccine in chronic hepatitis B patients[J].PLoS One,2008;3:e2565.
[11]MENG Z,QIU S,ZHANG X,et al.Inhibition of woodchuck hepatitis virus gene expression in primary hepatocytes by siRNA enhances the cellular gene expression [J].Virology,2009;384:88-96.
