Sox-2基因表达的变化在小鼠EST模型药物胚胎毒性评价中的应用*
2011-11-20邓淑琴查庆兵
许 华, 何 清, 邓淑琴, 查庆兵
( 暨南大学1药学院,2附属第一医院胎儿医学科,广东 广州 510632)
Sox-2基因表达的变化在小鼠EST模型药物胚胎毒性评价中的应用*
许 华1△, 何 清1, 邓淑琴1, 查庆兵2
( 暨南大学1药学院,2附属第一医院胎儿医学科,广东 广州 510632)
目的: 建立小鼠胚胎干细胞实验 (EST) 模型,验证该模型检测胚胎毒性的有效性,探讨未分化基因Sox-2表达水平的变化对药物胚胎毒性评价的作用。方法体外培养小鼠胚胎干细胞(ES),通过形态学观察、核型分析和碱性磷酸酶(AKP)染色等方法鉴定ES;MTT法检测5-氟尿嘧啶(5-FU)、苯妥英钠(DPH)和青霉素G(penicillin G)对ES的毒性作用,RT-PCR半定量分析法检测3种药物对未分化基因Sox-2表达的影响。结果成功建立EST 模型。5-FU、DPH和penicillin G细胞毒性检测结果表明,其胚胎毒性依次为强、弱和无,与临床药物毒性相一致。Sox-2基因表达结果显示,随药物浓度增高及毒性增加,Sox-2基因表达量逐渐高于阴性对照组,但均低于未分化ES细胞。结论研究结果显示,Sox-2基因的表达水平与药物毒性密切相关,可用于初步评价EST模型中药物的胚胎毒性。
模型,小鼠胚胎干细胞; 胚胎毒性; 有效性; 基因,Sox-2
自从1981年Martin、Evans等成功地分离培养出未分化小鼠胚胎干(embryonic stem,ES)细胞以来,国内外学者已相继建立了大鼠、小鼠、猪、灵长类等多种动物的ES细胞系。但迄今,只有在小鼠、猴、人类中建立的ES 细胞系可以在体外长期增殖,且能维持其未分化状态[1],其中又以小鼠胚胎干细胞体外分离培养较为简单易行而被广为用之。现有的胚胎干细胞实验模型(embryonic stem cell test,EST)大多通过检测待测物的细胞毒性及其对分化的抑制作用来确定其发育毒性[1,2]。如采用搏动心肌数或心肌细胞特异性表达基因,评价某受试物是否具有抑制ES细胞分化的毒性[3]。但有些药物如生长因子类,由于其本身促细胞增殖及促分化的生物学特性[4],如单独以细胞毒性及对某一细胞和器官分化的抑制作用来确定其胚胎毒性,可能具有片面性和不确定性。如能找到一种具有更广泛意义的ES细胞分化程度的标记物,可能会增加该模型评价胚胎发育毒性的受试物范围。
在保持ES细胞的基本特性和生物的早期发育中,Oct-4和Nanog被认为是两个基本调节器,而Sox-2则通过和Oct-4组成异二聚体发挥协同调控作用。三者的表达水平和功能状态将直接对ES细胞的多潜能性和自我更新乃至生物的早期发育产生影响。Sox-2与Oct-4基因在桑椹胚、ICM、上胚层和生殖细胞中的表达广泛重叠,不仅提示二者在维持多潜能性方面的平行作用,而且可把Sox-2作为早期鼠胚多能性谱系细胞的一个标志物[5]。本研究的目的是建立小鼠EST模型,以细胞毒性及未分化特异性基因Sox-2表达两个方面指标,检测5-氟尿嘧啶(fluorouracil,5-FU)、苯妥英钠(diphenylhydantoin sodium,DPH)和青霉素G(penicillin G)的胚胎发育毒性,以验证该方法的有效性,为EST模型的广泛应用奠定基础。
材 料 和 方 法
1材料
1.1动物 清洁级昆明小鼠,雌雄各半,6-8周龄,体质量(20±2) g,购自广东省医学实验动物中心,许可证号为SCXK粤2008-0002。
1.2细胞株 ES细胞由广州医学院附属第三医院妇产科研究所孙筱放教授惠赠;3T3细胞购自中山医科大学细胞库。
1.3试剂 DMEM 高糖培养基、新生牛血清、非必需氨基酸、明胶、丝裂霉素C(mitomycin)、胰蛋白酶购于Gibco,特级胎牛血清购于Hyclone、白血病抑制因子(leukemia inhibitor factor,LIF)购自Chemicon,RT-PCR试剂盒购于北京全式金生物技术有限公司、RNA 快速提取试剂盒购于广州东盛生物科技有限公司,Taq DNA聚合酶购于北京康为世纪公司。DPH系天津力生制药股份有限公司产品,青霉素G系华北制药股份有限公司产品,5-FU系华北制药股份有限公司产品。ES细胞培养液(高糖DMEM,20% Hyclone胎牛血清,0.1 mol/L 2-巯基乙醇,1 mol/L谷氨酰氨,0.1 mol/L非必须氨基酸,1×105U/L青霉素.1×105U/L链霉素、1×105U/L LIF)。
2方法
2.1小鼠ES细胞的培养
① 饲养层细胞即小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEF)的制备 制作方法参考文献[6],取怀孕13-14 d 的雌鼠,以胰酶消化法得到原代MEF细胞。通常取2-4代细胞作为饲养层细胞。以终浓度为10 mg/L丝裂霉素C作用MEF 2.5 h,处理过的MEF细胞以3.0×104cells/cm2密度均匀地铺在明胶处理过的培养瓶上,铺好的饲养层在1-7 d内都可以较好地支持小鼠ES细胞的生长并维持其全能性。
② 小鼠ES细胞的培养 从冻存状态复苏小鼠胚胎干细胞,在饲养层上培养2 d左右。然后用胰酶消化下来,传代至只铺有明胶的器皿内,培养18-36 h,即可去除饲养层细胞的干扰。
2.2小鼠ES细胞的鉴定
① 形态观察 相差显微镜观察ES细胞的生长行为及形态特征。
② 核型分析 取生长旺盛的ES细胞,以终浓度为5 mg/L的秋水仙素作用2.5 h,空气干燥法制片,Giemsa染色,油镜下观察细胞分裂相染色体情况。
③ 碱性磷酸酶(alkaline phosphatase,AKP)染色 用含7.5%蔗糖的4%多聚甲醛固定细胞10-15 min;再用 75 g/L硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)和50 g/L 5-溴-4-氯-3-吲哚磷酸(5-bromo-4-chloro-3-indolyl phosphate,BCIP)染色液染色1 h。
④ 未分化标记物Oct-4和Sox-2的测定 提取ES细胞和作为对照的MEF细胞的RNA,经RT-PCR检测ES细胞中未分化特异性基因Oct-4和Sox-2的表达。
⑤ 悬滴培养观察ES细胞分化行为 将胚胎干细胞与培养基混合后,以100滴/培养皿(每滴30 μL,含约750个细胞)的量置于100 mm培养皿盖上,培养皿内放入PBS溶液15 mL,将培养皿盖倒扣于培养皿上,则细胞悬滴于培养皿盖上。将此培养皿放入37 ℃ 、5%CO2孵箱中3 d。3 d后于倒置显微镜下可见每1个悬滴中有1个干细胞团(embryonic body,EB),将这些EBs转移至60 mm培养皿中,分别加入10 mL含不同浓度受试物的培养基,轻晃培养液,使其悬浮于培养液中生长2 d,可获得类胚体。类胚体继续分化可见中空的囊胚,并贴壁分化成多种类型细胞。
2.3EST有效性验证 选择发育毒性依次为无、弱、强的penicillin G、DPH和5-FU,分别求IC503T3、IC50ES、ID50ES。
① 应用EST模型对受试物细胞毒性(IC50)的检测 将500个/200 μL的3T3细胞和ES细胞分别接种在96孔的培养板上,5-FU浓度为0.01-0.12 mg/L 11个浓度,DPH浓度为20-160 mg/L 8个浓度,penicillin G浓度为200-1 400 mg/L 7个浓度[7],每浓度设3个复孔,同时设立阴性对照组(即每药的0 mg/L组)。第3 d和第5 d更换培养基,第10 d,用MTT法检测细胞活性,于570 nm处检测量其吸光度,分别计算3个药物的IC50ES和IC503T3。
② 应用EST模型对受试物抑制胚胎干细胞体外分化能力(ID50)的检测 受试物用无LIF ES培养基稀释,制备含不同浓度受试物的培养基。5-FU浓度为0.02、0.03、0.04、0.05和0.06 mg/L,DPH浓度为40、60、80、100和120 mg/L,penicillin G浓度为1 000、1 200、1 400、1 600和1 800 mg/L。按上述悬滴培养的方法,将胚胎干细胞与上述制备的含不同浓度受试物的培养基混合后,使形成EB,继续放人37℃、5%CO2,EB贴壁,在孵箱中培养5 d。于分化第10 d,采用RT-PCR方法,分别检测所培养ES中未分化的特异表达基因Sox-2和对照管家基因(GAPDH)的表达量进行半定量灰度分析,相关引物见表1,求出各受试物相对应的产生50%细胞分化抑制作用浓度,即ID50ES。

表1 Oct-4、Sox-2和内对照管家基因(GAPDH)的引物
③ 结果判定 受试物发育毒性结果的计算公式[8]:
Ⅰ.5.9157 lg(IC503T3)+3.500 lg(IC50ES)-5.307(IC503T3- ID50ES)/ IC503T3-15.72
Ⅱ.3.6511 lg(IC503T3)+2.3941 lg(IC50ES)-2.033(IC503T3- ID50ES)/ IC503T3-6.85
Ⅲ.-0.125 lg(IC503T3)+1.917 lg(IC50ES)+1.500(IC503T3- ID50ES)/ IC503T3-2.67
受试物发育毒性的判定标准 :上述结果中,Ⅰgt;Ⅱ且Ⅰgt;Ⅲ,则受试物发育毒性为1级,即无胚胎毒性;Ⅱgt;Ⅰ且Ⅱgt;Ⅲ,则受试物发育毒性为2级,即弱胚胎毒性;Ⅲgt;Ⅰ且Ⅲgt;Ⅱ,则受试物发育毒性为3级,即强胚胎毒性。
结 果
1ES细胞鉴定结果
1.1形态观察 倒置显微镜下,ES细胞呈克隆状生长,细胞紧密地聚集在一起,形似鸟巢,细胞界限不清,消化成单细胞后可见细胞小而圆,核大,胞浆小,见图1 。
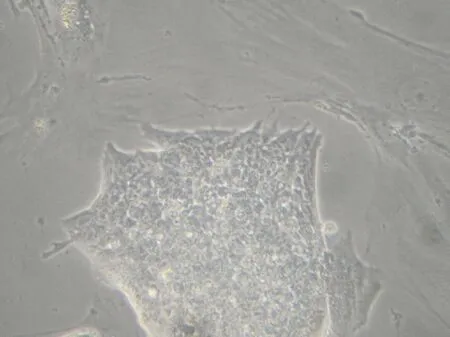
Figure 1.The embryonic stem cells cultured on mouse embryonic fibroblasts (×200).
1.2核型分析 具有正常二倍体核型,共40条染色体,见图2。

Figure 2.The karyotype of embryonic stem cells (×400).
1.3碱性磷酸酶(AKP)染色 用硝基四氮唑蓝(NBT)和5-溴-4-氯-3-吲哚磷酸(BCIP)染色液染色形成不溶性的深蓝色至蓝紫色的结晶,见图3。

Figure 3.The alkaline phosphatase staining of embryonic stem cells(×100).
1.4标记物Oct-4和Sox-2的测定 未分化标志性基因Oct-4和Sox-2均有高效表达,见图4。

Figure 4.The expression of undifferentiated gene Oct-4 and Sox-2 in embryonic stem cells.M:marker;1,3,5:the expression of Oct-4,GAPDH and Sox-2 in undifferentiated embryonic stem cells,respectively;2,4,6:the expression of Oct-4,GAPDH and Sox-2 in MEF cells,respectively.
1.5类胚体的生长行为 去除LIF的培养基分化培养10 d能获得类胚体,类胚体继续分化可见中空的囊胚,并贴壁分化成多种类型细胞,见图5。
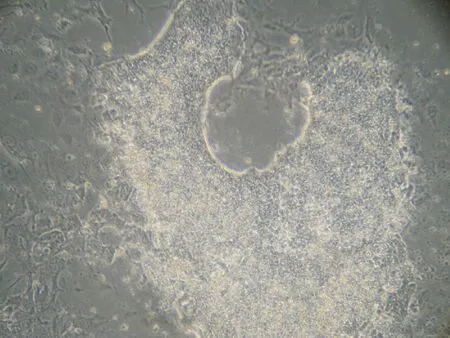
Figure 5.The blastula differentiated from embryoid (×100).
2小鼠EST模型对受试物发育毒性评价
2.1受试物细胞毒性评价 5-FU、DPH和penicillin G细胞毒性检测结果显示,随药物浓度加大,细胞的存活率明显下降,ES细胞显示出比3T3细胞更敏感的细胞毒性。5-FU、DPH和penicillin G的IC50ES分别为0.03900 mg/L、68.60 mg/L、962.0 mg/L;IC503T3依次为0.05400 mg/L、138.8 mg/L、1 475 mg/L,见图6-8。
2.2受试物对分化影响评价 RT-PCR半定量分析检测结果显示,未分化的ES细胞有Sox-2的高效表达,分化后的ES细胞Sox-2表达明显下降。随5-FU、DPH和penicillin G浓度的增加,表现为Sox-2的表达量逐渐高于阴性对照组,表明细胞分化受到不同程度抑制。5-FU、DPH和penicillin G的ID50分别为0.02400 mg/L、46.45 mg/L和1 018 mg/L,见图9-11。
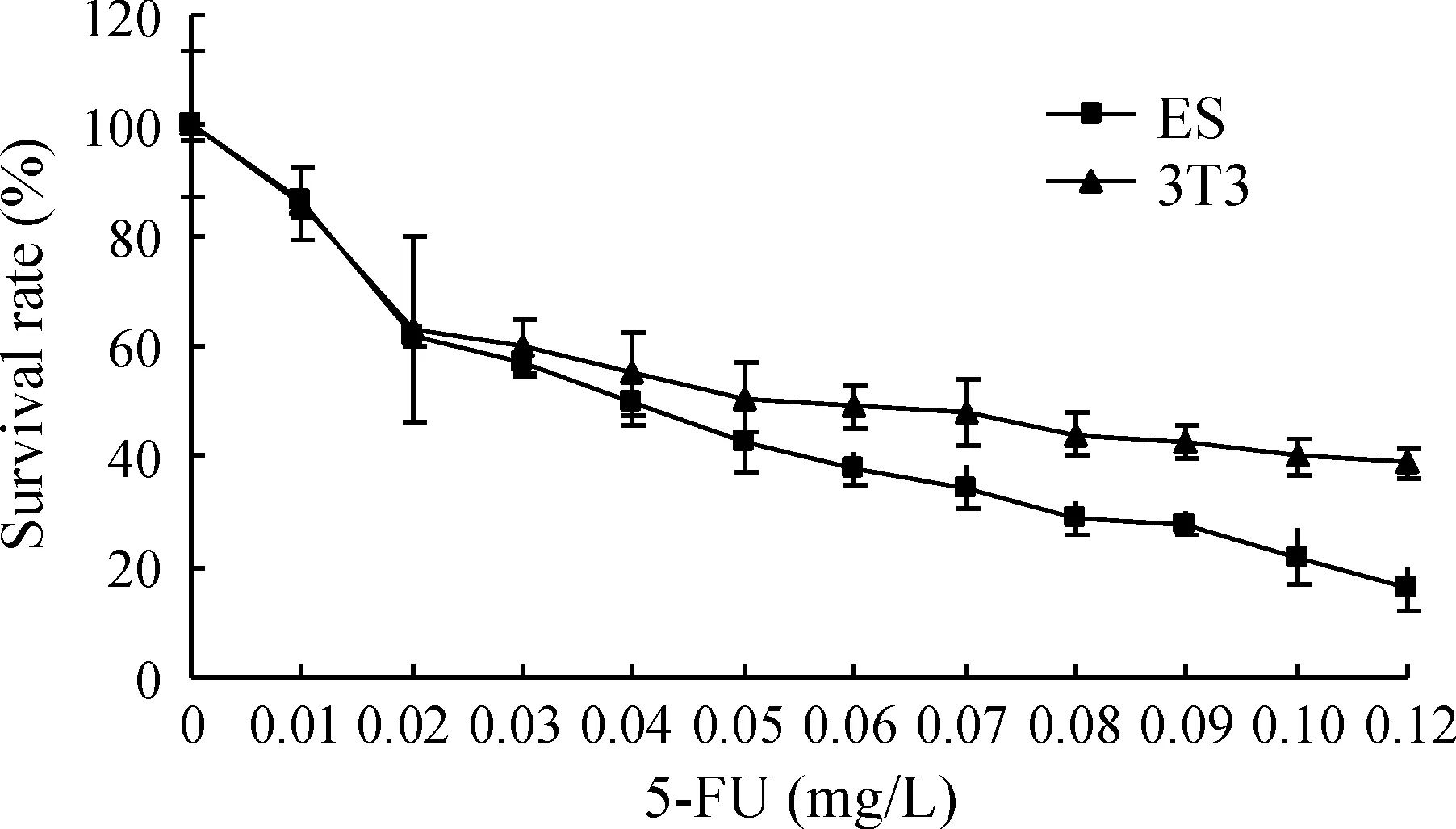
Figure 6.The toxic effect of different concentrations of 5-FU on embryonic stem cells and 3T3 cells.

Figure 7.The toxic effect of different concentrations of DPH on embryonic stem cells and 3T3 cells.
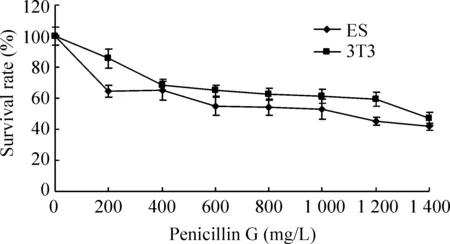
Figure 8.The toxic effect of different concentrations of penicillin G on embryonic stem cells and 3T3 cells.

Figure 9.The expression of Sox-2 in ES cells after exposed to 0 -0.06 mg/L 5-FU for 10 days.M:DL2000 marker; lane 1 and 8: Sox-2 and GAPDH expression in undifferentiated ES cells,respectively; lane 2-7: Sox-2 expression in ES cells that were treated with 0.06,0.05,0.04,0.03,0.02 and 0 mg/L 5-FU,respectively; lane 9-14: GAPDH genes expression in ES cells that were treated with 0.06,0.05,0.04,0.03,0.02 and 0 mg/L5-FU,respectively.

Figure 10.The expression of Sox-2 in ES cells after exposed to 0 - 120 mg/L DPH for 10 days.M: DL2000 marker; lane 1 and 8: Sox-2 and GAPDH expression in undifferentiated ES cells,respectively; lane 2 - 7: Sox-2 expression in ES cells that were treated with 120,100,80,60,40 and 0 mg/L DPH,respectively; lane 9 - 14: GAPDH expression in ES cells that were treated with 120,100,80,60,40 and 0 mg/L DPH,respectively.

Figure 11.The expression of Sox-2 in ES cells after exposed to 0 - 1 800 mg/L penicillin G for 10 days.M: DL2000 marker; lane 1 and 8: Sox-2 and GAPDH expression in undifferentiated ES cells,respectively; lane 2 - 7: Sox-2 expression in ES cells that were treated with 1 800,1 600,1 400,1 200,1 000 and 0 mg/L penicillin G,respectively; lane 9 - 14: GAPDH expression in ES cells that were treated with 1 800,1 600,1 400,1 200,1 000 and 0 mg/L penicillin G,respectively.
2.3受试物发育毒性的判定结果 将上诉结果代入判定公式中,得出5-FU,Ⅲgt;Ⅰ且Ⅲgt;Ⅱ,则发育毒性为3级,即强胚胎毒性;DPH,Ⅱgt;Ⅰ且Ⅱgt;Ⅲ,则发育毒性为2级,即弱胚胎毒性;penicillin G,Ⅰgt;Ⅱ且Ⅰgt;Ⅲ,则发育毒性为1级,即无胚胎毒性。
讨 论
ES细胞具有体外分化潜能,EST对受试物的检测终点由2个部分组成的,一为细胞毒性,二为胚胎毒性,通过检测受试物对ES细胞分化的影响,结合ES细胞与纤维母细胞(BALB/c 3T3)细胞毒性实验的结果,可以初步判断受试物对胚胎发育的毒性[9,10]。因有些受试物在低浓度时即可抑制ES细胞分化,而其细胞毒性的浓度却高出很多个数量级,所以将2个毒性浓度指标(IC50和ID50)进行综合考虑和计算分析,对于最终正确判定受试物产生胚胎毒性的强弱有更实际的意义[11]。本实验成功建立了EST模型,按照欧洲替代试验方法验证中心(European Center for Validation Alternative Methods,ECVAM)推荐的体外胚胎发育毒性评价方法,并采用未分化基因Sox-2的表达作为衡量分化程度的指标,对5-FU、DPH和penicillin G的胚胎毒性进行了检测和判断。结果表明,三药的胚胎毒性依次为强、弱、无,该判定结果与ECVAM所确定的受试物的发育毒性结论一致,说明本研究依据ECVAM的原则经过改良所建立的EST实验模型在进行受试物的发育毒性筛选和评价时,对受试物可能的发育毒性判断具有准确性。
Oct-4和Sox-2基因是小鼠胚胎发育早期生殖细胞谱系以及体外培养的多能干细胞特异性表达的一种发育多能性的标志基因,是ES细胞全能性的标志,被广泛用于鉴定胚胎干细胞是否处于未分化状态。在体外,Sox-2 基因在未分化的ES细胞中表达,且随着细胞分化表达下调[12],其表达量直接反映了ES细胞的分化程度,因而,可选择Sox-2评价受试物对ES细胞分化的影响。从本研究中5-FU、DPH和penicillin G对Sox-2基因的影响也可以看出Sox-2基因在ES细胞的分化受到抑制时,其表达量能维持在较高水平,且抑制程度越高,其表达量也越高,说明测定受试物对Sox-2基因表达的影响,可初步判断其对分化是否具有影响及其程度,结合细胞毒性试验结果,可综合评价该受试物的胚胎发育毒性。
现代药理与毒理研究已不仅仅局限于简单的整体动物实验,而是越来越深入到细胞和分子水平,从而能从蛋白质、酶、受体、分子通道及遗传因素等多方面更深层次地了解和分析药物与机体相互作用的机制[13]。本试验结合细胞活性和Sox-2基因的测定,从细胞毒性和对分化影响两个方面检测药物的生殖发育毒性,大大提高该方法的实用性和科学性,为我们进一步研究和筛选其它药物的生殖发育毒性打下了基础。
[1]Thomson JA,Kalishman J,Golos TG,et al.Isolation of a primate embryonic stem cell line[J].Proc Natl Acad Sci USA,1995,92 (17):7844-7848.
[2]Brown NA,Spielmann H,Bechter R,et al.Screening chemicals for reproductive toxicity: the current alternatives.The report and recommendations of an ECVAM/ETS work shop (ECVAM work shop 12)[J].Altern Lab Anim,1995,23(6):868-882.
[3]Laschinski G,Vogel R,Speiehnann H.Cytotoxicity test using blastocyst-derived euploid embryonal stem cells: A new approach toinvitroteratogenesis screening[J].Report Toxicol,1991,5(1):57-64.
[4]李 府,沈柏均,刘星霞,等.血管内皮生长因子促进小鼠胚胎干细胞的造血分化[J].中国病理生理杂志,2006,22(8):1602-1605.
[5]Boyer LA,Lee TI,Cole MF,et al.Core transcriptional regulatory circuitry in human embryonic stem cells[J].Cell,2005,122(6):947-956.
[6]都同功,黄 冰,钟女奇,等.不同条件下培养小鼠胚胎干细胞[J].中国病理生理杂志,2001,17(2): 190-192.
[7]于 洲,严卫星,张连峰,等.胚胎干细胞实验模型在发育毒性评价中有效性的初步研究[J].卫生研究,2008,37(5):570-573.
[8]Scholz G,Pohl I,Genschow E,et al.Embryotoxicity screening using embryonic stem cellsinvitro: correlation toinvivoteratogenicity[J].Cells Tissues Organs,1999,165(3-4): 203-211.
[9]Eisenbrand G,Pool-Zobel B,Baker V,et al.Methods ofinvitrotoxicology[J].Food Chem Toxicol,2002,40(2-3):193-236.
[10]Bremer S,Pellizzer C,Coecke S,et al.Detection of the embryotoxic potential of cyclophosphamide by using a combined system of metabolic competent cells and embryonic stem cells[J].Altern Lab Anim,2002,30(1):77-85.
[11]Rhodes SJ,Smith RC.Using the power of developmental biology for drug discovery[J].Drug Discov Today,1998,3(8):361-369.
[12]Yuan HB,Corbi N,Basilico C,et al.Developmental-specific activity of the FGF-4 enhancer requires the synergistic action of Sox2 and Oct-3[J].Genes Dev,1995,9(21): 2635-2645.
[13]Bremer S,Hartung T.The use of embryonic stem cells for regulatory developmental toxicity testinginvitro-the current status of test development[J].Curr Pharm Des,2004,10(22): 2733-2747.

中国病理生理学会2011年活动计划表
ExpressionofSox-2inmouseembryonicstemcelltestforscreeningdrugswithembryotoxicity
XU Hua1,HE Qing1,DENG Shu-qin1,ZHA Qing-bing2
(1PharmacyCollege,2DepartmentofFetalMedicine,TheFirstAffiliatedHospital,JinanUniversity,Guangzhou510632,China.E-mail:huax-mail@163.com)
AIM: To establish a model of mouse embryonic stem cell test (EST) to examine the toxic effect of 5-fluorouracil (5-FU),diphenylhydantoin (DPH) and penicillin G on embryonic stem cells and to confirm the validity of the model for detecting the embryotoxicity of drugs.METHODSMouse embryonic stem cells were cultured and identified by the methods of morphology,karyotype analysis and alkaline phosphatase staining.The cytotoxic effect of 5-FU,DHP and penicillin G were detected by MTT assay.The effects of 5-FU,DHP and penicillin G onSox-2 gene expression were determined by semi-quantitative RT-PCR.RESULTSEST model was successfully established.As the same as the clinical toxicities of the 3 drugs,the embryotoxicity of 5-Fu was strong,that of DPH was weak and no embryotoxicity of penicillin G was observed.With the increase in the concentrations of the drugs,Sox-2 gene expression was gradually higher than that in negative control cells,but still lower than that in undifferentiated ES cells.CONCLUSIONThe established EST model can be effectively used for preliminary evaluation of the embryotoxicity of drugs.
Models,mouse embryonic stem cells; Embryotoxicity; Validity; Genes,Sox-2
1000-4718(2011)05-0985-06
R991
A
10.3969/j.issn.1000-4718.2011.05.029
2010-10-20
2011-03-09
国家自然科学基金资助项目(No.30973602);广州市科技计划资助项目(No.2010Y1-C851);国家重大新药创制项目(No.2009ZX09103-749)
△ 通讯作者 Tel:020-85220850; E-mail: huax-mail@163.com
