米诺环素抑制MPP+ 诱导的PC12 细胞凋亡和线粒体功能损伤*
2011-12-23李晶洁黎仕锋朱文博束敏峰苏兴文邱鹏新颜光美
乐 亮, 李晶洁, 黎仕锋, 朱文博, 束敏峰, 苏兴文, 邱鹏新, 颜光美
(中山大学中山医学院药理学教研室,广东 广州510082)
帕金森病(Parkinson diseases,PD)是一种常见的慢性神经系统性疾病。PD 以运动减少、肌张力强直和震颤为主要症状;以中脑黑质致密区多巴胺能神经元进行性缺失并伴有Lewy 小体生成为主要病理特征[1-3]。长期以来,研究者针对神经元的坏死和凋亡,期望开发一种有效的神经保护剂。近几年来,人们发现四环素的衍生物- 米诺环素(minocycline)具有显著的抗炎、抗凋亡和抗氧化等作用,可能成为一种有效的多巴胺能神经元的保护剂[4-6]。本实验以PC12 细胞为多巴胺能神经元模型,观察米诺环素对1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium ion,MPP+)诱导的PC12 细胞的线粒体功能损伤的保护作用,为米诺环素应用于PD的临床治疗提供理论基础。
材 料 和 方 法
1 PC12 细胞培养及诱导分化
PC12 细胞(由中山大学中山医学院药理教研室提供)置于含10%马血清(Gibco)和5%胎牛血清(Gibco)、1 ×105U/L 青霉素和100 mg/L 链霉素的RMPI-1640(Gibco)培养基中,37 ℃、5%CO2细胞培养箱培养。
传代的PC12 细胞加入100 μg/L NGF,并培养在含胶原蛋白铺板的细胞板内,经7-8 d 的诱导分化,长出突触,用于实验。诱导分化后的PC12 细胞分别先用终浓度为0、0.01、0.1、1、10 μmol/L minocycline预处理30 min,然后加入0.5 mmol/L 的MPP+,再置于37 ℃、5%CO2细胞培养箱培养24 h,用于实验。
2 甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法检测细胞活性
PC12 细胞按密度为1 ×108cells/L、100 μL/well接种于96 孔板。经诱导分化并给药处理后,每孔加入5 g/L MTT(Sigma)溶液20 μL。37 ℃、5%CO2细胞培养箱放置4 h 后弃去培养基,加入二甲基亚砜(Sigma)100 μL。振荡10 min 后,用酶标仪(BioTek,Burlington,VT)在570 nm 波长处测定各孔的吸光度值(A值)。最后按公式:细胞的存活率=(给药组A 值/对照组A 值)×100%计算得出各组的细胞生存率。
3 Hoechst 染色检测细胞凋亡
PC12 细胞经处理后,用4% 多聚甲醛固定10 min,使用5 mg/L Hoechst 33258 暗处染色15 min,在荧光显微镜下,以340 nm 的激发光波长观察染色情况,并计算细胞核形态改变所占比例。
4 PC12 细胞内活性氧(reactive oxygen species,ROS)的测定
DCFH-DA 本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH 不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH 生成有荧光的DCF。检测DCF 的荧光就可以知道细胞内活性氧的水平。PC12 细胞经处理后,弃去培养基,96 孔板的细胞培养板中加入终浓度为10 μmol/L DCFH-DA(活性氧检测试剂盒,碧云天)100 μL/well。37 ℃细胞培养箱内孵育20 min,用无血清的培养基洗涤3 次,用多功能酶标仪(Infinite F500,奥地利),以488 nm 的激发光、525 nm 的发射光测定每孔的荧光强度。以(给药组/对照组)×100%的比率作为活性氧变化的指标。
5 线粒体膜电位(mitochondrial membrane potential,Δψm)分析
JC-1 是一种广泛用于检测Δψm的理想荧光探针。可以检测细胞的线粒体膜电位。在线粒体膜电位较高时,JC-1 聚集在线粒体的基质中,形成聚合物,可以产生红色荧光;在线粒体膜电位较低时,JC-1 不能聚集在线粒体的基质中,此时JC-1 为单体,可以产生绿色荧光。常用绿红荧光的相对比例来衡量线粒体去极化的比例[7]。孵育在6 孔板的PC12 细胞经给药处理24 h 后,去除培养基,加入等体积的JC-1(5 mg/L),37 ℃细胞培养箱内孵育20 min,用PBS 洗2 次。用激光扫描共聚焦显微镜(Zeiss),以激发光波长488 nm、发射光波长545 nm检测绿红荧光强度,以绿红荧光强度比值反映线粒体膜电位的变化。
6 统计学处理
结 果
1 Minocycline 对PC12 细胞活性的影响
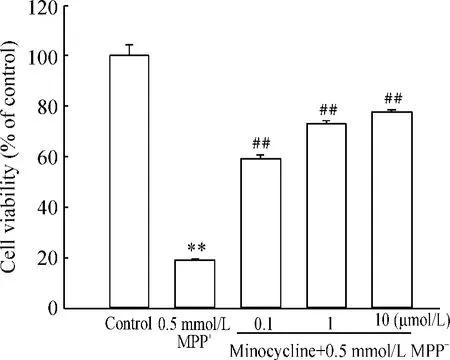
Figure 1. The protective effect of minocycline at 0. 1,1 and 10 μmol/L on decreased cell viability induced by 0.5 mmol/L MPP + in PC12 cells. PC12 cells were pretreated with 0.1,1 and 10 μmol/L minocycline for 30 min prior to 0.5 mmol/L MPP + treatment for 24 h,and then MTT assay was used to determine cell viability. ±s. n =5. **P <0.01 vs control group;## P <0.01 vs MPP + group.图1 不同浓度minocycline 预处理对MPP +诱导PC12 细胞活性下降的影响
由图1 可知,0.5 mmol/L MPP+处理PC12 细胞24 h 后,80.8%的细胞生长被抑制,与不加任何处理的细胞比较差异显著。而在用minocycline 预处理30 min 后,再用0.5 mmol/L MPP+处理,则PC12细胞的存活率明显提高,并随minocycline 浓度的升高有呈明显剂量依赖性。Minocycline 的浓度0.1 μmol/L、1 μmol/L、10 μmol/L 时,分别只有40.7%、28.8%、22.1%的细胞死亡,相对单用MPP+处理,分别提高了40.1%、54.0%、58.7%的细胞存活率。两两比较发现,给药组分别与MPP+组相比,差异显著(P <0.01),说明minocycline 能明显改善由MPP+引起的细胞活性下降。
2 Minocycline 对PC12 细胞凋亡的影响
如图2 所示,在0.5 mmol/L MPP+处理24 h 后,PC12 细胞经Hoechst 染色可以明显看到有凋亡现象发生,凋亡率为5.22%,与对照组的0.57%的凋亡率比较明显升高;而经10 μmol/L minocycline 预处理30 min 再用0.5 mmol/L MPP+处理24 h,则PC12 细胞的凋亡数明显减少,凋亡率仅为0.91%,与对照组接近。显然,minocycline 预处理能明显抑制MPP+引起的PC12 细胞凋亡。
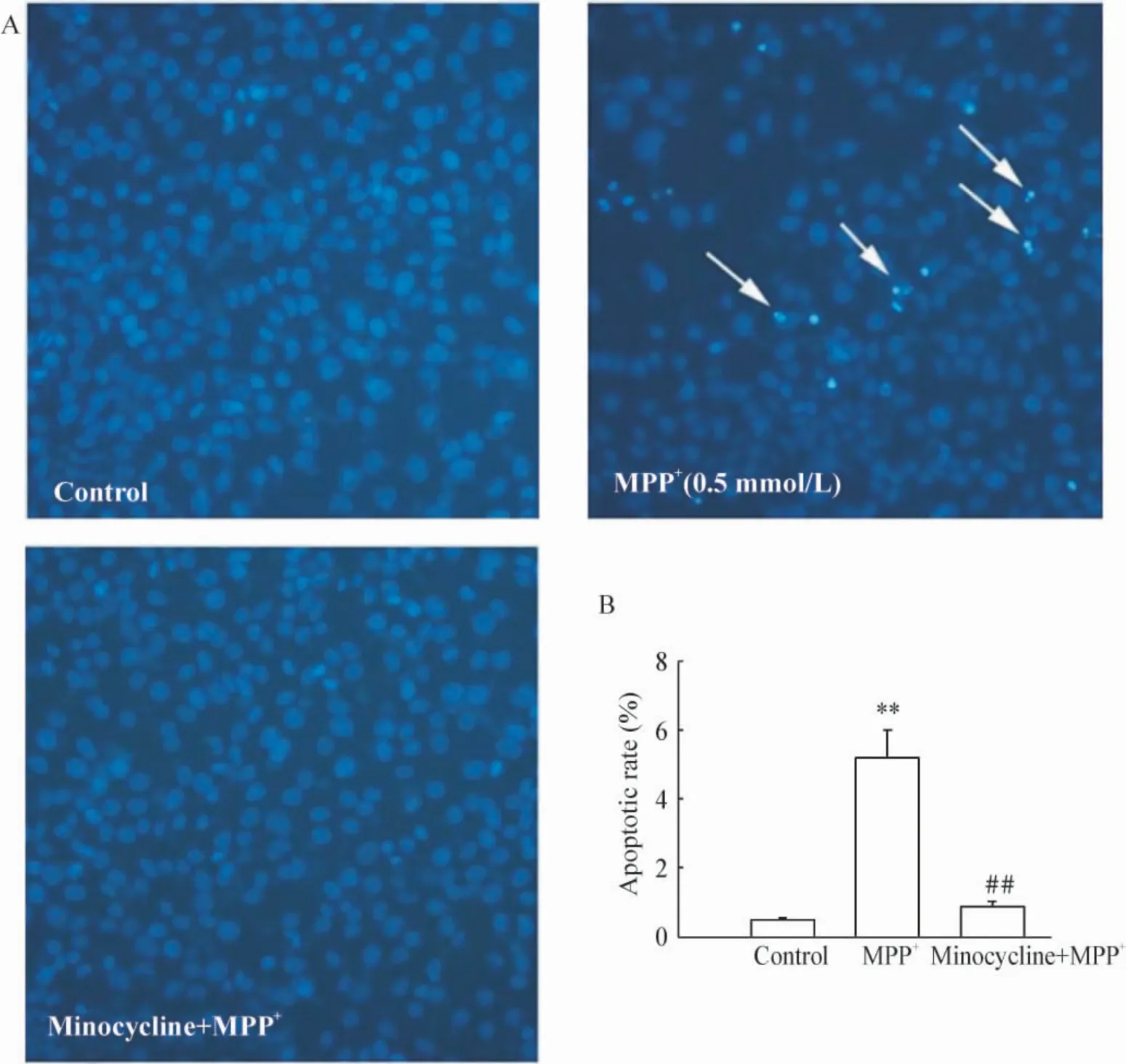
Figure 2. Minocycline inhibited the apoptosis of PC12 cells induced by MPP +. A:the apoptotic morphological changes of PC12 cells were induced by MPP +,however,pretreatment with 10 μmol/L minocycline blocked these changes(×100);B:quantitative analysis of apoptotic cells. ±s.n=5. **P <0.01 vs control group;##P <0.01 vs MPP + group.图2 Minocycline 对PC12 细胞凋亡的影响
3 Minocycline 抑制MPP+ 诱导的PC12 细胞内ROS 聚集
如图3 所示,0.5 mmol/L MPP+处理PC12 细胞24 h,能引起ROS 的大量聚集,与正常细胞比较增加230.0%,而预处理0.1、1、10 μmol/L minocycline 与正常组比较,ROS 分别只有143.7%、91.1%、93.8%,和MPP+组相比,都具有统计学差异(P <0.01)。表明minocycline 能明显抑制MPP+诱导的PC12 细胞内ROS 聚集。
4 Minocycline 抑制MPP+引起的PC12 细胞线粒体膜电位去极化
线粒体去极化时,由于JC-1 进入线粒体内减少,不能形成聚集,致使绿/红荧光强度的比例上升。在正常PC12 细胞中,绿/红荧光强度比仅为0.38,见图4,而用0.5 mmol/L MPP+处理24 h 后,绿/红荧光强度比则迅速上升为11.95,线粒体迅速去极化。而minocycline 预处理30 min,再加入0.5 mmol/L MPP+则绿/红荧光强度比降为6.72,与单用MPP+比较差异显著,说明minocycline 抑制MPP+诱导的PC12 细胞线粒体膜电位去极化。但与正常组比较差异显著(P <0.01),说明用minocycline 预处理并不能完全阻断MPP+诱导的线粒体膜电位去极化。
讨 论
PD 是继阿尔茨海默病之后影响老年人身心健康的第二大神经退行性功能障碍疾病[8]。PD 的平均发病年龄在55 岁,并随年龄的增长,发病率从20/10 万增长至120/10 万。在65 岁以上人群中,PD 发病率最高达1%[2]。目前对于PD 的发病机制众说纷纭[9],有研究显示,线粒体功能性障碍和氧化应激可能与PD 的发病有关[10,11]。
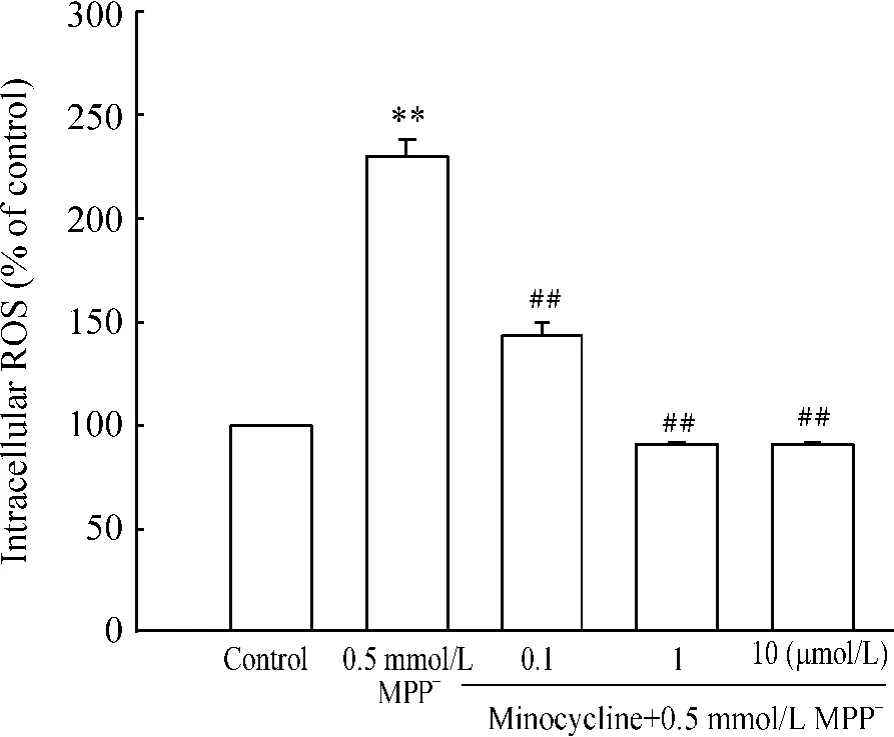
Figure 3. The inhibitory effect of minocycline at 0.1,1 and 10 μmol/L on intracellular ROS increasing induced by 0.5 mmol/L MPP + in PC12 cells. PC12 cells were pretreated with 0.1,1 and 10 μmol/L minocycline for 30 min prior to 0.5 mmol/L MPP + treatment for 24 h,and then DCFH-DA probe was used to determine intracellular ROS. ± s. n =5. **P <0.01 vs control group;##P <0.01 vs MPP + group.图3 Minocycline 对PC12 细胞内ROS 产生的影响
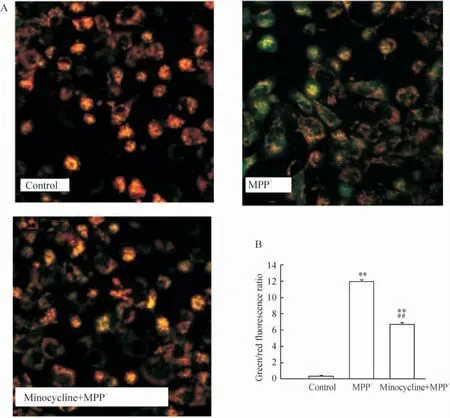
Figure 4. Minocycline attenuated mitochondrial membrane potentials in PC12 cells induced by MPP +. A:photographs of JC-1 staining in the three groups(×400);B:quantitative analysis of the ratio of mitochondrial green fluorescence to red fluorescence among groups. ±s.n=5. **P <0.01 vs control group;##P <0.01 vs MPP + group.图4 Minocycline 对PC12 细胞线粒体膜电位的影响
Minocycline 是第二代四环素类抗生素,具有较高的脂溶性,能顺利透过血脑屏障。近年来研究发现minocycline 具有抗凋亡和抗氧化的作用,因此本实验通过MPP+诱导PC12细胞建立多巴胺神经元细胞凋亡和坏死模型,观察minocycline 预处理的保护作用。PC12 细胞是大鼠肾上腺髓质嗜铬细胞瘤细胞系,富含酪氨酸羟化酶、单胺氧化酶和儿茶酚胺氧位甲基转移酶,通过NGF 诱导产生突触,具有神经分泌细胞和神经元的性质。因此PC12 细胞被广泛用于PD 的研究。
MPP+是建立PD 细胞模型的常用工具药,能诱导线粒体功能障碍和氧自由基生成增加。本实验用0.5 mmol/L MPP+处理细胞24 h 后,MTT 检测细胞活性,80.8%的细胞死亡,而Hoechst 染色计数显示5.22%的细胞发生凋亡,说明0.5 mmol/L MPP+处理PC12 细胞24 h,既能诱导凋亡,也可导致细胞坏死,且细胞坏死占多数。本实验发现,minocycline 预处理30 min,可明显改善细胞活性,并具有剂量依赖性,在给以10 μmol/L minocycline 时,细胞存活率最大,为77.9%。这与Lin 等[12]的研究相符。同时,细胞凋亡从5.22%降到0.91%,说明minocycline 具有显著保护PC12 细胞凋亡的作用,但目前对其抗凋亡机制尚无定论。Zhu 等[13]研究表明minocycline 可以抑制线粒体通透性转换介导(permeability transition- mediated)的细胞色素C 的释放,从而抑制caspase-1 和caspase-3 介导的细胞凋亡,延缓肌萎缩性侧索硬化小鼠的病情进展。
线粒体内膜分布着大量质子泵,其功能是将基质内质子H+泵入外室,从而形成横跨内膜的ΔΨm,以维持线粒体的正常功能。ΔΨm的结构基础是线粒体膜通透性转换孔(mitochondrial permeability transition pore),其开放需要Ca2+的参与。使用MPP+处理后,线粒体复合物I 活性下降,线粒体基质内氧化磷酸化反应减少,ATP 产生减少,H+生成受抑制,其ΔΨm发生改变,线粒体膜电位去极化,pH 值升高,最终导致细胞死亡。N-methyl-D-aspartate (NMDA)受体功能可能与MPP+介导的神经毒性有关[14],而minocycline 能够抑制NMDA 介导的神经毒性[12]。本实验发现minocycline 能够抑制MPP+诱导的线粒体膜电位去极化,从而保护细胞。
[1] Pereira EA,Aziz TZ . Parkinson's disease and primate research:past,present,and future[J]. Postgrad Med J,2006,82 (967):293-299.
[2] Dauer W,Predborskis S. Parkinson's disease:mechanisms and models[J].Neuron,2003,39(6):889-909.
[3] Thomas B,Beal MF. Parkinson's disease[J]. Hum Mol Genet,2007,16 (2):R183-R194.
[4] Du Y,Ma Z,Lin S,et al. Minocycline prevents nigrostriatal dopaminergic neurodegeneration in the MPTP model of Parkinson's disease[J]. Proc Natl Acad Sci USA,2001,98(25):14669-14674.
[5] Kikuchi K,Kawahara K,Biswas KK,et al. Minocycline attenuates both OGD-induced HMGB1 release and HMGB1-induced cell death in ischemic neuronal injury in PC12 cells[J]. Biochem Biophys Res Commun,2009,385(2):132-136.
[6] Wang J,Wei Q,Wang CY,et al. Minocycline up-regulates Bcl-2 and protects against cell death in mitochondria[J]. J Biol Chem,2004,279(19):19948-19954.
[7] Wang Z,Tang X,Li Y,et al. 20-Hydroxyeicosatetraenoic acid inhibits the apoptotic responses in pulmonary artery smooth muscle cells[J]. Eur J Pharmacol,2008,588(1):9-17.
[8] de Lau LM,Breteler MM . Epidemiology of Parkinson's disease[J]. Lancet Neurol,2006,5 (6):525-535.
[9] 康君芳,张宝荣,尹厚民,等.经颅磁刺激对帕金森氏病患者的运动诱发电位的研究[J]. 中国病理生理杂志,2009,25(4):725-728.
[10] Shults CW. Mitochondrial dysfunction and possible treatments in Parkinson's diseases:a review[J]. Mitochondrion,2004,4(5-6):641-648.
[11] Batandier C,Leverve X,Fontaine E. Opening of the mitochondrial permeability transition pore induces reactive oxygen species production at the level of the respiratory chain complex I [J]. J Biol Chem,2004,279(17):17197-17204 .
[12] Lin S,Wei X,Xu Y,et al. Minocycline blocks 6-hydroxydopamine-induced neurotoxicity and free radical production in rat cerebellar granule neurons[J]. Life Science,2003,72(14):1635-1641.
[13] Zhu S,Stavrovskaya IG,Drozda M,et al. Minocycline inhibits cytochrome c release and delays progression of amyotrophic lateral sclerosis in mice[J]. Nature,2002,417(6884):74-78.
[14] Church WH,Hewett SJ. Relationship between NMDA receptor expression and MPP+toxicity in cultured dopaminergic cells[J]. J Neurosci Res,2003,73(6):811-817.
