去卵巢骨质疏松模型大鼠骨组织CGRP及其1型受体的表达*
2011-11-20吕辰鹏奉水旺李淑琴张荣华
吕辰鹏, 杨 丽, 孙 影, 方 霁, 奉水旺, 粱 恒, 李淑琴, 张荣华△
(暨南大学1药学院中药学教研室,2医学院中医系,广东 广州 510632)
去卵巢骨质疏松模型大鼠骨组织CGRP及其1型受体的表达*
吕辰鹏1, 杨 丽1, 孙 影1, 方 霁2, 奉水旺1, 粱 恒2, 李淑琴1, 张荣华1△
(暨南大学1药学院中药学教研室,2医学院中医系,广东 广州 510632)
目的: 观察去卵巢骨质疏松(OP)模型大鼠骨组织降钙素基因相关肽(CGRP)及其1型受体(CGRPR1)的表达。方法将30只3月龄Sprague-Dawley(SD)雌性大鼠随机分成假手术组(15只)和模型组(15只)。采用双侧卵巢切除术复制OP大鼠模型。去卵巢12周后,应用逆转录聚合酶链式反应(RT-PCR)观察各组大鼠股骨CGRP和CGRPR1 mRNA的表达;应用免疫组织化学技术观察各组大鼠股骨远端干骺端CGRP和CGRPR1蛋白的表达。结果模型组大鼠股骨CGRP和CGRPR1 mRNA的表达较假手术组显著降低(Plt;0.01);模型组大鼠股骨远端干骺端CGRP和CGRPR1蛋白的表达较假手术组显著降低(Plt;0.01)。结论骨组织CGRP及CGRPR1表达的减少可能是OP形成的机制之一。
降钙素基因相关肽; 骨质疏松; 卵巢切除术
降钙素基因相关肽(calcitonin gene-related peptide,CGRP)在脊椎动物的骨组织广泛存在[1],对骨代谢起着重要的调节作用[2,3]。本实验通过逆转录聚合酶链式反应(RT-PCR)和免疫组织化学技术观察去卵巢骨质疏松模型大鼠骨组织CGRP及CGRP1型受体(calcitonin gene-related peptide type 1 receptor,CGRPR1)表达的变化,探讨CGRP在骨质疏松症(osteoporosis,OP)发展过程中的作用机制。
材 料 和 方 法
1材料
1.1动物 清洁级(SPF)3月龄SD(Sprague-Dawley)雌性大鼠30只,体重(242.0±12.0)g,由广东省医学实验动物中心提供,合格证号为SCXK(粤)2008-0002。
1.2主要仪器 Prodigy型双能X线骨密度仪(Lunar),2-16K型台式高速冷冻离心机(Sigma),Veriti 96孔多重控温梯度PCR仪(ABI),GEL EQ凝胶成像系统(Bio-Rad),奥林巴斯显微镜(Olympus),轮转切片机(Shandon)。
1.3主要试剂 CGRP兔抗鼠多克隆抗体(Abcam),CGRPR1兔抗鼠多克隆抗体、即用型SABC免疫组化染色试剂盒和DAB显色试剂盒(均购自武汉博士德生物工程有限公司),ReverTra Dash RT-PCR Kit(Toyobo)等。
2方法
2.1实验动物分组及模型复制 30只3月龄SD雌性大鼠,随机分为模型组(15只)和假手术组(15只)。模型组大鼠行双侧卵巢切除术[4,5],假手术组大鼠打开腹腔,找到卵巢,但不切除。
2.2标本的制备 2组大鼠于手术12周后进行双能X线骨密度检测,确定造模成功后处死。2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,开胸,暴露心脏,心脏采血后,依次灌注200-250 mL生理盐水和350-400 mL 4%多聚甲醛。灌注完毕后,迅速取左侧股骨,用DEPC水处理后,包裹密封置液氮中保存,用于RT-PCR实验。取出右侧股骨,置4%多聚甲醛中4 ℃固定24 h。取出后置20%EDTA溶液中4 ℃脱钙[6],3 d换液1次,直至大头针能顺利刺入骨组织。常规脱水,透明,浸蜡,包埋,选择远端干骺端切成4 μm厚的连续切片,贴片于防脱玻片,用于免疫组织化学染色。
2.3逆转录聚合酶链式反应
① 总RNA的提取 采用Trizol一步法提取总RNA。
② 引物的设计 以管家基因G3PDH为内参照。G3PDH引物由东洋纺(上海)生物科技有限公司提供,基因序列为:上游引物5′-ACCACAGTCCATGCCATCAC-3′,下游引物5′-TCCACCACCCTGTTGCTGTA-3′。CGRP和CGRPR1特异性引物设计参照文献[7,8],由上海捷瑞生物技术有限公司合成,基因序列为:CGRP上游引物5′-AAGTTCTCCCCTTTCCTGGT-3′,下游引物5′-GGTGGGCACAAAGTTGTCCT-3′;CGRPR1上游引物5′-TGCTCTGTGAAGGCATTTAC-3′,下游引物5′-CAGAATTGCTTGAACCTCTC -3′。
③ 第一链cDNA的合成 反应体系20 μL:RNase-free H2O 10 μL,random primer(25 μmol/L) 1 μL,Total RNA 1 μL,5×RT buffer 4 μL,dNTP mixture(10 mmol/L) 2 μL,RNase inhibitor(1×107U/L) 1 μL,ReverTra Ace 1 μL。反应条件:30 ℃ 10 min,42 ℃ 20 min,99 ℃5 min,4 ℃ 5 min,1个循环。产物于-20 ℃冰箱保存备用。
④ PCR反应 总反应体系为100 μL:第一链cDNA 20 μL,RNase-free ddH2O 67 μL,10×PCR buffer 10 μL,序列特异性上游引物(10 μmol/L)1 μL,序列特异性下游引物(10 μmol/L)1 μL,KOD Dash 1 μL。G3PDH扩增条件:98 ℃ 10 s,60 ℃ 2 s,74 ℃ 30 s,33个循环。CGRP扩增条件:94 ℃ 10 s,52 ℃ 2 s,74 ℃ 30 s,33个循环。CGRPR1扩增条件:94 ℃ 10 s,45 ℃ 2 s,74 ℃ 30 s,33个循环。
⑤ PCR产物分析 PCR反应结束后取反应液10 μL进行2%琼脂糖凝胶电泳,电泳结束后用凝胶成像系统拍照并对电泳条带进行分析。目的基因条带灰度值与G3PDH条带的灰度值之比作为目的基因mRNA 的表达水平参数。
2.4免疫组织化学染色
① 免疫组织化学染色步骤 切片常规烤片,脱蜡至水,进行SABC染色。具体步骤如下:3%H2O2室温孵育10 min;0.1%胰蛋白酶37 ℃修复抗原10 min;5%BSA室温封闭20 min;滴加Ⅰ抗(CGRP:1∶200;CGRPR1:1∶50)4 ℃过夜;第2 d复温至室温,滴加Ⅱ抗工作液37 ℃孵育20 min;滴加SABC 37 ℃20 min;滴加DAB 显色剂,显微镜下观察控制反应时间。以上步骤间均用0.2 mol/L PBS(pH=7.2)缓冲液洗涤5 min × 3次。苏木素复染,常规脱水,透明,封片。
② 阳性标记的分析及数据的采集 每张切片均在光学显微镜下(×200)分析阳性标记的分布情况,随机选取5个视野观察并拍照。应用Image-Pro Plus 6.0医学图像分析软件(Media Cybernetics)对表达结果进行半定量分析[9],测量免疫阳性部位的平均吸光度值(absorbance value,A),并以mean density作为免疫反应强度的参数。
3统计学处理
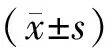
结 果
1总RNA的检测
总RNA的1%琼脂糖凝胶电泳条带在紫外灯下观察为3条带,见图1,分别为28 S、18 S、5 S,且各条带清晰拖尾轻,说明其质量和丰度均很高。在紫外分光光度计下检测各组RNA的A260/A280值均介于1.8-2.0之间,说明其纯度较高。
22组大鼠股骨CGRPmRNA的表达
RT-PCR检测表明,CGRP扩增产物为370 bp,见图2;2组CGRP目的基因条带和G3PDH看家基因条带灰度之比的结果见表1。从以上结果可以看出,模型组大鼠股骨CGRP mRNA的表达较假手术组显著降低(Plt;0.01)。
32组大鼠股骨CGRPR1mRNA的表达
RT-PCR检测表明,CGRPR1扩增产物为540 bp,见图3;2组CGRPR1目的基因条带和G3PDH看家基因条带灰度之比的结果见表1。从以上结果可以看出,模型组大鼠股骨CGRPR1 mRNA的表达较假手术组显著降低(Plt;0.01)。
42组大鼠股骨远端干骺端CGRP的表达
CGRP的阳性标记主要见于骨膜、软骨细胞、骨细胞、骨髓区细胞和成骨细胞,见图4;假手术组和模型组免疫阳性部位的平均吸光度见表2。由以上结果可以看出,模型组大鼠股骨远端干骺端CGRP的表达较假手术组显著降低(Plt;0.01)。
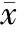
表1 CGRP和CGRPR1 mRNA的表达
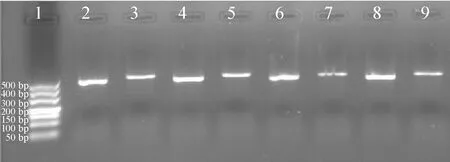
Figure 3.The expression level of CGRPR1 mRNA in femur.1: marker; 2,4,6,8: G3PDH; 3,5: CGRPR1 of sham operation group; 7,9: CGRPR1 of model group.
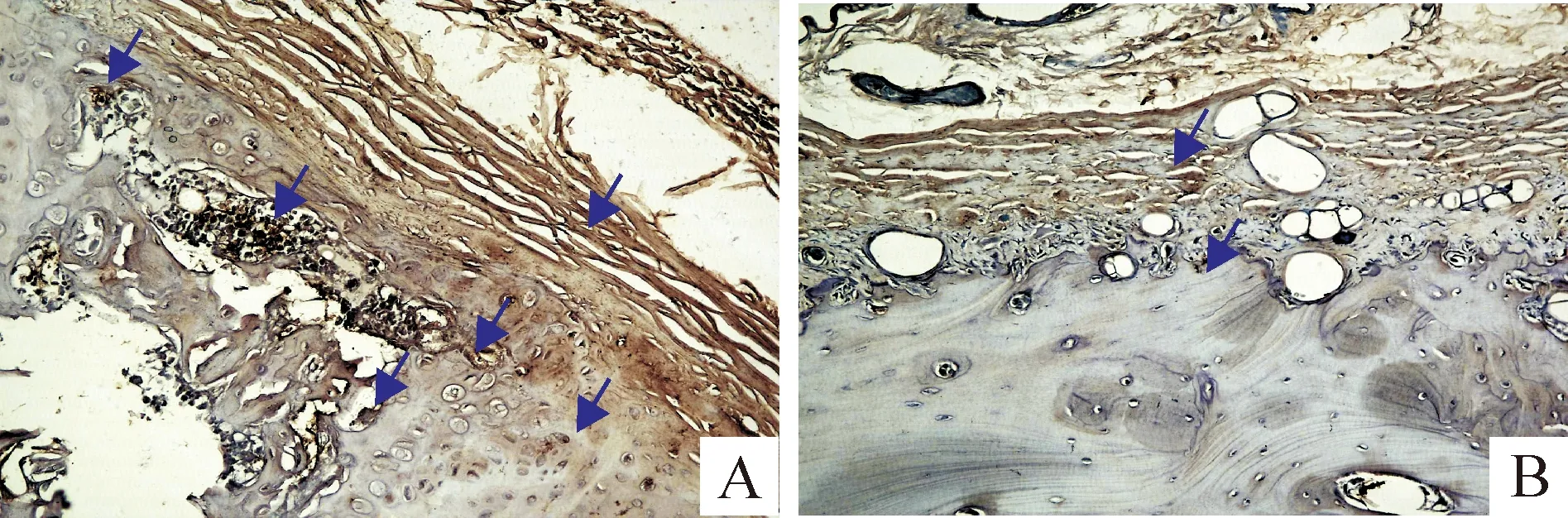
Figure 4.Immunohistochemistry of CGRP in the metaphysis of distal femur(×200).A: sham operation group; B: model group.
52组大鼠股骨远端干骺端CGRPR1的表达
CGRPR1的免疫阳性反应见图5,假手术组和模型组免疫阳性部位的平均吸光度见表2。由以上结果可以看出,模型组大鼠股骨远端干骺端CGRPR1的表达较假手术组显著降低(Plt;0.01)。
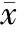
表2 CGRP 和CGRPR1免疫阳性部位的平均吸光度值
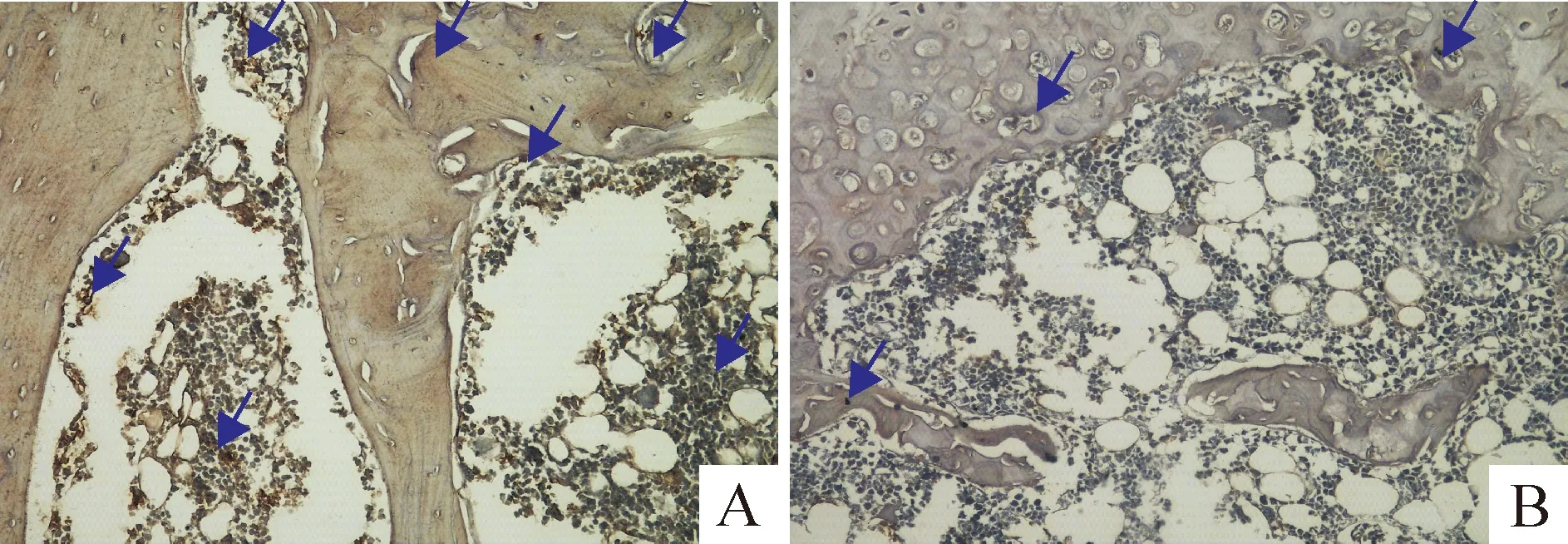
Figure 5.Immunohistochemistry of CGRPR1 in the metaphysis of distal femur(×200).A: sham operation group; B: model group.
讨 论
CGRP是一种含有37个氨基酸残基的活性多肽。它由降钙素基因编码而成,在骨组织中主要分布于骨代谢活跃、成骨活性较高的区域,如干骺端、骨膜和髓腔,且骨骺的分布较骨干多。成骨细胞(osteoblast,OB)自身也可自分泌或旁分泌CGRP[10]。
利用CGRP培养液培育SD大鼠头盖骨来源的OB,发现外源性CGRP可以促进OB增殖而有利于骨形成[11]。研究还发现CGRP通过增强胰岛素样生长因子I的自分泌作用来间接地调节OB活性,从而发挥成骨效应[12]。此外,CGRP可以明显刺激体外培养的人成骨细胞样细胞的cAMP水平,通过cAMP/PKA信号途径影响OB的代谢[13]。有研究也证实CGRP能够抑制破骨细胞(osteoclast,OC)的分化及活性[14,15],通过给去卵巢大鼠外源性注射CGRP可抑制OC的骨吸收作用,但CGRP对OC骨吸收的抑制作用,可能是通过调节OB细胞因子的释放而间接调节[3]。基于对OB活性的促进作用,CGRP能够促进骨形成[16]。Ballica等[17]用转基因技术使小鼠OB产生CGRP,发现转基因鼠的骨密度大幅增高,他们进一步发现,即使切除卵巢后,转基因鼠的骨密度也只是下降到与正常鼠相同的水平,组织学观察发现骨密度的增加源于OB数量的增加、成骨速度的加快以及骨吸收的减少。
本实验发现,大鼠行双侧卵巢切除术12周后能够形成OP,通过RT-PCR实验我们发现OP模型大鼠股骨CGRP和CGRPR1 mRNA的表达显著减少,免疫组织化学染色也表明OP模型大鼠股骨CGRP和CGRPR1蛋白的表达显著减少。这一结果提示,大鼠骨组织CGRP及CGRPR1水平的降低与OP的形成存在着一定的联系。CGRP及CGRPR1的减少可能导致其促进骨形成功能的减弱,进一步刺激OP的形成,这可能是OP形成的机制之一。但是,在OP形成过程中,是何种原因导致大鼠股骨CGRP及CGRPR1水平降低及CGRP具体通过哪种途径来调节骨代谢,还需要进一步的研究。
[1]Irie K,Hara-Irie F,Ozawa H,et al.Calcitonin gene-related peptide (CGRP)-containing nerve fibers in bone tissue and their involvement in bone remodeling[J].Microsc Res Tech,2002,58(2): 85-90.
[2]Bjurholm A,Kreicbergs A,Brodin E,et al.Substance P- and CGRP-immunoreactive nerves in bone[J].Peptides,1988,9(1): 165-171.
[3]Valentijn K,Gutow AP,Troiano N,et al.Effects of calcitonin gene-related peptide on bone turnover in ovariectomized rats[J].Bone,1997,21(3): 269-274.
[4]徐 进,荣海钦,王 东,等.人甲状胺激素相关蛋白(1-34)对去卵巢大鼠骨密质和骨生物力学性能的影响[J].中国病理生理杂志,2007,23(6):1233-1235.
[5]黎 波,张荣华.益骨胶囊对去卵巢骨质疏松大鼠骨组织cbfα-mRNA表达的影响[J].中国病理生理杂志,2008,24(4):759-762.
[6]Chang W,Tu C,Chen TH,et al.Expression and signal transduction of calcium-sensing receptors in cartilage and bone[J].Endocrinology,1999,140(12): 5883-5893.
[7]Eberhardt M,Neeb L,Vogel EM,et al.Glyceroltrinitrate facilitates stimulated CGRP release but not gene expression of CGRP or its receptor components in rat trigeminal ganglia[J].Neuropeptides,2009,43(6): 483-489.
[8]Dong YL,Vegiraju S,Chauhan M,et al.Expression of calcitonin gene-related peptide receptor components,calcitonin receptor-like receptor and receptor activity modifying protein 1,in the rat placenta during pregnancy and their cellular localization[J].Mol Hum Reprod,2003,9(8): 481-490.
[9]Franciso JS,Moraes HP,Dias EP.Evaluation of the Image-Pro Plus 4.5 software for automatic counting of labeled nuclei by PCNA immunohistochemistry[J].Braz Oral Res,2004,18(2): 100-104.
[10]Imai S,Matsusue Y.Neuronal regulation of bone metabolism and anabolism: calcitonin gene-related peptide-,substance P-,and tyrosine hydroxylase-containing nerves and the bone[J].Microsc Res Tech,2002,58(2): 61-69.
[11]廉 凯,杜靖远,张银刚.降钙素基因相关肽对大鼠成骨细胞增殖和分化的影响[J].中国骨伤,2002,15 (1):20-22.
[12]廉 凯,杜靖远.降钙素基因相关肽对鼠成骨细胞IGF-I及IGF-IR mRNA表达的影响[J].中国矫形外科杂志,2001,8(11):1084-1087.
[13]Villa I,Mrak E,Rubinacci A,et al.CGRP inhibits osteoprotegerin production in human osteoblast-like cells via cAMP/PKA-dependent pathway[J].Am J Physiol Cell Physiol,2006,291(3): C529-C537.
[14]Ishizuka K,Hirukawa K,Nakamura H,et al.Inhibitory effect of CGRP on osteoclast formation by mouse bone marrow cells treated with isoproterenol[J].Neurosci Lett,2005,379(1): 47-51.
[15]徐 琳,谭颍徽,王建华,等.失神经支配兔下颌骨骨折愈合过程中CGRP对OPG/RANKL表达的影响[J].第三军医大学学报,2005,27 (10):988-990.
[16]Huebner AK,Keller J,Catala-Lehnen P,et al.The role of calcitonin and α-calcitonin gene-related peptide in bone formation[J].Arch Biochem Biophys,2008,473(2): 210-217.
[17]Ballica R,Valentijn K,Khachatryan A,et al.Targeted expression of calcitonin gene-related peptide to osteoblasts increases bone density in mice[J].Bone Miner Res,1999,14(7): 1067-1074.
ExpressionofCGRPanditstype1receptorinbonetissuesofovariectomizedosteoporoticrats
LÜ Chen-peng1,YANG Li1,SUN Ying1,FANG Ji2,FENG Shui-wang1,LIANG Heng2,LI Shu-qin1,ZHANG Rong-hua1
(1DepartmentofChineseMateriaMedica,PharmacyCollege,2DepartmentofTraditionalChineseMedicine,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tzrh@jnu.edu.cn)
AIM: To investigate the expression levels of calcitonin gene-related peptide (CGRP) and its type 1 receptor(CGRPR1) in bone tissues of ovarectomized osteoporotic rats.METHODSFemale SD rats of 3 month old were randomly divided into model group and sham operation group (15 rats in each group).The osteoporotic model was established by bilateral ovariectomy.Twelve weeks after ovariectomy,reverse transcription polymerase chain reaction (RT-PCR) was applied to detect the mRNA expression of CGRP and CGRPR1 in the femur.The protein expression of CGRP and CGRPR1 in the metaphysis of distal femur was determined by the technique of immunohistochemistry.RESULTSThe mRNA levels of CGRP and CGRPR1 in the femur in model group were significantly lower than those in sham operation group (Plt;0.01).The protein levels of CGRP and CGRPR1 in the metaphysis of distal femur in model group were significantly lower than those in sham operation group (Plt;0.01).CONCLUSIONThe decreased expression of CGRP and CGRPR1 in bone tissues may be one of the mechanisms in the pathogenesis of osteoporotic formation.
Calcitonin gene-related peptide; Osteoporosis; Ovariectomy
1000-4718(2011)05-0976-04
R361.2
A
10.3969/j.issn.1000-4718.2011.05.027
2010-12-09
2011-03-19
国家自然科学基金资助项目(No.30772885)
△通讯作者 Tel:020-85228578; E-mail: tzrh@jnu.edu.cn
