后适应对树鼩不同脑缺血模型同一“时间窗”海马神经元保护的比较*
2011-12-23李树清罗海芸俞志成
李树清, 罗海芸, 俞志成
(昆明医学院病理生理学教研室,云南 昆明650031)
脑缺血治疗“时间窗”的选择一直是国内外脑血管病治疗研究的难点和重点。脑缺血超早期(缺血4 h)、平稳期(缺血24 h)及恢复期(缺血72 h 后)的研究显示,神经元的损伤随缺血时间的延长而加重;而选择缺血后6 h 或更早时机进行干预,已成为脑缺血治疗“时间窗”探索重要领域。业已证明,缺血后适应(postconditioning,PC)的脑保护效应可能与延长治疗“时间窗”,缓解神经元损伤进程有关。新近研究表明,缺血PC 的实施效果不仅取决于循环的数量(即开夹再灌注的次数),还取决于每次灌注持续时间以及实施PC 的时机选择[1,2]。当前缺血PC 的实施多采用开颅闭塞大脑中动脉及其随后瞬间夹闭/开放血管数次的方式实施PC[3,4],与临床脑缺血后4 h 的超早期“时间窗”相距甚远。为此,本研究选择缺血后4 h 作为实施PC 的“时间窗”,比较永久性大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)与血栓性脑缺血(thrombotic cerebral ischemia,TC)模型的PC 效果,以探讨其发生发展的病理生理机制。
材 料 和 方 法
1 动物与分组
健康成年树鼩73 只,雌雄不拘,体重(120±20)g;随机分为对照组(n =10,仅手术而不做光化学反应);TC 组(n =15,其中4 h、24 h 及72 h 各5只);MCAO 组(n =15,其中4 h、24 h 及72 h 各5只);TC+PC 组(n =15,其中4 h、24 h 及72 h 各5只);MCAO+PC 组(n=15,其中4 h、24 h 及72 h 各5 只)。另取3 只动物进行TTT 染色。
2 主要仪器
2.1 SQ-Ⅲ型光化学诱导脑血栓形成装置(本教研室研制)[3]由光源(含滤波电路及触发器)、万能支架、数控光源、散热装置以及光学系统(包括干涉滤镜及聚光透镜)组成。光源中心波长(λ)560 nm,带宽(Δλ)60 nm,光强度(1.0 W/cm2),用时间继电器控制照射时间。
2.2 JEM -1011 型电子显微镜(日立产品) Peri-Flux System 5000 型双通道LD 血流测定仪(Perimed),含PF5010 模块和接触式探头(PF5010 LDPM Unit)。探头最大输出功率:1 mW;波长780 nm;波段:20 Hz-20 kHz;倍频程:12 kHz-21 DB/octave。
2.3 血压换能器及MEDLINE 血压描记系统 南京建成生物系统研制。
3 试剂和材料
孟加拉红(Rose Bengal)购自Fluka,以0.85%生理盐水溶解,浓度为1.5 g·L-1,避光冷藏保存。
4 方法
4.1 树鼩TC 模型的建立[5]以2.5%硫喷妥钠40 mg·kg-1腹腔注射麻醉动物,固定于自制的小动物台上,消毒右顶部皮肤、矢状切开1 cm、分离颞肌,小心分离骨膜以免损伤颅骨表面出血而影响其透光性。于切口处嵌一外径2.5 cm 的消毒铝片,其中有一孔径0.5 cm 的窗孔,以便光束透照于颅骨表面。至此,于实验组动物舌下静脉注射孟加拉红生理盐水1.33 mL·kg-1,循环10 min,用SQ-Ⅲ型脑血栓形成装置照射暴露的颅骨表面10 min,其温度控制在(37.0 ± 0.1)℃,照毕,缝合皮肤、保温待动物清醒后放回饲养笼内观察。
4.2 树鼩MCAO 模型的建立 参照李树清等[6]的方法实施MCAO。将树鼩常规麻醉、固定。左侧卧位固定并于右侧面部备皮,在LM -1 型无影灯放大镜下用自制蝶形小拉钩扩开右眼上下眼睑,充分暴露眼眶并摘除眼球;透过半透明的颅骨板可见大脑中动脉(middle cerebral artery,MCA)走向,用细钢针于距视神经孔1 mm 处的颅骨板上钻2 个小孔使之与颅骨下的MCA 相交,再将小孔间相连的外骨板切开。至此,用高频电刀对准外骨板小口下的MCA 位置启动开关凝闭MCA。此后用棉球填塞眼眶,缝合创口置饲养笼观察。
4.3 电镜观察 每组动物于规定时间麻醉,小心剪开颅骨取出缺血侧(右侧)海马,置于3.5%戊二醛内保存,磷酸盐缓冲液冲洗后,丙酮酸逐级脱水,1%四氧锇酸固定24 h,LKBS 型超薄切片机半薄切片定位,再作柠檬酸铅醋酸铀双染色,在JEM-1011 型电子显微镜下观察海马超微结构(内质网及线粒体)。
4.4 树鼩海马局部脑血流(regional cerebral blood flow,rCBF)测定 分别将各组动物于既定时点前2.5 h 重新麻醉,使用KW- II 型脑立体定位仪固定动物,以电极固定器夹持套管针;以法兰克福平面(Frankfurt plane,耳眼水平面)作为立体定位坐标系统的基础,这一平面通过外耳道的中心以及眶口的下缘,冠状面与法兰克福平面垂直并同时通过2 个外耳道的中心,形成AP 0.0 平面;选择右侧海马为灌流部位,以AP 0.0 平面前2.5 mm (A2.5)、中线左(右)侧6.5 mm (L 6.5 或R 6.5 )坐标点处为穿刺点,钻开颅骨(Φl mm);使用数字式微电极驱动器控制,自硬脑膜表面向下垂直进针8.0 mm (H8.0)至海马,取出套针,并植入激光多普勒血流仪探头,用PeriFlux System 5000 型LD 血流仪及Perimed 公司提供的Perisoft 配套软件(Windows,Software version 2.50)进行曲线输出记录,将采集信号转换成血流灌注单位(perfusion unit,PU)[=运动红细胞的浓度(concentration of moving blood cells,CMBC)×平均血细胞的移动速率(velocity of blood cells,V)],利用套管使探头置于海马CA1 区,保持稳定测量30 s,选取稳定记录血流曲线300 s,作为海马CA1 区的血流值,所有数据取平均值为rCBF。当激光多普勒撞击到运动的血细胞,将发生多普勒频移。对接收光纤接收到的反射激光进行分析并显示灌注量值即PU[7]。
5 建立缺血PC 模型
树鼩脑缺血后4 h,将麻醉动物固定,行颈前正中切口,分离缺血侧(右侧)颈总动脉,用无创动脉夹将其夹闭5 min/再灌注5 min,重复3 次。同时用激光多普勒血流仪连续观察海马rCBF,见图1。
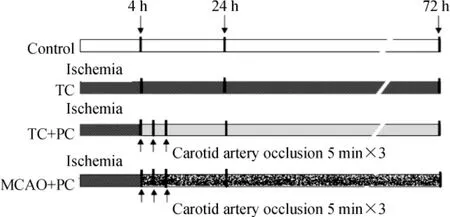
Figure 1. The protocols for postconditioning in TC and MCAO group.图1 TC 和MCAO 组的PC 模型建立
6 统计学处理
结 果
1 血栓形成与MCAO 缺血模型的TTC 染色结果
TTC 染色显示:血栓性脑缺血24 h 时TTC 染色显示缺血区呈苍白色,其范围与光化学反应区基本一致,见图2A 箭头所示;冠状切面可见梗塞部位以皮层为主。MCAO 性脑缺血24 h 时TTC 染色可见梗塞区与中动脉供血区域相吻合,梗塞面积过大,相当于患侧半球的2/3,见图2B 箭头所示为被凝闭的MCA 主干。
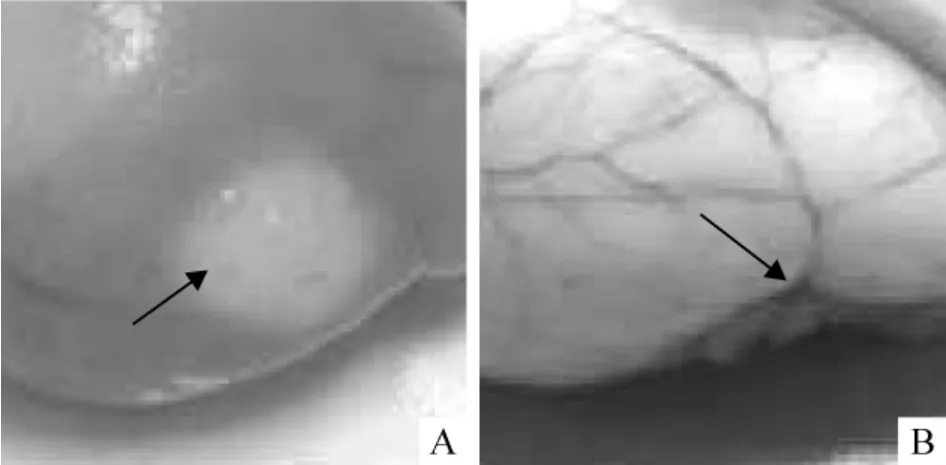
Figure 2. Comparison of infarct size in TC (A)and MCAO (B)24 h after cerebral ischemia in tree shrews.图2 树鼩TC(A)和MCAO(B)后24 h 脑梗塞面积的比较
2 PC 对血栓及MCAO 脑缺血海马神经元超微结构改变的影响
TC 与MCAO 后海马CA1 区神经元的超微结构改变以线粒体肿胀、嵴断裂以及内质网扩张为主,其中以缺血24 h 的改变为著;而细胞损伤的程度则以MCAO 组最明显。TC 后24 h 可见明显的内质网池形成,神经元固缩,见图3C。TC + PC 24 h 内质网形态接近正常,但部分线粒体肿胀,嵴断裂,见图3D。MCAO 24 h 神经元胞质水肿,内质网池形成,线粒体肿胀,见图3E;MCAO + PC 24 h 神经元内质网池形成,神经毡水肿,见图3F。PC 缓减血栓性脑缺血组海马线粒体损伤的作用较MCAO 组明显,见图3。
3 PC 对血栓及MCAO 脑缺血海马rCBF 改变的影响
研究结果显示,TC 与MCAO 组海马rCBF 降低的程度与时间有明显不同,在同一时点MCAO 组海马rCBF 降低的程度明显大于TC 组。MCAO 组凝闭脑血管后4 h、24 h 及72 h 海马rCBF 分别为(3.45±0.45)PU、(1.51 ±0.44)PU 和(1.06 ±0.03)PU(P <0.01);TC 组光化学反应后4 h、24 h 及72 h 海马rCBF 分别为(5.80 ±0.26 )PU、(2.55 ±0.28 )PU和(9.84 ±1.22)PU(P <0.01)。实施PC 后MCAO组与TC 组的rCBF 均有升高,但以TC 组的变化为著,其4 h、24 h 及72 h 的rCBF 分别为(7.20 ±0.66)PU、(10.42 ±3.75)PU(P <0.01)、(18.74 ±1.60)PU(P <0.01),呈进行性增加趋势。而MCAO实施PC 后除4 h 的rCBF 有所增加[(5.68 ±0.30)PU]以外,其余时间的rCBF 呈进行性降低,72 h 降至(2.40 ±0.39)PU,见图4、5。
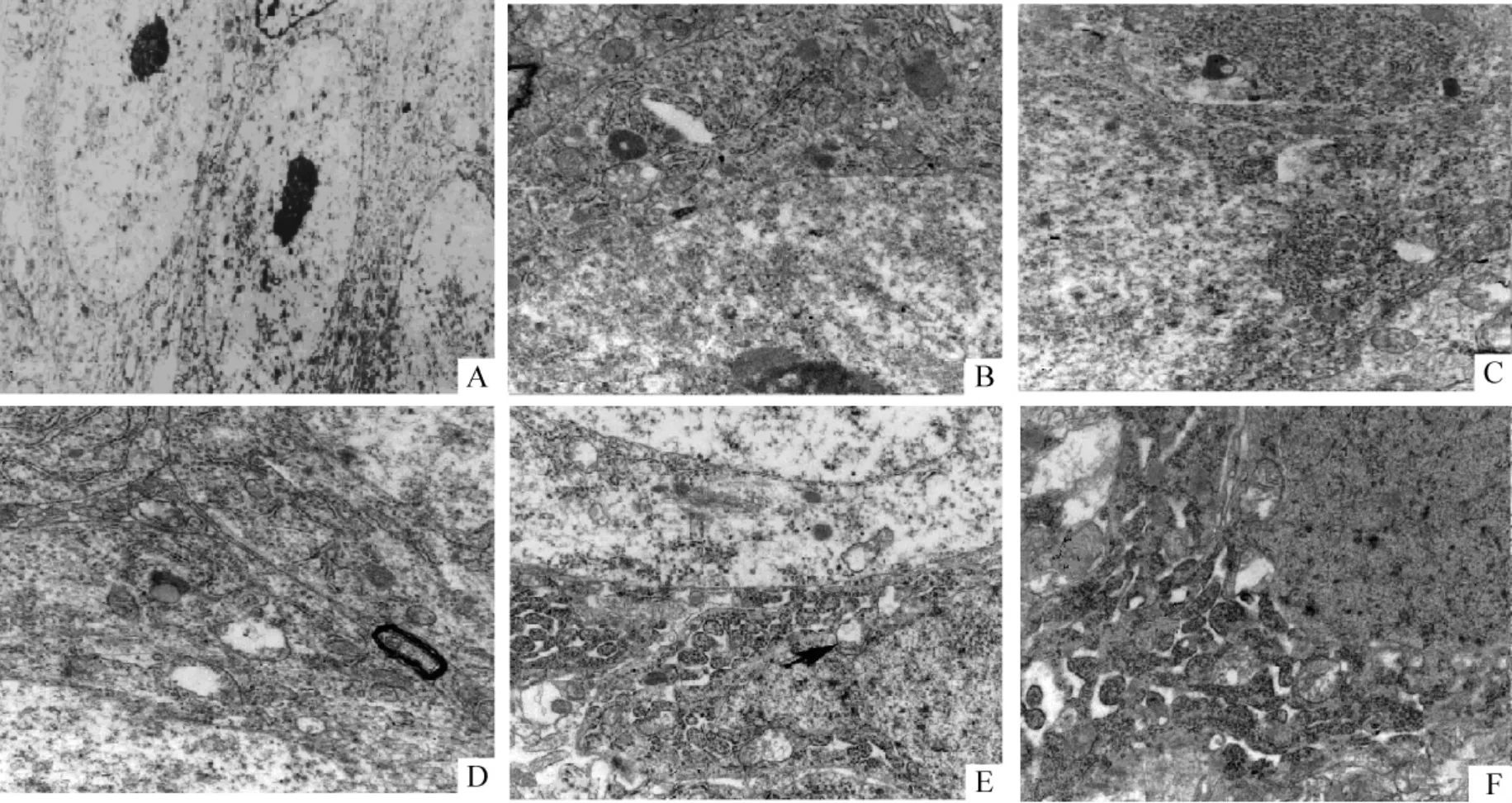
Figure 3. The normal neurons(A,×5 000)of hippocampus and mitochondria(B,×25 000).The endoplasmic reticulum pool formation and neuron-shrinkage 24 h after TC(C,×25 000)and MCAO(E,×25 000).The abnormal changes of endoplasmic reticulum and mitochondria swelling and ridge ruptures were reduced at 24 h in TC+ PC group(D,×25 000),but the endoplasmic reticulum pool formation and neuropil edema at 24 h in MCAO + PC group(F,×25 000).图3 PC 对TC 及MCAO 脑缺血海马神经元超微结构改变的影响
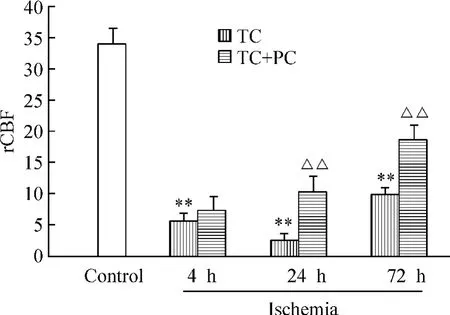
Figure 4. Effect of ischemic PC on rCBF in TC group. ±s.n =5. **P <0.01 vs control;△△P <0.01 vs TC group.图4 缺血PC 对TC 组rCBF 的影响
讨 论
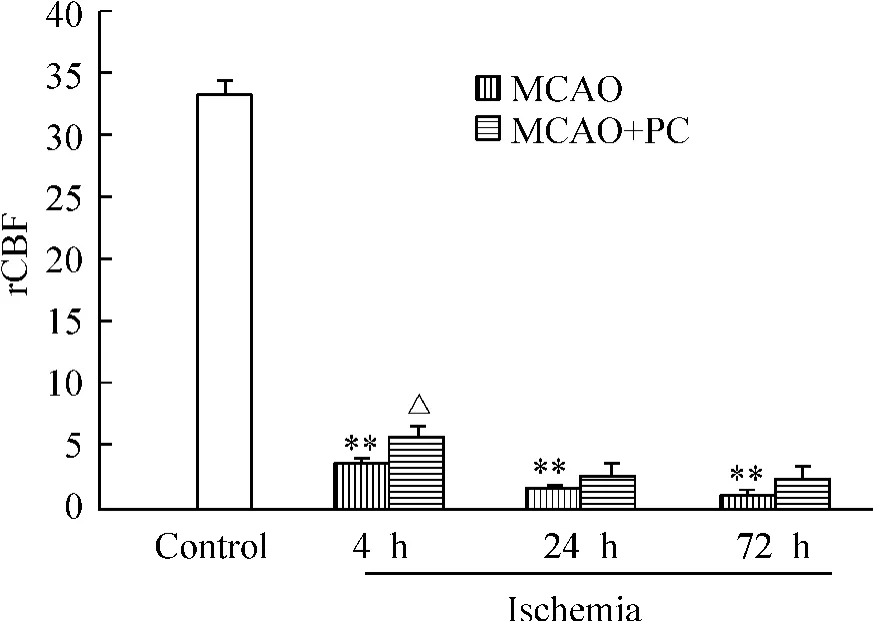
Figure 5. Effect of ischemic PC on rCBF in MCAO group. ±s.n=5. **P <0. 01 vs control;△P <0. 05 vs MCAO group.图5 缺血PC 对MCAO 组rCBF 的影响
近年的研究显示,后适应的实施时机对神经保护作用极其重要。缺血PC 的实施效果既取决于开夹再灌注的次数),又取决于每次灌注持续时间,尤其是选择PC 的时机。Pignataro 等[8]通过阻塞大脑中动脉100 min 后开夹2 min /闭塞2 min,再灌注2 min(重复5 个循环)实施脑缺血后适应可使脑梗塞面积减少23%,无统计学意义;开夹5 min/闭塞5 min,再灌注5 min(重复3 次),梗塞面积减少38%;开夹10 min/闭塞10 min (循环1 次),梗塞面积减少达65%;开夹30 min/闭塞10 min (循环1 次),则无保护作用。由此可见,实施后适应的时机是影响大脑神经保护的关键因素之一。我们的前期研究证明,光化学诱导血栓性局部脑缺血时海马的缺血性改变十分明显[9];采用反复夹闭缺血远隔区的颈总动脉3 次(每次5 min)的方式实施PC,可使缺血后72 h 时海马rCBF 自然回升至正常对照的56%以上,为夹闭远离缺血部位的颈总动脉改善海马CA1 区的血液供应提供了直接证据。
本研究证实,缺血PC 对MCAO 模型的海马神经元保护效应不及TC 模型明显,可能由于MCA 闭塞发生于一瞬间,其组织损伤的程度明显增强,且随时间的延长rCBF 进行性下降,以致缺血72 h 达最低点。然而,与MCAO 不同,TC 为局部血小板聚集、血栓形成、局部血流供应减少所致,其发病过程呈渐进性,组织损伤的程度显然不及MCAO 组严重,是实施PC 脑保护的重要基础。TC 时海马rCBF 在一定时间内可随时间的延长而下降,但由于缺血局部成生的扩血管物质,既有助于血管扩张又有利于侧支循环的建立,可能是缺血72 h 海马rCBF 增加的主要原因。我们的研究已证实PC 的机制可能包括“机械信号转导”和体内血液重新分布两方面[10],而MCAO所致的脑缺血为一种机械性、完全性的血管阻塞,不利于后适应介导的机械信号的转导,开夹时自颈总动脉进入颅内的血流无法到达海马,正是后适应对MCAO 所致脑缺血时海马rCBF 难于改善的机理所在。近年研究发现,血管机械张力可加快来自心脏的快速诱导型蛋白激酶-血清和糖皮质激素诱导的蛋白激酶1(serum and glucocorticoid - inducible kinase-1,SGK1)的活化[1]。SGK1 作为多种细胞信号转导通路和磷酸化级联反应的功能交汇点参与了人体许多重要生理功能[11],其与蛋白激酶B (PKB/Akt)具有极强的同源性,活化的SGK1 可抑制心肌细胞凋亡,激活Akt 途经可抑制神经元凋亡[12]。PC的保护效应可能与夹闭颈总动脉产生机械张力继而激活SGK1 有关。
本实验表明,PC 的脑保护效果具有模型与时间的选择性,MCAO 组的PC 效果显然不及TC 组明显。通过夹闭缺血远隔区的颈总动脉3 次(每次5 min)实施PC 的方式具有简便易行、改善脑缺血效果好的优点。与TC 组相比,MCAO 的PC 效果较差可能与其缺血的细胞与细胞间的信号联系以及细胞与基质相互作用所介导全身“神经-血管单元(neurovascular unit)”反应障碍有关[13]。然而,临床应用缺血后适应调控神经损伤的可行性仍值得进一步探索,若未获得反复循环的最佳再灌注,对某些患者可能具有一定危险性[14]。
[1] Takuma A,Takashi M,Mikhail N,et al. Serum and glucocorticoid-responsive kinase-1 regulates cardiomyocyte survival and hypertrophic response [J]. Circulation,2005,111(1):1652 -1659.
[2] Zhao H. Ischemic postconditioning as a novel avenue to protect against brain injury after stroke[J]. J Cereb Blood Flow Metab,2009,29(9):873 -885.
[3] Gao X,Ren C,Zhao H. Protective effects of ischemic postconditioning compared with gradual reperfusion or preconditioning[J]. J Neurosci Res,2008,86(11):2505 -2511.
[4] Ren C,Yan Z,Wei D,et al. Limb remote ischemic postconditioning protects against focal ischemia in rats [J].Brain Res,2009,1288(1):88 -94.
[5] Li SQ,Meng Q,Zhang LN. Experimental therapy of a platelet - activating factor antagonist (Ginkgolide B)on photochemical induced thrombotic cerebral ischemia in tree shrews[J]. Clin Exp Pharmacol Physiol,1999,26(10):824 -825.
[6] 李树清,李麟仙,周凤鸣,等.实验性脑梗塞及监测指标的探讨[J].中国病理生理杂志,1989,5(7):452 -455.
[7] Fukuda K,Yao H,Ibayashi S,et al. Ovariectomy exacerbates and estrogen replacement attenuates photothrombotic focal ischemic brain injury in rats[J]. Stroke,2000,31(1):155 -160.
[8] Pignataro G,Meller R,Inoue K,et al. In vivo and in vitro characterization of a novel neuroprotective strategy for stroke:ischemic postconditioning[J]. J Cereb Blood Flow Metab,2008,28(2):232 -241.
[9] Li SQ,Zhang Y,Yang LJ. Improving effect of Ginkgolide B on mitochondrial respiration of ischemic neuron after cerebral thrombosis in tree shrews[J]Chin Med J,2007,120(17):1529 -1533.
[10] Lo EH,Broderick JP,Moskowitz MA. tPA and proteolysis in the neurovascular unit[J]. Stroke,2004,35(2):354 -356.
[11] 李彩蓉,蔡 飞,黎 荣,等.氟伐他汀对醛固酮诱导的系膜细胞SGK1 及CTGF 表达的影响[J]. 中国病理生理杂志,2010,26 (5):956 -960.
[12] 陈诗鸿,倪一虹,庄向华.脂联素激活AKT 抑制H2O2诱导的大鼠心肌细胞凋亡[J]. 中国病理生理杂志,2010,26 (11):2161 -2164.
[13] Zhao H,Sapolsky RM,Steinberg GK. Interrupting reperfusion as a stroke therapy:ischemic postconditioning reduces infarct size after focal ischemia in rats[J]. J Cereb Blood Flow Metab,2006,26(9):1114 -1121.
[14] Wong GT,Li R,Jiang LL,et al. Remifentanil post -conditioning attenuates cardiac ischemia-reperfusion injury via κ or δ opioid receptor activation[J]. Acta Anaesthesiol Scand,2010,54(4):510 -518.
