RIP2对大肠杆菌的抗菌作用研究*
2011-11-20胡巢凤陆大祥
席 琼, 胡巢凤, 张 芸, 陆大祥, 蒋 宇
(暨南大学医学院病理生理学教研室,国家中医药管理局三级科研实验室,广东 广州 510632)
RIP2对大肠杆菌的抗菌作用研究*
席 琼, 胡巢凤△, 张 芸, 陆大祥, 蒋 宇
(暨南大学医学院病理生理学教研室,国家中医药管理局三级科研实验室,广东 广州 510632)
目的: 探讨受体相互作用蛋白2(RIP2)对人肠细胞清除大肠杆菌的作用。方法使用阳离子聚合物JetPeiTM介导人RIP2基因(pEGFP-C2-PIP2)转染人结肠癌SW480细胞株,以转染空质粒及未转染的SW480细胞株作为对照,应用RT-PCR检测外源性RIP2 mRNA水平的变化、Western blotting法检测细胞RIP2蛋白的表达;并利用大肠杆菌ATCC25922感染转染和未转染的SW480细胞24 h,用平板培养菌落计数活菌数。应用p38 MAPK通路抑制剂SB203580作用于3组细胞,计数活菌数。结果与对照组相比,转染RIP2组其mRNA和蛋白表达水平均有明显升高(Plt;0.01,Plt;0.05),表明RIP2表达质粒成功转染SW480细胞。转染RIP2细胞能清除胞内大肠杆菌;而阻断p38 MAPK信号通路后,RIP2清除胞内大肠杆菌的作用被阻断。结论RIP2转染细胞可有效清除胞内大肠杆菌,这种胞内细菌的清除作用可能与p38 MAPK信号通路有关。这些结果提示RIP2在细菌感染性疾病治疗中具有广阔的临床应用前景。
受体相互作用蛋白2; 基因转染; 抗菌作用
受体相互作用蛋白2(receptor-interacing protein 2,RIP2),也称为RIPK2、RICK或CARDIAK,是RIP激酶家族的成员,其基因全长1 623 bp,表达61 kD蛋白,在多种组织中均有分布。RIP2的 N-末端包含有信号转导途径中关键的丝/苏氨酸激酶结构域, C-末端含caspase募集结构域(caspase recruitment domain,CARD),可与多种蛋白相互作用,发挥其生理功能。RIP2参与固有免疫和获得性免疫中多个受体的信号转导[1],被认为是固有免疫和特异性免疫信号途径的重要衔接分子,在免疫及炎症反应中起重要作用。
固有免疫系统通过免疫识别模式受体(pattern-recognition receptors,PRRs)识别入侵的病原体,其主要包括Toll样受体(Toll-like receptors,TLRs)家族和NOD样受体(NOD-like receptors,NLRs )家族,而RIP2是NLRs的下游因子,激活后能启动下游分子级联反应,衔接NLRs并激活NF-κB (nuclear factor-κB)信号转导通路[2],引起宿主的天然和获得性免疫反应,在先天性免疫反应和清除病原感染的炎症反应中起着重要作用。对RIP2的研究可以加深我们对细胞内外模式识别受体参与免疫应答和炎症防御机制的认识。本实验选择大肠杆菌(Escherichiacoli,E.coli) 为入侵病原体,利用转染RIP2基因观察其表达情况,同时将转染细胞与大肠杆菌共同孵育,观察RIP2对大肠杆菌的作用,并初步探讨其作用机制。
材 料 和 方 法
1材料
质粒pEGFP-C2为本室保存;pEGFP-C2-RIP2真核表达质粒由本课题组构建,经酶切及测序鉴定后保存在本实验室。大肠杆菌ATCC25922由暨南大学附属华侨医院检验科惠赠。人结肠癌细胞系SW480由暨南大学病理教研室惠赠。细胞转染所用的阳离子聚合物JetPEITM为Polyplus产品;细胞培养基DMEM为Gibco产品;胎牛血清购自Hyclone;细胞培养板为Corning Costar产品;Trizol、MMLV reverse transcriptase试剂盒购自Invitrogen;PCR试剂盒购自TaKaRa;BCA蛋白质定量测定试剂盒为上海申能博彩生物公司产品;兔抗人RIP2多抗购自Santa Cruz,羊抗兔IgG抗体购自博士德生物公司;Triton X-100购自Sigma;p38 MAPK抑制剂SB203580购自Promega。其余试剂为国产分析纯。
2细胞培养及重组质粒转染细胞
SW480细胞采用DMEM高糖培养液,加入10%的胎牛血清及0.1 g/L青霉素和链霉素,在37 ℃、5%的CO2条件下进行细胞培养及传代。SW480细胞按5×108cells/L分别接种于6孔板内,待细胞生长至80%融合时进行转染。将2 μg质粒DNA稀释于150 μL浓度为0.15 mol/L的NaCl中(DNA溶液);4 μL JetPEITM稀释于150 μL浓度为0.15 mol/L NaCl中(JetPEITM溶液),充分混匀后将JetPEITM溶液加入DNA溶液中,将该JetPEITM/DNA复合物在室温下孵育20 min后加入培养SW480细胞的6孔板,轻摇混匀,置于37 ℃、5%CO2培养箱中孵育。48 h后将转染的SW480细胞置于Olympus BX-51倒置荧光显微镜下,用488 nm波长紫外光激发,发射光波长为507 nm观察细胞中绿色荧光的表达。
3RT-PCR法检测RIP2的mRNA表达
实验分组:(1) pEGFP-C2-RIP2转染组;(2) pEGFP-C2转染组;(3)未转染组。按Trizol试剂盒说明书抽提细胞总RNA,以1 μg RNA为模板,按照MMLV逆转录试剂盒说明书合成cDNA;根据GenBank资料设计RIP2引物如下:上游5’-TCCCTACCACAAACTCGCC-3’;下游5’- GCATCCTTTCTTTCACTGTCG-3’(扩增产物150 bp);以GAPDH(上游5’- CCAATATGATACCACCCATG-3’,下游5’- AGGTCCACCACTGACACGTT-3’,扩增产物为594 bp)为内参照进行PCR反应。RT-PCR反应条件:98 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃延伸10 min。取5 μL用1.5%琼脂糖凝胶电泳,在凝胶成像仪上成像及灰度分析,分析目的条带与相应的GAPDH条带灰度比值。
4Western蛋白印迹检测RIP2蛋白表达
实验分组如前。收集转染或未转染的SW480细胞5×106cells,培养细胞用冰冷PBS洗3次后,加入PMSF裂解缓冲液。冰浴30 min后将裂解物以12 000×g离心5 min,收集上清。Bradford法检测蛋白质的含量。在SDS-PAGE(5%浓缩胶,10%分离胶)上进行分离后,电转移至硝酸纤维(PVDF)薄膜上。5% 脱脂牛奶封闭2 h后,将PVDF膜与兔抗人RIP2多抗4 ℃过夜孵育。洗膜3次后与生物素标记的抗兔IgG抗体室温孵育1 h。最后用ECL试剂检测结果,并曝光于X光片上。Bio-Rad图像分析仪分析目的蛋白条带与相应的GAPDH条带相对灰度比值。
5细菌培养及计数
挑取ATCC25922单菌落,在LB液体培养基中37 ℃、150 r/min振摇培养4 h,取100 μL菌液至LB固体培养板,37 ℃孵箱培养过夜,24 h后收集细菌至离心管,10 000 r/min离心5 min收集细菌沉淀,将细菌重悬于无菌生理盐水,利用分光光度计测定菌液A值(600 nm),用平板记数法检测最终培养浓度。再以已知菌浓度的菌液A值为横坐标,以细菌浓度为纵坐标,建立细菌数与A值关系曲线,获得直线回归方程[3],从而确定细菌感染浓度。
6大肠杆菌胞内活菌数量的测定
大肠杆菌按上法定量至4×1010CFU/L。按常规培养SW480细胞,将浓度调至4×108cells/L,每孔加0.1 mL于48孔培养板,待细胞贴壁生长至80%,弃去培养孔中的液体,每孔加入0.1 mL菌液,37 ℃共同作用2 h后弃去菌液并用PBS洗3次以去除未黏附的细菌。再将每孔加入含有10%胎牛血清、100 mg/L庆大霉素的DMEM培养基300 μL(庆大霉素不进入细胞内,只杀死胞外细菌),置于37 ℃、5% CO2培养箱中孵育以杀死细胞外细菌。分别于实验4、24和36h后每孔加入Triton X-100裂解细胞15 min,漩涡振荡后将裂解液作10倍系列稀释,每个稀释度取100 μL涂布LB平板(每个稀释度取涂2块板),置于37 ℃温箱中培养24 h。观察菌落形成单位(CFU)数量,计算出每孔细胞内的活菌数量。
7各组细胞对大肠杆菌胞内清除作用的检测
实验分3组:(1) pEGFP-C2-RIP2转染细胞+细菌;(2) pEGFP-C2转染细胞+细菌;(3)未转染细胞+细菌。将以上分组细胞以4×104cells接种于48孔板,实验方法如前所述,在细菌感染细胞后的24 h用Triton X-100裂解细胞15 min,漩涡振荡后将裂解液作10倍系列稀释,每个稀释度取100μL涂布LB平板(每个稀释度取涂2块板),置于37℃温箱中培养,24 h后计数胞内活菌数。
8SB203580对各组细胞感染大肠杆菌的影响
实验分6组:(1)pEGFP-C2-RIP2转染细胞+细菌+SB203580;(2)pEGFP-C2-RIP2转染细胞+细菌;(3)pEGFP-C2转染细胞+细菌+SB203580;(4)pEGFP-C2转染细胞+细菌;(5)未转染细胞+细菌+SB203580;(6)未转染细胞+细菌。细菌感染前用10 μmol/L的SB203580刺激细胞2 h,之后加入细菌共孵育,方法如前述。24 h后计数胞内活菌数。
9统计学处理
结 果
1RIP2mRNA在人结肠癌细胞株SW480中的表达
pEGFP-C2-RIP2和pEGFP-C2转染细胞48 h后,多数细胞胞浆区可观察到绿色荧光蛋白的表达,未转染组无绿色荧光蛋白表达。RIP2 mRNA片段为150 bp,内参照GAPDH片段为594 bp,见图1,扩增产物与预计一致。pEGFP-C2-RIP2转染细胞组RIP2 mRNA的含量较pEGFP-C2转染细胞组和未转染细胞组明显增高,组间比较差异显著(Plt;0.01)。而pEGFP-C2转染细胞组和未转染细胞组之间RIP2 mRNA表达无显著差异(Pgt;0.05),见图1。
2RIP2蛋白在SW480细胞中的表达
Western blotting结果显示,在61 kD处有明显的特异性蛋白条带,与RIP2蛋白的分子量相符。pEGFP-C2-RIP2转染细胞组RIP2 蛋白表达较pEGFP-C2转染细胞组和未转染细胞组明显增高(Plt;0.05)。而pEGFP-C2转染细胞组和未转染细胞组之间RIP2 蛋白表达无显著差异(Pgt;0.05),见图2。
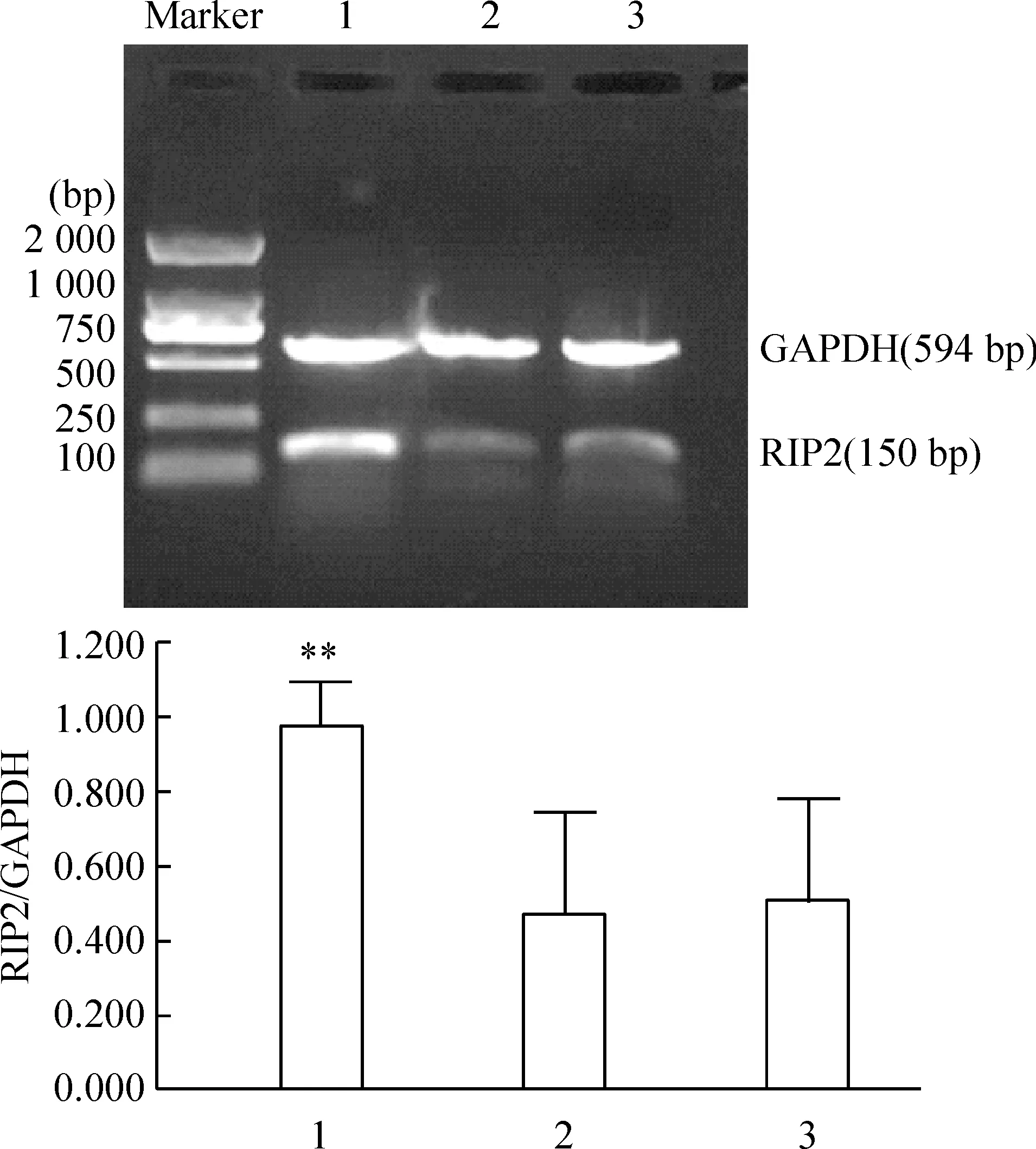
Figure 1.RIP2 mRNA expression in SW480 cells detected by RT-PCR.Marker:2 000 bp DNA marker;1: SW480 cells transfected with pEGFP- C2-RIP2;2: SW480 cells transfected with pEGFP- C2;3: SW480 cells without transfection.±s.n=3.**Plt;0.01 vs 2 and 3.
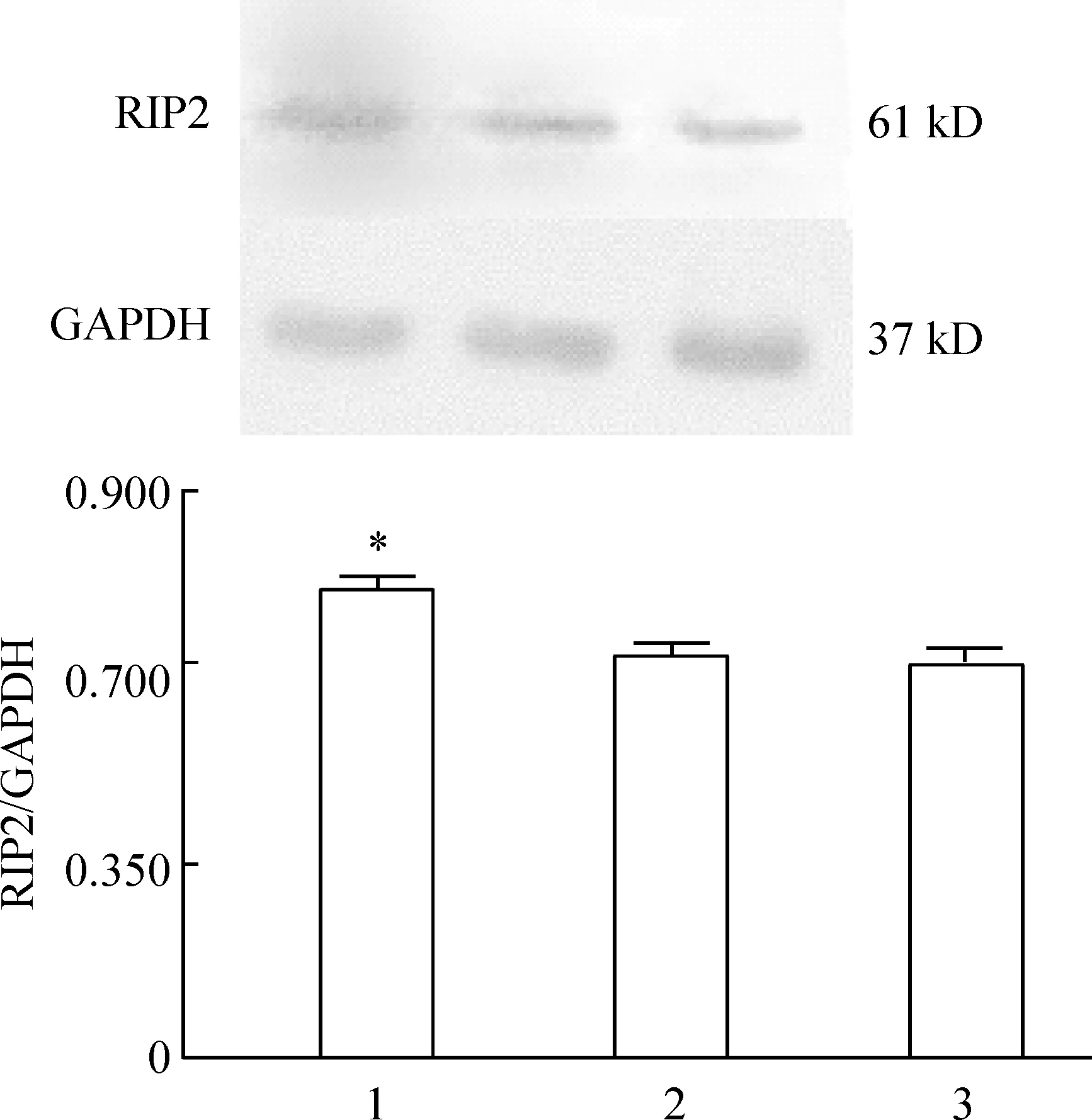
Figure 2.RIP2 protein expression in SW480 cells detected by Western blotting.1: SW480 cells transfected with pEGFP- C2-RIP2;2: SW480 cells transfected with pEGFP- C2;3: SW480 cells without transfection±s.n=3.*Plt;0.05 vs 2 and 3.
3大肠杆菌细菌数与A值的关系
以已知菌浓度的菌液A值为横坐标,以细菌浓度为纵坐标,建立细菌数与A值关系曲线,得到该菌的回归方程:细菌数Y=14.362X-0.052,见图3。用此方程可计算细菌感染浓度。本研究选择细菌感染浓度为4×1010CFU/L,每孔加入0.1 mL菌液。
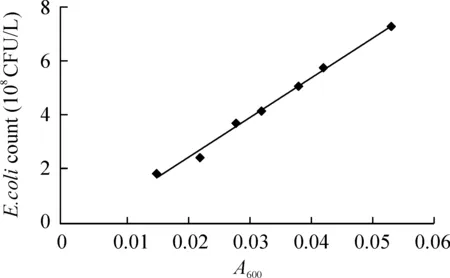
Figure 3.The relationship curve between A value and bacterial number of E.coli.
4大肠杆菌胞内生长曲线
实验结果表明,随感染时间延长(4 h、24 h、36 h),SW480细胞内大肠杆菌数量不断增加,见图4。本研究选择大肠杆菌在细胞内感染时间为24 h。
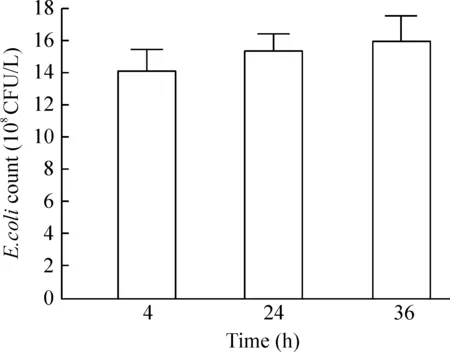
Figure 4.The growth curve of E.coli in SW480 cells.
5转染RIP2后细胞对大肠杆菌的清除作用
pEGFP- C2-RIP2组胞内细菌数量为(1.14×1010±1.1×108)CFU/L,明显低于pEGFP- C2 转染组(1.63×1010±0.44×108)CFU/L和未转染组(1.62×1010±0.33×108)CFU/L(Plt;0.01),提示RIP2转染细胞可以清除胞内大肠杆菌,见图5。
6SB203580对RIP2抗菌作用的影响
pEGFP- C2-RIP2组细菌数量明显低于pEGFP- C2 转染组(Plt;0.01),而加入SB203580后pEGFP- C2-RIP2组细胞内细菌数明显增加,与pEGFP- C2 转染组和未转染组比较无显著差别(Pgt;0.05),提示p38 MAPK 抑制剂SB203580能阻断RIP2清除胞内大肠杆菌的作用,见图6。
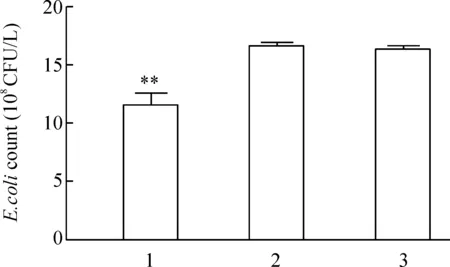
Figure 5.Comparison of the intracellular viable count of E.coli in SW480 cells.1: SW480 cells transfected with pEGFP- C2-RIP2;2: SW480 cells transfected with pEGFP- C2;3: SW480 cells without transfection±s.n=6.**Plt;0.01 vs 2 and 3.
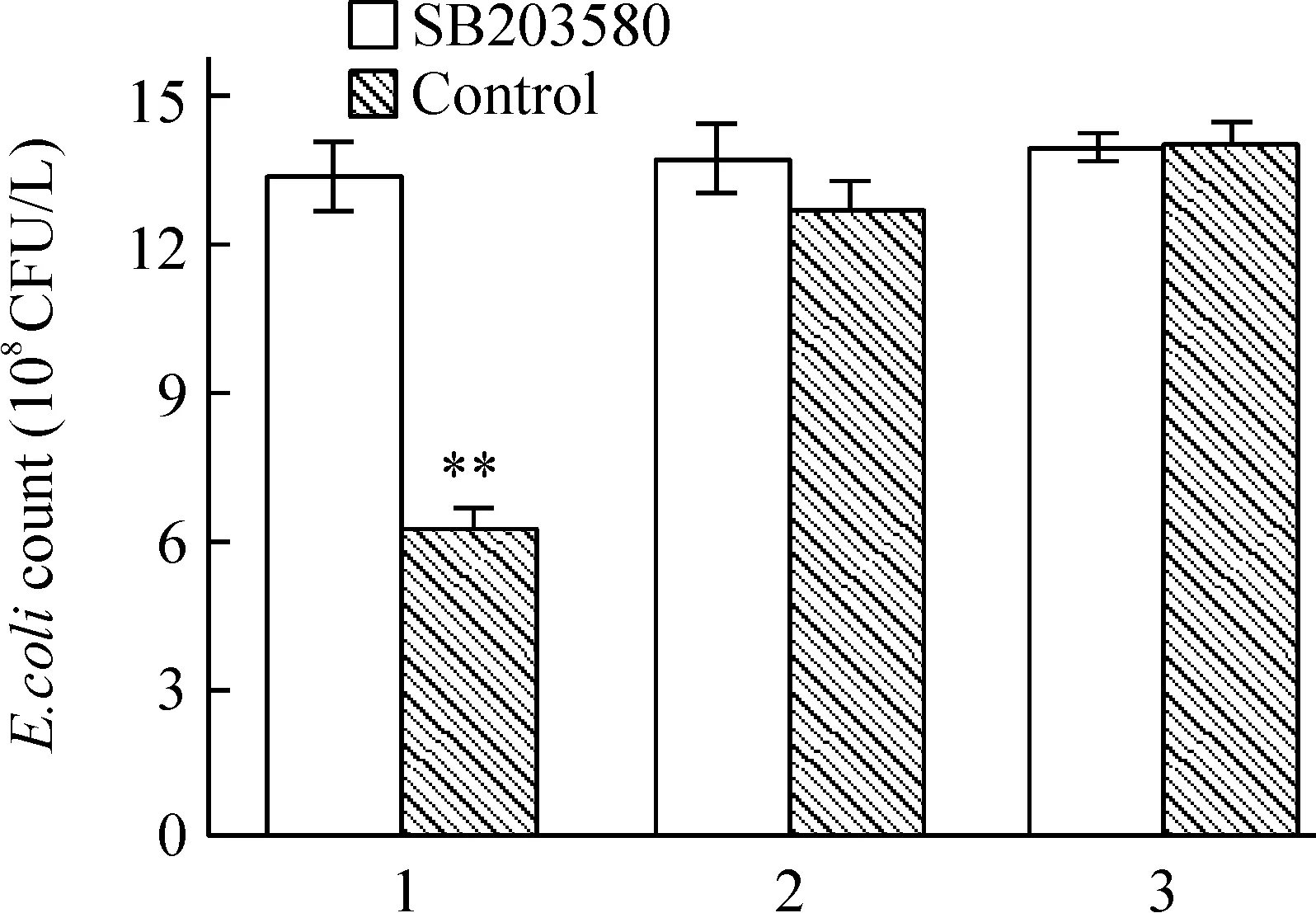
Figure 6.Effect of SB203580 on the intracellular viable count of E.coli in SW480 cells.1: SW480 cells transfected with pEGFP- C2-RIP2;2: SW480 cells transfected with pEGFP- C2;3: SW480 cells without transfection±s.n=6.**Plt;0.01 vs other groups.
讨 论
大肠杆菌是致病性革兰氏阴性肠道菌,其胞壁上的肽聚糖在感染时可被宿主NLRs识别,通过RIP2信号分子激活细胞核内核转录因子NF-κB转录,表达炎性细胞因子,引发宿主的固有免疫应答[4]。在黏膜表面上皮细胞(如结肠上皮细胞),由于细胞不断与菌丛接触,TLRs表达下调,以避免PAMPs对细胞的刺激导致这些组织的异常炎症反应。当这些细胞感染了病原体,PAMPs可转入细胞内,与NOD蛋白相互作用,启动防御反应[5],NOD 的寡聚化诱导了 RIP2 蛋白并导致 NF-κB 的活化,因此,RIP2在抵御病原体入侵过程中发挥了重要作用。RIP2基因位于8q21,编码RIP2蛋白,在脾脏、外周血白细胞、胎盘等组织中呈现高表达。研究发现,RIP2缺陷型巨噬细胞游走延迟,细胞内感染增加,临床病程迁移;相反早期RIP2表达上调往往临床预后较好[6]。
近年来发现,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路参与细胞的生长发育及细胞间功能同步等多种生理过程,它通过磷酸化下游激酶和转录因子而参与各种信号转导[7]。目前在哺乳动物中已发现和成功克隆了细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinases,ERKs)、应激活化蛋白激酶(stress-activated protein kinases,SAPK,又称JNK)和p38 MAPK 3个MAPK亚族。其中p38 MAPK主要参与炎症反应、应激反应,还参与细胞增殖、凋亡和分化[8]。各种细胞外信号包括细菌、活性氧、细胞因子、紫外线照射、高渗状态等均能激活p38 MAPK。p38激活后可趋化和活化白细胞、激活单核-巨噬细胞系统,在人体屏障功能中起重要作用。p38 MAPK特异性抑制剂SB203580(吡啶异哒唑衍生物)竞争性结合p38 MAPK的ATP位点,可阻止p38 MAPK激活下游底物[9],从而阻断p38 MAPK的信号转导通路,并可减少或阻断多种炎症介质。SB203580活性的IC50大约为0.5 μmol/L[10],并存在剂量依赖(0.1-10 μmol/L),最强的抑制作用发生在10 μmol/L时[11]。
肠道感染是临床实践中最常见的细菌感染之一,宿主多种防御机制和抗生素治疗可有效杀灭肠道细菌,本研究发现,将构建的RIP2基因转染至肠道细胞后,RT-PCR和Western blotting检测分别证实了其mRNA转录水平和蛋白表达水平明显增加;在大肠杆菌感染肠道细胞后,随着时间的增长,其胞内菌也随之增长。而将大肠杆菌感染转染RIP2的细胞,发现细胞胞内菌数量明显减少,与未转染组和空质粒转染组相比具有显著差异,说明RIP2对大肠杆菌有明显的抑制作用;而加入p38 MAPK通路抑制剂SB203580,则其清除胞内大肠杆菌的作用被阻断,说明RIP2的抗菌作用可能与p38 MAPK信号通路有关。随着对NLRs信号转导机制的深入研究,RIP2可作为肠道细菌感染治疗的新靶点,将有助于预防和治疗感染性疾病。
[1]Kobayshik K,Inohara N,Hernandez LD,et al.RICK/Rip2/CARDIAK mediates signalling for receptors of the innate and adaptive immune systems[J].Nature,2002,416(6877): 194-199.
[2]Park JH,Kim YG,McDonald C,et al.RICK/RIP2 mediates innate immune responses induced through Nod1 and Nod2 but not TLRs[J].J Immunol,2007,178(4): 2380-2386.
[3]沈 萍,范秀容,李广武.微生物学实验[M].第3版.北京:高等教育出版社,1999.224-230.
[4]Argast GM,Fausto N,Campbell JS.Inhibition of RIP2/RICK/CARDIAK activity by pyridinyl imidazole inhibitors of p38 MAPK[J].Mol Cell Biochem,2005,268(1-2):129-140.
[5]Girardin SE,Tournebize R,Mavris M,et al.CARD4/Nod1 mediates NF-κB and JNK activation by invasiveShigellaflexneri[J].EMBO Rep,2001,2(8): 736-742.
[6]McCully ML,Fairhead T,Colmont CS,et al,Receptor-interacting protein-2 deficiency delays macrophage migration and increases intracellular infection during peritoneal dialysis-associated peritonitis[J].Am J Nephrol,2008,28(6):879-889.
[7]姚 琳,余书勤,张锡然.内毒素诱导p38MAPK信号转导作用的研究进展[J].中国病理生理杂志,2004,20(12):2357-2362.
[8]Owens TW,Valentijn AJ,Upton JP,et al.Apoptosis commitment and activation of mitochondrial Bax during anoikis is regulated by p38MAPK[J].Cell Death Differ,2009,16(11):1551-1562.
[9]Henklova P,Vrzal R,Papouskova B,et al.SB203580,a pharmacological inhibitor of p38 MAP kinase transduction pathway activates ERK and JNK MAP kinases in primary cultures of human hepatocytes[J].Eur J Pharmacol,2008,593(1-3):16-23.
[10]Koranteng RD,Swindle EJ,Davis BJ,et al.Differential regulation of mast cell cytokines by both dexamethasone and the p38 mitogen-activated protein kinase (MAPK) inhibitor SB203580[J].Clin Exp Immunol,2004,137(1):81-87.
[11]Nembrini C,Kisielow J,Shamshiev AT,et al.The kinase activity of Rip2 determines its stability and consequently Nod1- and Nod2-mediated immune responses[J].J Biol Chem,2009,284(29):19183-19188.
ExpressionofRIP2enhancesclearanceofintracellularEscherichiacoliinSW480cells
XI Qiong,HU Chao-feng,ZHANG Yun,LU Da-xiang,JIANG Yu
(DepartmentofPathophysiology,KeyLaboratoryofStateAdministrationofTraditionalChineseMedicine,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:thcf@jnu.edu.cn)
AIM: To investigate the clearance effect and mechanism of high expression of receptor-interacting protein 2 (RIP2) againstEscherichiacoli(E.coli) in intestinal cells.METHODSRIP2 gene (pEGFP-C2-PIP2) was transfected into cell line SW480 by the method of JetPeiTM.Western blotting and RT-PCR analysis were then used to detect RIP2 protein and mRNA expression,respectively.The transfected and non-transfected cells were incubated withE.coliat 37 ℃.At 24 h after initial incubation,the viable intracellular bacteria were quantified by plating appropriate dilution on LB agar plates.The transfected and non-transfected cells were treated with SB203580,an inhibitor of p38 MAPK pathway,and the changes of intracellular bacteria were also quantified.RESULTSCompared with the cells transfected with pEGFP-C2 and non-transfected cells,the expression of RIP2 at mRNA and protein levels was significantly enhanced in SW480 cells transfected with recombinant plasmid pEGFP-C2-PIP2 (Plt;0.01 andPlt;0.05,respectively).The cells transfected with pEGFP-C2-PIP2 had the ability to clear invadingE.coli,and this antibacterial effect was inhibited by a p38 MAPK inhibitor SB203580.CONCLUSIONRIP2 effectively eliminates the invadingE.coli,and p38 MAPK pathway plays an important role in the clearance effect of RIP2,indicating that RIP2 may be a potential molecular therapeutic target for infectious disease.
Receptor-interacting protein 2; Gene transfection; Antibacterial effect
1000-4718(2011)05-0951-05
R392.11
A
10.3969/j.issn.1000-4718.2011.05.022
2011-01-06
2011-03-04
广东省自然科学基金资助项目(No.06025159);广东省教育厅自然科学研究项目[No.粤财教(2005)126];暨南大学“211工程”三期预研项目;暨南大学重点实验室基金资助项目
△通讯作者 Tel: 020-85228079;E -mail:thcf@jnu.edu.cn
