CD133和CD44在结直肠癌细胞中的表达及其与患者5年生存率的相关性分析*
2011-11-20陈仕才宋新明陈志辉李明哲何裕隆詹文华
陈仕才, 宋新明, 陈志辉, 李明哲, 何裕隆, 詹文华
(中山大学附属第一医院胃肠胰外科,广东 广州 510080)
CD133和CD44在结直肠癌细胞中的表达及其与患者5年生存率的相关性分析*
陈仕才, 宋新明△, 陈志辉, 李明哲, 何裕隆, 詹文华
(中山大学附属第一医院胃肠胰外科,广东 广州 510080)
目的: 探讨不同CD133/CD44细胞亚群的成瘤能力及CD133、CD44的表达水平对根治性结直肠癌患者术后生存率的影响,明确CD133和CD44作为结直肠癌肿瘤干细胞表面标志物的意义。方法利用流式细胞术分选出SW480细胞系中CD133和CD44标记的不同细胞亚群,比较其在裸鼠皮下成瘤情况;并利用免疫组化的方法观察CD133和CD44在90例结直肠癌患者石蜡切片标本的表达情况,对CD133、CD44与患者临床病理资料及生存率进行分析。结果CD133+CD44+细胞群成瘤能力明显优于其它各组。CD133和CD44均在细胞膜上表达,两者均与患者性别、年龄 、肿瘤位置、肿瘤大小、浸润深度、淋巴结转移、肝转移、肿瘤分化程度及UICC分期无关(Pgt;0.05)。Kaplan-Meier生存分析法显示,CD133高表达组5年生存率为45.2%,CD133低表达组5年生存率为83.8%,两者有明显差异(Plt;0.01);而CD44高表达组5年生存率(75.6%)与低表达组(70.1%)无明显差异(Pgt;0.05);其中CD133/CD44同时高表达者5年生存率明显较差(Plt;0.01)。Cox风险回归模型分析结果表明,CD133、肝转移、分化程度及淋巴结转移是影响结直肠癌患者预后的几个独立危险因素(Plt;0.05)。结论CD133可作为结直肠癌肿瘤干细胞的良好标志物。CD133是影响结直肠癌患者预后的独立危险因素,其表达水平越高,预后越差;尽管CD44与结直肠癌患者预后无明显相关性,但联合检测CD133/CD44却能更好地判断患者的预后情况。
CD133; CD44; 结直肠肿瘤; 预后
结直肠癌(colorectal cancer,CRC)是最常见的恶性肿瘤之一。近年来,尽管通过外科手术、放化疗等手段使其治疗效果有了显著提高,但其所致的死亡率仍高居癌症死因第二位[1],复发与转移是影响结直肠癌患者预后的根本原因。
肿瘤干细胞(cancer stem cells)是目前肿瘤研究中的热点问题。该学说认为肿瘤组织中存在极少量肿瘤细胞,在肿瘤发展中充当干细胞的角色,具有自我更新和无限分化、增殖潜能,在启动肿瘤形成和生长中起着关键性的作用,决定了肿瘤的形成、复发和转移;而其余的大多数肿瘤细胞经过短暂的分化后最终死亡。自1997年Bonnet等[2]分离出人急性粒细胞白血病干细胞以来,至今已有多种实体肿瘤如乳腺癌、胶质瘤等分离纯化出肿瘤干细胞[3,4]。目前用来分离肿瘤干细胞的方法主要是利用肿瘤细胞不同表面抗原标记,将特殊标记的单抗结合到细胞上,经流式细胞仪或免疫磁珠将肿瘤细胞分选为不同的亚群,再检测各亚群细胞的体外克隆传代及体内成瘤能力,从而筛选出肿瘤干细胞的表面标记。CD133和CD44是目前研究较多的2种结直肠癌肿瘤干细胞标志物[5-9]。CD133抗原的相对分子量为120 kD,有5个跨膜片段的糖蛋白,包括细胞膜外的氨基末端、2个短的细胞内环、2个长的细胞外环以及细胞内的羧基端,并且CD133集中在膜突出部。CD44是一种跨膜糖蛋白,参与许多细胞功能,包括生长、生存、分化及死亡等;在细胞的黏附、移动及转移过程中起着重要的作用。
肿瘤干细胞与结直肠癌的起源、发展密切相关,然而CD133、CD44可否作为结直肠癌肿瘤干细胞的标志物目前尚存在较大的争议[10,11];且两者与结直肠癌患者预后的关系尚未明确。有报道提示CD133是影响结直肠癌患者预后的一个重要因素[12-15],表达水平越高,预后越差;然而另有报道指出CD133表达与生存率无关[16,17]。而关于CD44与结直肠癌患者预后的关系更鲜有报道。本文拟通过裸鼠体内成瘤实验比较SW480细胞系中不同CD133/CD44细胞亚群的成瘤能力,并利用免疫组化的方法观察两者在肿瘤组织中的原位表达情况与结直肠癌患者临床病理特点及预后的关系,为结直肠癌患者的治疗找到更好的靶点。
材 料 和 方 法
1裸鼠成瘤实验
1.1材料 SW480细胞系及5-6周雄性裸鼠由中山大学实验动物中心提供。Anti-CD133-PE和anti-CD44-PECY5抗体均购自BD公司,DMEM/F12培养基、0.25%胰酶、0.02%EDTA和青、链霉素混合液购自南京凯基生物公司;特级新生小牛血清购自杭州四季青公司。使用的流式细胞仪为Beckman Coulter产品,另配备超净工作台、CO2恒温细胞培养箱(Thermo)、高速离心机和倒置显微镜(Olympus)等。
1.2方法 将SW480细胞系接种于含10%小牛血清的DMEM/F12培养基中,置于5%CO2、37 ℃恒温培养箱内培养。取对数生长期的细胞,PBS清洗后用含0.25%胰蛋白酶和0.02%EDTA的消化液消化,小心吹打制成单细胞悬液,台盼蓝染色并计数,按1×1010cells/L重悬于PBS缓冲液中,取2支无菌试管,每管分别加入2 mL细胞悬液,即每管2×107个细胞,然后每管加入anti-CD133-PE和anti-CD44-PECY5抗体各20 μL,立即用流式细胞仪进行检测、分选。将分选出来不同数量级的各亚群细胞分别接种于雄性裸鼠前腋皮下,由中山大学实验动物中心负责饲养动物,每周观察各组肿瘤形成过程,测量其长轴(a)、短轴(b),并根据公式V=ab2/2计算肿瘤体积,8周后处死动物,行HE染色检查。
2结直肠癌患者标本免疫组化实验
2.1入选病人资料 选取曾于我院行根治性切除术的结直肠癌患者标本90例,组织类型均为腺癌,并取其中10 例癌旁正常组织(距离癌组织10 cm以上)作对照。所有入选病人确诊时均无多源性肿瘤、家族性腺瘤性息肉病或炎症性肠病病史;手术前后均未行放化疗;有远处转移者均为肝转移,且可行根治性切除。为减少手术因素的影响,术后3个月内死亡者未纳入该研究,排除年龄大于80岁患者。所有入选患者随访不少于5年,只有确定为术后因结直肠癌死亡者视为随访结束,中位随访时间为54.5个月。肿瘤分化程度依照WHO分类标准;结直肠癌分期参照国际抗癌联盟(International Union against Cancer,UICC)分期。肿瘤侵润深度分期,T1:肿瘤侵及黏膜下层;T2:肿瘤侵及肠壁肌层;T3:肿瘤侵润达浆膜或浆膜外;T4:肿瘤侵犯周围脏器。淋巴结转移分期,N0:无淋巴结转移;N1:有1-3个淋巴结转移,N2:有4个或以上淋巴结转移。
2.2免疫组化方法 将10%甲醛固定、石蜡包埋的肿瘤样本切片,每个样本各2张。白片先置于60 ℃烤箱,烤片过夜。石蜡切片脱蜡和梯度水化后,用PBS(pH7.4)冲洗3次,每次3 min。在柠檬酸抗原修复液中对抗原进行修复,修复条件为微波修复CD133约10 min;高压修复CD44约3 min。自然冷却、PBS冲洗后每张切片滴加3%过氧化氢溶液50 μL,室温下孵育10 min。PBS冲洗后每个样本的2张切片分别滴加50 μL CD133Ⅰ抗(anti-CD133 rabbit polyclonal antibody,1∶200,ab19898; Abcam)及CD44Ⅰ抗(anti-CD44 rabbit monoclonal antibody,1∶100,ab51037; Abcam),4 ℃过夜。PBS冲洗后每张切片滴加50 μLⅡ抗(即用型快捷免疫组化Maxvision试剂盒,KIT-5010,MAIXIN_Bio),室温下孵育10-15 min。PBS冲洗3次,每次3 min,除去PBS液,每张切片滴加100 μL新鲜配制的DAB液,显色3-5 min后自来水冲洗,苏木素复染8 s,再用自来水反复冲洗。切片经过梯度乙醇脱水干燥,二甲苯透明,中性树胶封片,置显微镜下观察。
3统计学处理
结 果
1CD133+CD44+细胞致裸鼠成瘤结果
SW480细胞系中CD133+CD44+、CD133+CD44-、CD133-CD44+及CD133-CD44-细胞亚群的比例分别为:0.82%、0.05%、96.79%和2.34%,见图1。各瘤体行HE染色检查均可见肿瘤细胞成团排列,细胞异型性大,有病理性核分裂,并可见坏死,证实为结肠癌组织,见图2、3。由表1可看出,103个CD133+CD44+细胞即可见肿瘤形成(1/4),104个CD133+CD44+细胞的成瘤率为100%(8/8);104个CD133+CD44-细胞的成瘤率为62.5%(5/8);未分选细胞需105个以上才能成瘤;而105个CD133-CD44+及106个CD133-CD44-细胞均未成瘤。对各亚群细胞的成瘤能力进行比较发现,主要致瘤细胞为CD133+细胞,且CD133+CD44+细胞亚群的致瘤能力明显强于其它各组细胞,自第4周始,体积差异有统计学意义(Plt;0.05),见图4。
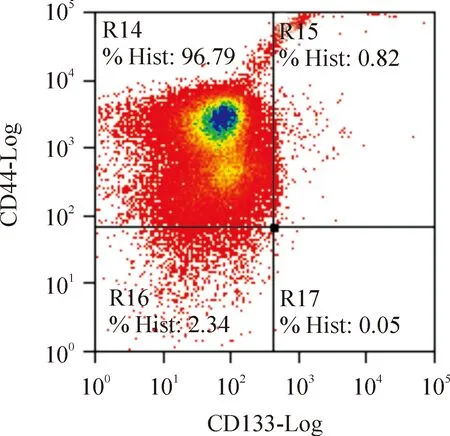
Figure 1.CD133/CD44 subpopulations from SW480 cell line.
Figure 2.Transplanted tumor in nude mice.
Figure 3.HE staining of mouse xenograft(×100).
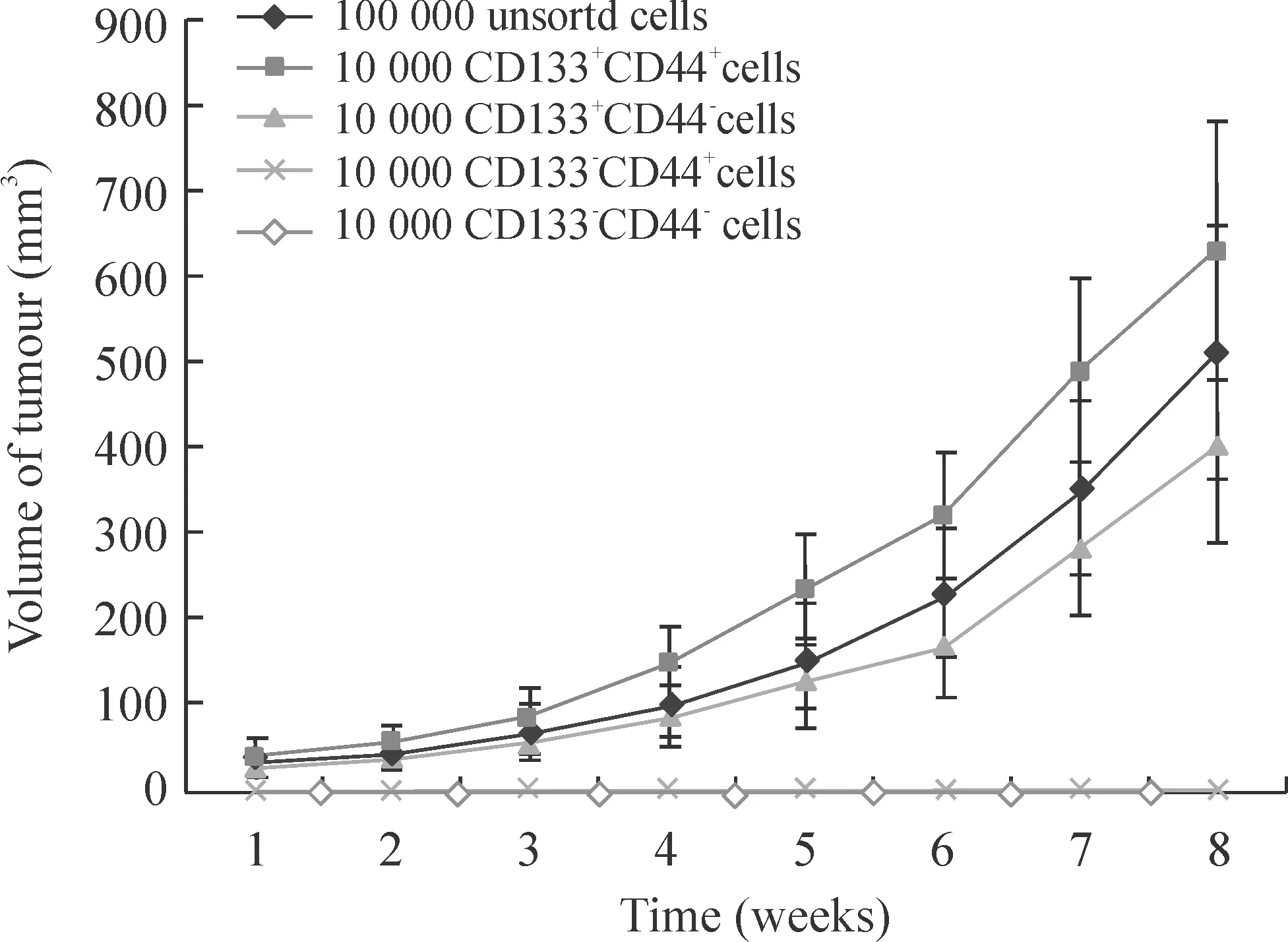
Figure 4.Tumorigenicity of five different cell subpopulations: unsorted cells(n=6),CD133+CD44+(n=8),CD133+CD44-(n=5),CD133-CD44+(n=8 ) and CD133-CD44-(n=8).*Plt;0.05,**Plt;0.01 vs unsorted cells CD133+CD44+ cells and CD133+CD44- cells.
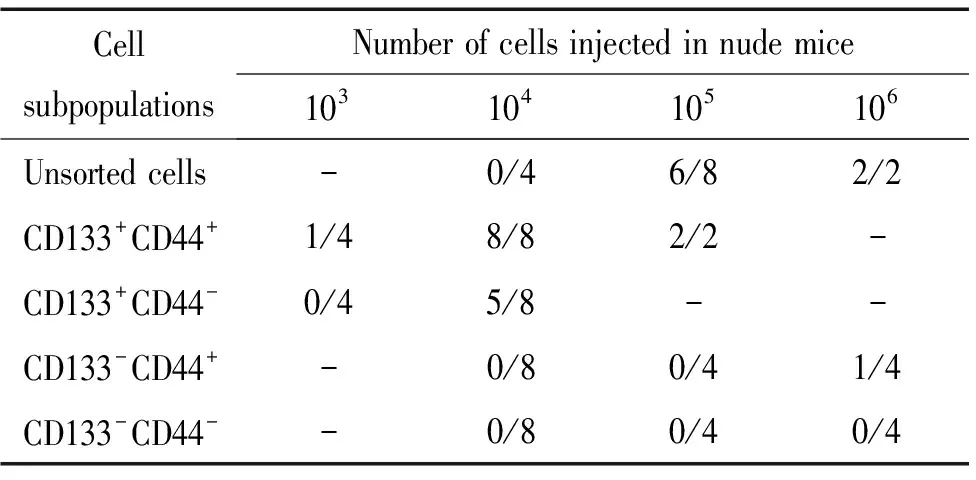
表1 SW480细胞系中不同数量细胞亚群成瘤情况
2免疫组化结果
2.1临床特点 入选患者的临床病理资料见表2。其中男54例,女36例,年龄24-80岁,平均(61.8±13.5)岁。结肠癌51例,直肠癌39例;肿瘤lt;5 cm共30例,≥5 cm共60例。肿瘤浸润深度T1、T2、T3、T4分别为12、 14、63、1例;淋巴结转移分别为N0 61例、N1 17例、N2 12例;有肝转移者4人。高、中、低分化者为30、31和29例;UICC分期为Ⅰ期19人、Ⅱ期40人、Ⅲ期27人及Ⅳ期4人。
2.2CD133、CD44的表达情况与临床病理特征 显微镜下,可见CD133表达方式主要位于结直肠癌腺体靠管腔一侧的细胞膜上,而在胞浆基本不表达,部分腺体管腔内还可见脱落的CD133+细胞碎片,见图5。将肿瘤组织中CD133+腺体数比例低于50%者定义为CD133低表达组;CD133+腺体比例大于50%为CD133高表达组[12]。据此,CD133低表达组共65例(72.2%),高表达组25例(27.8%)。CD44只在细胞膜上表达,见图6。将CD44+细胞数比例低于50% 为CD44低表达组;CD44+细胞比例大于50%为CD44高表达组[15],则CD44低表达组40例(44.4%),高表达组为50例(55.6%)。经2检验,CD133和CD44均与患者性别、年龄、肿瘤位置、肿瘤大小、浸润深度、淋巴结转移、肝转移、肿瘤分化程度及UICC分期无关。
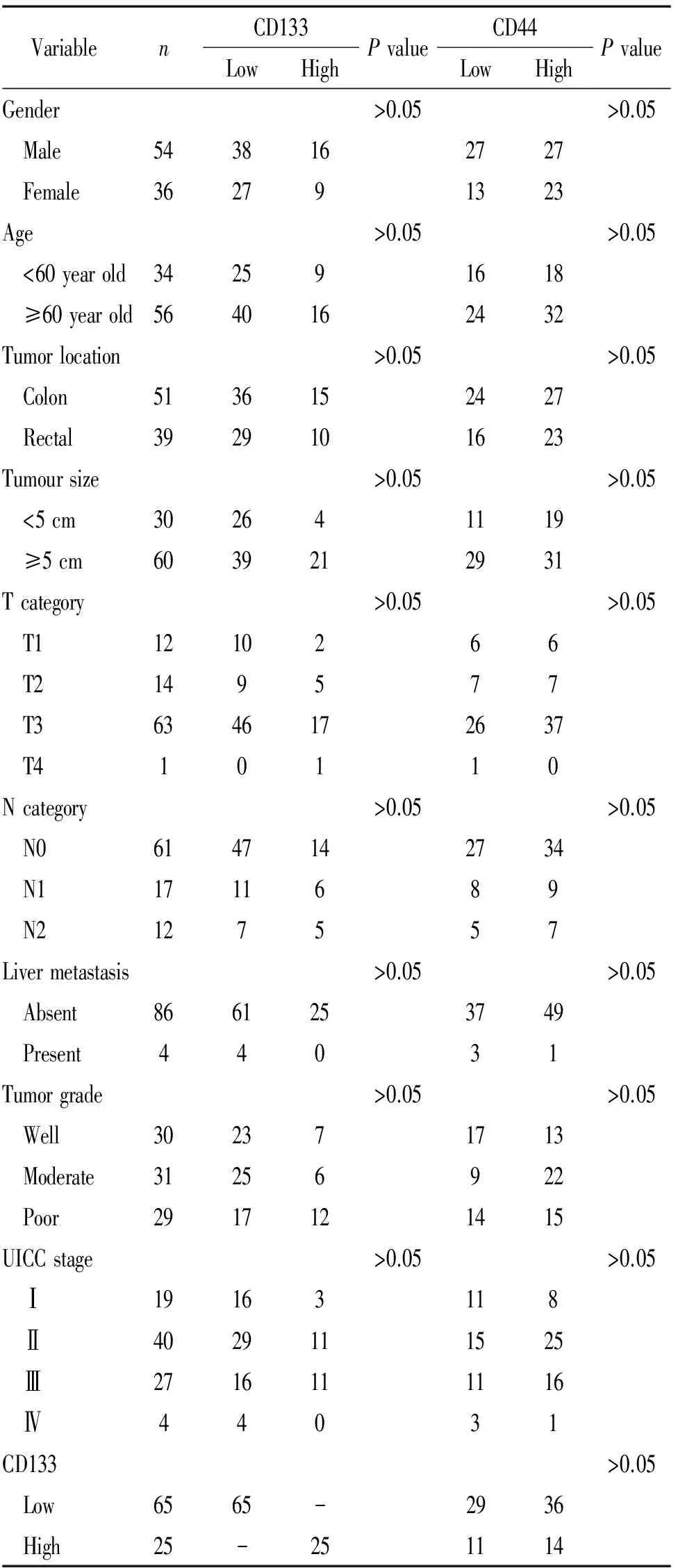
表2 CD133、CD44的表达情况与结直肠癌患者临床病理资料的关系

Figure 5.Expression of CD133 in colorectal cancer glands and normal colorectal glands.A: CD133 was located on the luminal surface of colorectal cancer glands and intraglandular fragments of CD133+ cells were observed.B: no CD133 expression had been found in normal colorectal glands.
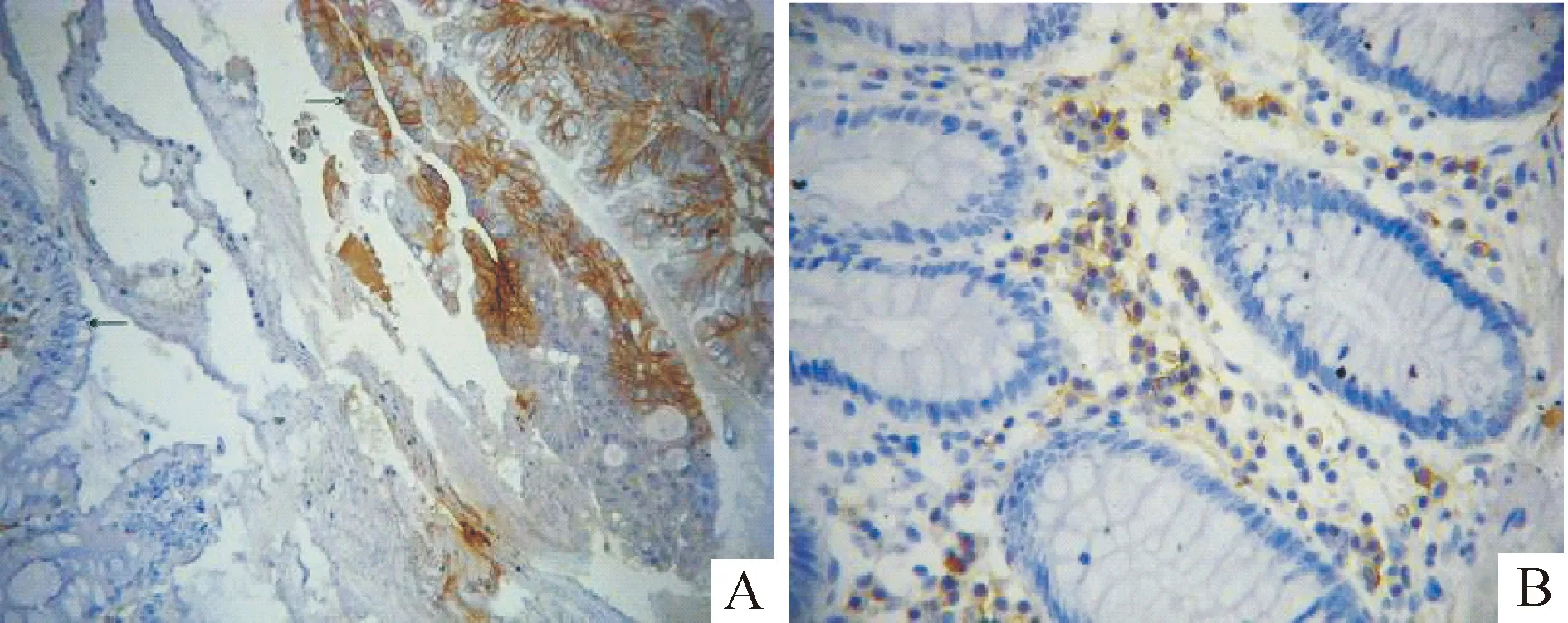
Figure 6.Expression of CD44 in colorectal cancer glands and normal colorectal glands.A: CD44 was immunostained along the membrane.B: no CD44 expression had been found in normal colorectal glands and only CD44+ lymphoid tissues among the glands were observed.
2.3CD133、CD44的表达水平与结直肠癌患者术后5年生存率的关系 利用Kaplan-Meier生存分析法对CD133、CD44的表达水平与结直肠癌患者预后关系进行比较。CD133低表达组5年生存率为83.8%,CD133高表达组5年生存率为45.2%,两组有明显差异(Plt;0.01),见图7A。 CD44低表达组5年生存率为75.6%,CD44高表达组5年生存率为70.1%,两组差异无统计学意义(Pgt;0.05),见图7B。且经单因素生存分析表明,影响患者术后总体生存率的因素有淋巴结转移、肝转移、分化程度、UICC分期及CD133,而性别、年龄、肿瘤位置、肿瘤大小、浸润深度及CD44水平与总体生存率无关,见表3。Cox比例风险回归模型提示,CD133、肝转移、分化程度及淋巴结转移是影响结直肠癌患者预后的几个重要因素(Plt;0.05),见表3。CD133的相对危险度(RR)为0.151(95%CI0.057-0.402),Plt;0.01,说明CD133的表达与患者的预后为负相关,即CD133的表达水平越高,患者的预后越差。
在本研究中,90例结直肠癌患者中,CD133-low/CD44-low 29例,CD133-low/CD44-high 36例,CD133-high/CD44-low 11例,CD133-high/CD44-high 14例。这4组病人的5年生存率分别为78.3%、86.8%、68.2%和26.8%,其中CD133-high/CD44-high组5年生存率明显差于其它3组(Plt;0.01),见图7C。
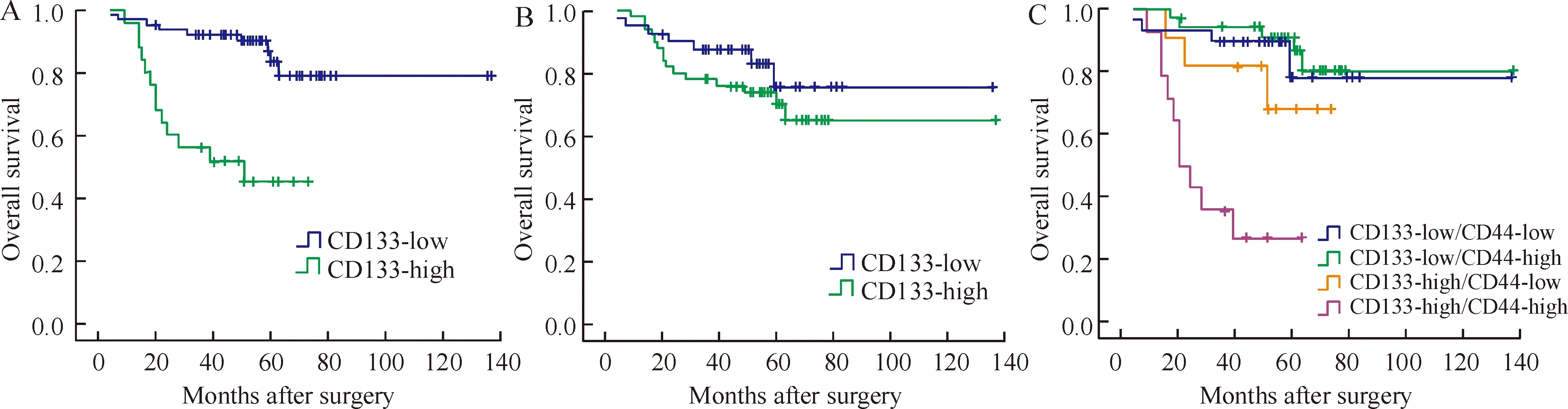
Figure 7.Analysis of CD133 and CD44 expression in colorectal cancer and patient survival.A: CD133-high group(n=25) showed worse survival than that in CD133-low group(n=65)by log-rank test (Plt;0.01).B: no correlation was found between patient survival and CD44 expression(Pgt;0.05.CD44-low: n=40,CD44-high: n=50).C: CD133-high/CD44-high expression group had the worst prognosis(Plt;0.01.CD133-low/CD44-low: n=29; CD133-low/CD44-high: n=36; CD133-high/CD44-low: n=11; CD133-high/CD44-high: n=14).

表3 90例结直肠癌患者总体生存率的Kaplan-Meier单因素及Cox多因素分析
讨 论
肿瘤干细胞最早报道存在于急性粒细胞性白血病中,Bonnet等[2]成功地提取、纯化了具有CD34+CD38-表型的AML细胞,这些细胞只占AML细胞总数的0.2%,却能在NOD/SCID小鼠体内成瘤;而占AML细胞大部分的CD34+CD38+细胞无法形成肿瘤。在实体肿瘤方面,有学者先后在乳腺癌及脑肿瘤中成功地分离出肿瘤干细胞[3,18,19]。
在结直肠癌肿瘤干细胞的研究方面,2007年O’Brien等[5]及Ricci-Vitiani等[6]首先报道了结直肠癌肿瘤起源细胞均存在于CD133+细胞群中。CD133+细胞群除了能在体外含有生长因子的无血清培养基中以未分化肿瘤细胞球的形式快速增长,还能在免疫缺陷小鼠体内连续成瘤。据估计,在5.7×104个未分类肿瘤细胞中只有1个细胞具有致瘤性,而在262个CD133+细胞中就有1个致瘤性细胞,这几乎富集了200倍;而占瘤体大部分的CD133-细胞却无成瘤能力。然而有学者对此亦提出了异议。Shmelkov等[10]指出,CD133不一定局限表达于干细胞表面,在结肠癌肝转移瘤中CD133+及CD133-细胞均可致瘤。另有报道CD44亦可作为结直肠癌肿瘤干细胞的良好标志物[7,8];而且联合CD133、CD44 2种标志物能更好地分选、纯化出结直肠癌的肿瘤干细胞[9]。本研究显示在SW480细胞系中,CD133+细胞具备较强的成瘤能力,而占大部分比例的CD44+细胞无明显致瘤性。
尽管结直肠癌肿瘤干细胞是肿瘤形成、复发和转移的决定因素,且对放化疗治疗均不敏感[20],但其表面标志物CD133、CD44的表达情况与其预后的关系目前尚无定论。研究发现,CD133抗原是影响结直肠癌患者预后的一个重要独立因素,CD133高表达者其生存率明显低于CD133低表达者[13,14];然而,也有学者对此提出不同的观点,认为CD133的表达水平对患者的生存率并无影响[1,16]。另一方面,Horst等[15]及Choi等[17]认为CD44与结直肠癌患者的预后无明显相关性;更有意思的是,Lugli等[16]通过对1 261例结直肠癌患者研究发现,尽管不排除T分期、淋巴结分级、远处转移等因素的干扰,CD44低表达者的5年生存率为53.4%,而高表达者的5年生存率为59.3%,两组生存率有明显差异,这说明与CD133相反,CD44表达水平越低,预后越差。本文通过免疫组化的方法证实结直肠癌肿瘤细胞膜上的确有CD133和CD44的原位表达,而细胞浆内基本无表达。研究结果表明CD133的表达水平与患者预后显著相关(Plt;0.01),高表达组5生存率(45.2%)明显差于低表达组5年生存率(83.8%);而CD44低表达组5年生存率为75.6%,CD44高表达组5年生存率为70.1%,两组患者的预后无明显相关性。CD133/CD44均高表达者5年生存率明显差于其它3组患者(Plt;0.01)。
CD133、CD44的表达情况与结直肠癌患者预后的关系可能受样本量的限制、免疫组化取材方式的不同(组织芯片或石蜡切片)、定义阳性标本的标准不一等因素影响[16]。如Horst等[12,15]将肿瘤组织中CD133阳性腺体数大于50%定义为CD133高表达组,小于50%定义为CD133低表达组;而有学者将CD133+细胞占总细胞数10%以上定义为CD133+标本[13,15];更有学者将5%的CD133+细胞数作为界限[16]。上述定义标准的不同必然会带来统计结果的差异。
关于CD133、CD44与结直肠癌患者临床病理资料的关系特点目前亦尚未明确。有研究显示,CD133的表达情况与肿瘤的分化程度呈负相关, CD133表达水平越高,分化程度越低[6,21],这似乎也合理地解释了为何CD133高水平表达者意味着预后不佳。而本文研究结果提示CD133、CD44与患者性别、年龄、肿瘤位置、肿瘤大小、浸润深度、淋巴结转移、肝转移、肿瘤分化程度及UICC分期均无关。其中,CD133的表达水平与肿瘤的分化程度并无相关性,这与既往的文献报道相符合[15]。
综上所述,CD133可作为结直肠癌肿瘤干细胞的标志物,其表达水平越高,生存率越差;虽然CD44与结直肠癌患者预后无关,但联合检测CD133/CD44却有助于更好地判断患者的预后情况。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2006[J].CA Cancer J Clin,2006,56(2): 106-130.
[2]Bonnet D,Diek JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med,1997,3(7):730一737.
[3]郭运杰,崔秀英,姚和瑞.乳腺癌细胞株MCF-7/ADM中肿瘤干细胞的研究[J].中国病理生理杂志,2008,24(12):2374-2377.
[4]李 平,钟雪云.肿瘤干细胞与胶质瘤细胞起源[J].中国病理生理杂志,2009,25(8):1652-1655.
[5]O’Brien CA,Pollett A,Gallinger S,et al.A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J].Nature,2007,445(7123):106-110.
[6]Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells[J].Nature,2007,445(7123):111-115.
[7]Dalerba P,Dylla SJ,Park IK,et al.Phenotypic characterization of human colorectal cancer stem cells[J].Proc Natl Acad Sci USA,2007,104(24):10158-10163.
[8]Du L,Wang H,He L,et al.CD44 is of functional importance for colorectal cancer stem cells[J].Clin Cancer Res,2008,14(21):6751-6760.
[9]Haraguchi N,Ohkuma M,Sakashita H,et al.CD133+CD44+population efficiently enriches colon cancer initiating cells[J].Ann Surg Oncol,2008,15(10):2927-2933.
[10]Shmelkov SV,Butler JM,Hooper AT,et al.CD133 expression is not restricted to stem cells,and both CD133+and CD133-metastatic colon cancer cells initiate tumors[J].J Clin Invest,2008,118(6):2111-2120.
[11]Dittfeld C,Dietrich A,Peickert S,et al.CD133 expression is not selective for tumor-initiating or radioresistant cell populations in the CRC cell line HCT-116[J].Radiother Oncol,2010,94(3): 375-383.
[12]Horst D,Kriegl L,Engel J,et al.CD133 expression is an independent prognostic marker for low survival in colorectal cancer[J].Br J Cancer,2008,99(8):1285-1289.
[13]Kojima M,Ishii G,Atsumi N,et al.Immunohistochemical detection of CD133 expression in colorectal cancer: a clinicopathological study[J].Cancer Sci,2008,99(8):1578-1583.
[14]Wang Q,Chen ZG,Du CZ,et al.Cancer stem cell marker CD133+tumour cells and clinical outcome in rectal cancer[J].Histopathology,2009,55(3):284-293.
[15]Horst D,Kriegl L,Engel J,et al.Prognostic significance of the cancer stem cell markers CD133,CD44,and CD166 in colorectal cancer[J].Cancer Invest,2009,27(8): 844-850.
[16]Lugli A,Iezzi G,Hostettler I,et al.Prognostic impact of the expression of putative cancer stem cell markers CD133,CD166,CD44s,EpCAM,and ALDH1 in colorectal cancer[J].Br J Cancer,2010,103(3): 382-390.
[17]Choi D,Lee HW,Hur KY,et al.Cancer stem cell markers CD133 and CD24 correlate with invasiveness and differentiation in colorectal adenocarcinoma[J].World J Gastroenterol,2009,15(18): 2258-2264.
[18]Al-Hajj M,Wicha MS,Benito-Hemandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
[19]Singh SK,Clarke ID,Terasaki M,et al.Identification of a cancer stem cell in human brain tumors[J].Cancer Res,2003,63(18):5821-5828.
[20]Saigusa S,Tanaka K,Toiyama Y,et al.Immunohistochemical features of CD133 expression: association with resistance to chemoradiotherapy in rectal cancer[J].Oncol Rep,2010,24(2):345-350.
[21]Feng HL,Liu YQ,Yang LJ,et al.Expression of CD133 correlates with differentiation of human colon cancer cells[J].Cancer Biol Ther,2010,9(3):216-223.
CorrelationanalysisofCD133/CD44expressionincolorectalcancertissuesand5-yearsurvivalrateincolorectalcancerpatients
CHEN Shi-cai,SONG Xin-ming,CHEN Zhi-hui,LI Ming-zhe,HE Yu-long,ZHAN Wen-hua
(DepartmentofGastrointestinalandPancreaticSurgery,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:songxm888@163.com)
AIM: To compare the tumorigenicity of different CD133/CD44 subpopulations in colorectal cancer cell line and to evaluate relationship between the expression of CD133/CD44 in colorectal cancer tissues and the prognosis of colorectal cancer patients.METHODSThe cells of CD133/CD44 subpopulations from SW480 cell line were sorted by flow cytometry and vaccinated into nude mice.The expression of CD133 and CD44 in 90 colorectal cancer specimens from the patients with radical resection was analyzed by immunohistochemistry.The clinicopathological factors and survival rate of the selected patients were evaluated.RESULTSThe tumorigenicity of CD133+/CD44+cells was stronger than that of other cells.Both CD133 and CD44 were expressed on the cell membrane and CD133 was mainly located at the glandular luminal surface of colorectal cancer cells.No correlation were found between CD133/CD44 and the clinicopathological parameters including gender,age,tumor location,tumor size,T category,N category,liver metastasis,tumor grade and UICC stage (Pgt;0.05).However,the patients with CD133-high tumors were associated with a significantly worse 5-year survival rate than those with CD133-low tumors (45.2%vs83.8%,Plt;0.01) using Kaplan-Meier analysis.No difference was observed in survival rate when CD44 was taken into account (75.6%vs70.1%,Pgt;0.05).The CD133-high/CD44-high group had the worst 5-year survival rate than others (Plt;0.01).Multivariate Cox analysis demonstrated that CD133 as well as liver metastasis,tumor grade and lymph node metastasis was closely associated with the prognosis of the patients (Plt;0.05).CONCLUSIONCD133 can be considered as a robust marker for cancer stem cells in colorectal cancer.Rather than CD44,CD133 is strongly associated with a poorer prognosis in patients with colorectal cancer.Evaluation of CD133 combined with CD44 may help to judge the outcome of colorectal cancer.
CD133; CD44; Colorectal neoplasms; Prognosis
1000-4718(2011)05-0883-07
R735.3
A
10.3969/j.issn.1000-4718.2011.05.010
2011-03-23
2011-05-03
广东省自然科学基金资助项目(No.8151008901000207)
△通讯作者 Tel:020-87755766;E-mail:songxm888@163.com
