硼替佐米对多发性骨髓瘤细胞乙酰肝素酶表达及迁移能力的影响*
2011-11-20谷景立刘俊茹黄蓓晖
郑 冬, 袁 梅, 李 娟, 谷景立, 卢 博, 刘俊茹, 黄蓓晖
(中山大学附属第一医院血液内科,广东 广州 510080)
硼替佐米对多发性骨髓瘤细胞乙酰肝素酶表达及迁移能力的影响*
郑 冬△, 袁 梅, 李 娟, 谷景立, 卢 博, 刘俊茹, 黄蓓晖
(中山大学附属第一医院血液内科,广东 广州 510080)
目的: 研究硼替佐米对多发性骨髓瘤细胞株U266的乙酰肝素酶(HPA)表达及迁移能力的影响,并探讨其作用机制。方法体外培养U266细胞,以不同浓度的硼替佐米进行处理,采用CCK-8检测细胞活力,用RT-PCR方法检测HPA mRNA水平的变化,用Western blotting方法检测HPA蛋白及IκB表达水平的变化,以Transwell方法检测细胞迁移能力的变化。结果U266细胞表达HPA,以0、3.125、12.5及50 nmol/L浓度的硼替佐米处理U266细胞48 h,HPA mRNA及蛋白的表达逐渐减少(Plt;0.01),而细胞迁移能力逐渐减弱(Plt;0.01)。同时,HPA的蛋白表达水平与IκB的表达水平呈负相关(Plt;0.01)。结论硼替佐米通过抑制HPA的表达抑制骨髓瘤细胞的迁移能力,其机制可能是通过NF-κB信号途径进行调控的。
硼替佐米; 多发性骨髓瘤; 乙酰肝素酶; 细胞迁移
多发性骨髓瘤(multiple myeloma,MM)是一种恶性浆细胞增殖性疾病,在血液肿瘤性疾病中占10%。新药硼替佐米近年来在MM的治疗取得了重大突破,使骨髓瘤患者的疗效有了明显改善[1]。已知晓乙酰肝素酶(heparanase,HPA)是一种与肿瘤细胞生长及转移密切相关的葡萄糖醛酸酯酶[2],研究发现,HPA在MM的患者中呈现高表达,且表达水平与患者预后密切相关[3-5]。硼替佐米是否同样能影响骨髓瘤细胞HPA的表达,进而减弱其迁移能力,从而抑制骨髓瘤细胞的生长和转移,尚有待进一步研究。本研究探讨了硼替佐米对骨髓瘤细胞株U266的HPA表达及迁移能力的影响,期望发现硼替佐米作用于骨髓瘤细胞的新途径。
材 料 和 方 法
1细胞和试剂
人MM细胞系U266由第二军医大学长征医院血液科侯健教授惠赠,Cell Counting Kit-8(CCK-8)试剂盒购自日本株式会社同仁化学研究所,Trizol 试剂购自Invitrogen公司,反转录试剂盒和Taq 酶购自Toyobo公司,PCR 引物由TaKaRa公司合成,HPA兔抗人多克隆抗体及IκB兔抗人多克隆抗体购自Santa Cruz,GAPDH兔抗人单克隆抗体及羊抗IgG/HRPⅡ抗购自博奥申公司,Transwell板(8 μm孔径)购于Corning。
2细胞培养
用含10%的胎牛血清、1×105U/L青霉素、100 mg/L链霉素的RPMI-1640培养基,在37 ℃、5%CO2的饱和湿度培养箱中培养,选用对数生长期细胞进行实验。
3药物干预
硼替佐米粉剂溶解于生理盐水中,将其浓度配置为100 μmol/L(母液),使用RPMI-1640培养基将其稀释成终浓度为:3.125、6.25、12.5、25、50 nmol/L,未加入硼替佐米药物的即为对照组,每个实验浓度组各设3个复孔。每次实验重复3次。
4CCK-8检测细胞活力
将收集的细胞稀释为6×107cells/L,分别接种50 μL于96孔板中,3×104cells/well,每孔分别加入配置好的不同浓度的硼替佐米(0、3.125、6.25、12.5、25、50 nmol/L) 50 μL,将孔板置于5%CO2、37℃、饱和湿度培养箱中作用不同时间(12、24、36、48、60 h)。将处理好的细胞,每孔加入10 μL CCK-8溶液,再置于培养箱中孵育4 h,最后用酶标仪测定在450 nm处的吸光度值。
5RT-PCR检测HPAmRNA
细胞检测前的药物干预方法同上,只是将培养板改换为6孔板,接种5×106个细胞。HPA上游引物: 5′-GAATGGCCCTACCAGGAGCA -3′,下游引物5′-AACGCATTTAGGCCAAAGATCAAG-3′,扩增产物为145 bp;GAPDH上游引物5′-GCACCGTCAAGGCTGAGAAC -3′,下游引物5′- TGGTGAAGACGCCAGTGGA -3′,扩增产物为138 bp。
总RNA的提取按RNA提取试剂盒说明书进行。经紫外分光光度计测定其260 nm和280 nm处吸光度(A)值,选取A260/A280比值为1.8-2.0者,以A计算出浓度。反转录按试剂盒说明书合成cDNA。PCR反应条件如下:94 ℃预变性2 min;96 ℃30 s,55 ℃30 s,72 ℃30 s,进行35个循环(内参照GAPDH只进行了30个循环);72 ℃延长7 min。反应体系为25 μL。取PCR扩增产物5 μL上样于1.5 %琼脂糖(含0.5 g/L的溴化乙锭),于100 V电压下电泳25 min,然后将凝胶放入凝胶电泳成像仪,在紫外光下观察结果并行灰度分析。
6Westernbloting检测HPA及IκB蛋白的表达
提取总蛋白前的细胞药物干预与提取RNA前处理一致,加入RIPA裂解液及使用超声细胞破碎仪裂解细胞,4 ℃、12 000 r/min离心15 min,取上清,用BCA蛋白定量试剂盒(Pierce)测定蛋白浓度后,定量,变性。选择9 %的分离胶及3.75%的浓缩胶,上样、电泳后电转移到PVDF膜上,使用含5%脱脂奶的1×TBST室温封闭膜1 h,加入HPAⅠ抗(1∶600),4 ℃孵育过夜,摇床轻摇,第2 d洗膜,然后加入Ⅱ抗(1∶5 000)室温孵育1 h,洗膜,ECL发光液反应数分钟,使用Kodak 胶卷压片,曝光,显影,定影。然后将膜取出,用Stripping Buffer(Pierce)洗脱后重复上述封闭步骤,加入IκBⅠ抗(1∶800),后同上显影后,再加入内参照GAPDH(1∶2 500),显影。用Quantity One(Bio-Rad)进行灰度分析。
7Transwell细胞体外迁移实验
迁移实验用24孔Transwell板,其孔径为8 μm。照前述用不同浓度的硼替佐米(3.125、12.5、50 nmol/L)作用细胞40 h后用于实验。调整细胞密度为1×109cells/L,Transwell细胞培养板上室中加入200 μL U266细胞悬液,下室中加入含有趋化因子基质细胞衍生因子(stromal cell-derived factor-1α,SDF-1α)和不同浓度的硼替佐米600 μL,RPMI-1640培养液作用细胞为对照,细胞在5%CO2、37 ℃、饱和湿度培养箱中培养8 h,用细胞收集器仔细收集由上室进入下室的U266细胞,然后使用CCK-8试剂盒进行细胞计数。
8统计学处理
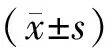
结 果
1U266细胞中HPA的表达情况
在未给予任何干预处理下,HPA mRNA及蛋白在骨髓瘤细胞株U266的表达见图1。
2硼替佐米对U266细胞活性的影响
硼替佐米可抑制U266细胞生长,且呈时间和剂量依赖关系,如图2,硼替佐米作用U266细胞48 h后IC50为8.853 nmol/L。

Figure 1.The expression of HPA mRNA and protein in U266 cells detected by RT-PCR(A) and Western blotting(B),respectively.M:marker;Lane 1-3 :U266 cells.

Figure 2.Cell viability of U266 cells after treated with different concentrations of bortezomib detected by CCK-8 .±s.n=3.
3硼替佐米对HPAmRNA表达水平的影响
由图3可以看出,随着硼替佐米药物浓度的增加,U266细胞内HPA mRNA表达量逐渐减少(均Plt;0.01)。
4硼替佐米对HPA和IκB蛋白表达水平的影响
由图4可以看出,随着硼替佐米药物浓度的增加,IκB蛋白的表达水平逐步增加,而HPA蛋白表达量逐渐减少。经Pearson相关性分析显示,HPA蛋白的表达水平与IκB蛋白的表达水平呈负相关(r=-0.904,Plt;0.01)。
5硼替佐米对U266细胞迁移能力的影响
由于Transwell下室中加入了含趋化因子的胎牛血清,故细胞在趋化因子的作用下由上室迁移至下室,因硼替佐米的作用浓度不同,最终进入下室的U266细胞数不同。随着硼替佐米药物浓度的增加(0、3.125、12.5、50 nmol/L),迁移入下室的U266细胞数逐渐减少,进入下室的细胞分别为:(1.350±0.079)×104个、(1.230±0.088)×104个、(0.830±0.068)×104个、(0.630±0.096)×104个,经方差分析显示,通过不同浓度的硼替佐米处理过的U266细胞,其迁移能力在总体上是有差异的(Plt;0.05)。经Pearson相关分析显示,HPA的表达与U266细胞迁移能力呈负相关(r=0.85,Plt;0.01)。

Figure 3.The expression of HPA mRNA in U266 cells treated with different concentrations of bortezomib for 48 h detected by RT-PCR.M:marker;lane 1-4:0,3.125,12.5 and 50 nmol/L bortezomib,respectively.±s.n=3.**Plt;0.01 vs lane 1.
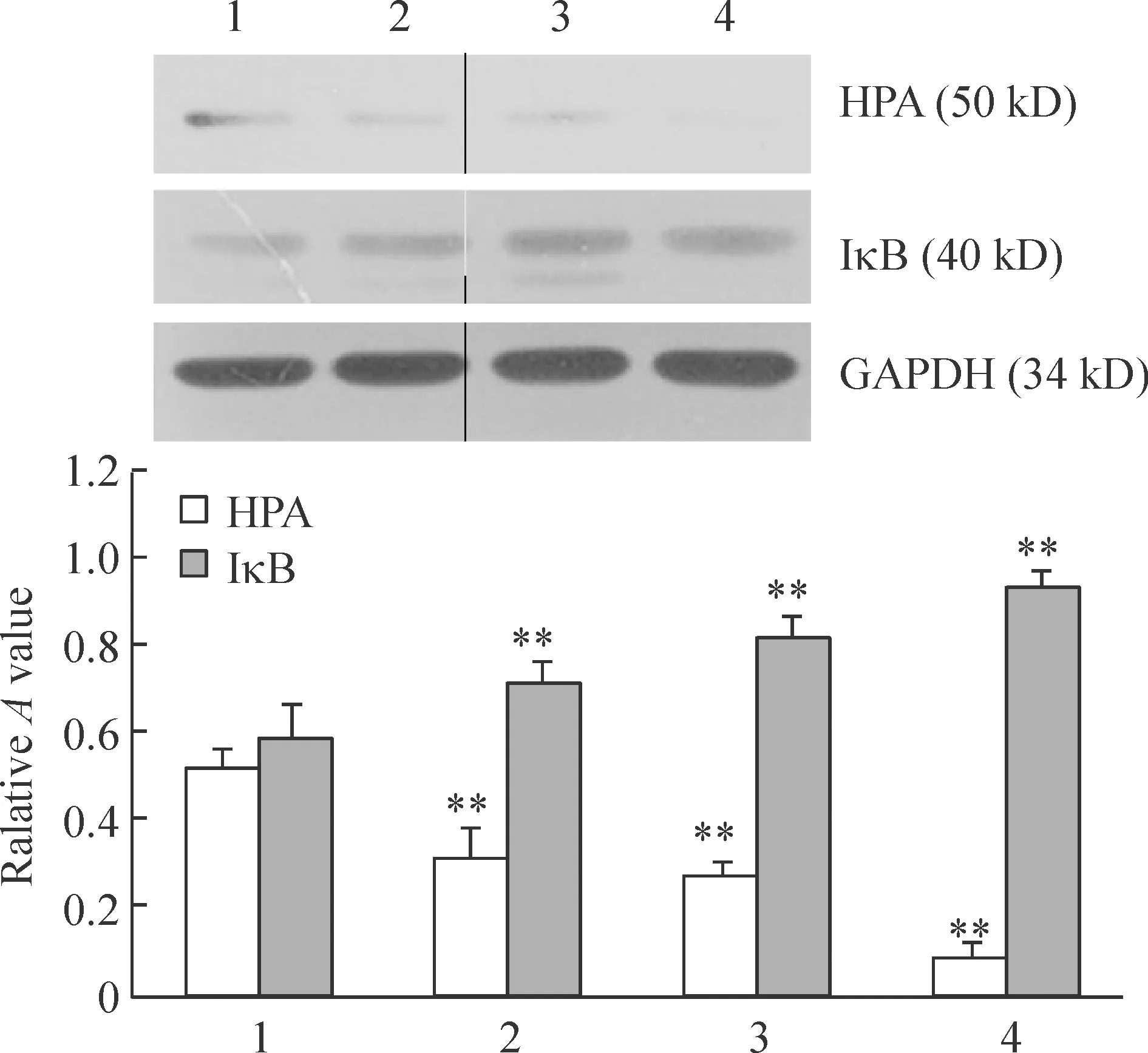
Figure 4. The expression of HPA and IκB proteins in U266 cells treated with different concentrations of bortezomib for 48 h detected by Western blotting.Lane 1-4:0,3.125,12.5 and 50 nmol/L bortezomib,respectively±s.n=3.**Plt;0.01 vs lane 1.
讨 论
MM是浆细胞克隆性增殖的恶性肿瘤,侵袭和转移是恶性肿瘤的重要特征,随着对MM发病机制的研究进展,发现了许多新药抗MM侵袭和转移,同时也发现了通过抑制某些因子或转导通路可降低MM细胞的迁移。
HPA是一种内切糖苷酶,为内源性β葡萄醛酸酯酶,通过对硫酸乙酰肝素蛋白聚糖(heparan sulphate proteoglycans,HSPG)的特异性降解,改变细胞外基质的结构,促使各种炎症细胞及肿瘤细胞的游走转移,同时释放多个具有生物学活性的硫酸乙酰肝素链(heparan sulfate,HS)片段以及与HS结合的各种生长因子及细胞因子,如血管内皮生长因子、碱性成纤维生长因子、转化生长因子β,从而促进血管的生成[2]。目前已证实,与正常组织相比,肿瘤组织优先表达HPA,并且与许多肿瘤细胞的侵袭和转移密切相关,影响着肿瘤的预后[6-8]。在MM中,Kelly等[3]及Mahtouk等[4]发现HPA在MM患者骨髓中呈现高表达,Yang等[5]发现HPA基因转染的MM细胞的增殖和侵袭力上升,皮下注射可转移至脾、肝、肺和骨,骨内注射选择性地转移至其它骨头。
硼替佐米是首个应用于临床治疗难治复发MM的蛋白酶体抑制剂[9],通过抑制蛋白酶体26S亚基的活性,减少NF-κB的抑制因子(IκB)的降解,阻断NF-κB信号途径,从而抑制骨髓瘤细胞增殖及减少生长因子的分泌和黏附因子的表达,达到治疗的目的。本研究发现,MM细胞株U266表达HPA,并随着硼替佐米药物浓度的增加,HPA mRNA及蛋白表达水平逐渐减少,MM细胞的迁移能力逐步减弱,HPA的表达水平与MM细胞的迁移能力密切相关。
因此,我们推测硼替佐米减弱MM细胞迁移的能力,其作用途径之一是通过调节HPA的表达水平来实现的。HPA表达水平的减低可减少激活及释放细胞因子,也可减少可溶性CD138的形成。而可溶性CD138被认为是促进骨髓瘤细胞的生长及侵袭转移的物质[10,11],并能促进基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)表达[12]。由此推测,HPA表达水平的减低,减弱了骨髓瘤细胞的游走能力,增强了黏附性,从而降低了骨髓瘤细胞的侵袭转移能力。
我们的研究还发现,硼替佐米抑制MM细胞HPA的表达,其中HPA蛋白的表达水平与IκB的表达水平呈负相关。是否NF-κB信号途径的阻断抑制了HPA 的转录,进而影响蛋白翻译,尚需进一步研究。但Andela等[13]通过转染无磷酸化功能的IκB载体入小鼠肺泡细胞,阻断NF-κB信号通路,可下调HPA、MMP-9等促转移蛋白物质的表达。总之,目前对于HPA的直接调控机制仍需进一步探讨。
[1]王 清,李 娟,谷景立,等.Bortezomib增强三氧化二砷抑制KM3细胞生长和促凋亡机制的研究[J].中国病理生理杂志,2010,26(2):297-301.
[2]Vlodavsky I,Miao HQ,Medalion B,et al.Involvement of heparan sulfate and related molecules in sequestrateion and growth promoting activity of fibroblast growth factor[J].Cancer Metastasis Rev,1996,15(2) : 177 - 186.
[3]Kelly T,Miao HQ,Yang Y,et al.High heparanase activity in multiple myeloma is associated with elevated microvessel density[J].Cancer Res,2003,63(24):8749-8756.
[4]Mahtouk K,Hose D,Raynaud P,et al.Heparanase influences expression and shedding of syndecan-1,and its expression by the bone marrow environment is a bad prognostic factor in multiple myeloma[J].Blood,2007,109(11):4914-4923.
[5]Yang Y,MacLeod V,Bendre M,et al.Heparanase promotes the spontaneous metastasis of myeloma cells to bone[J].Blood,2005,105(3):1303-1309.
[6]Cohen I,Pappo O,Elkin M,et al.Heparanase promotes growth,angiogenesis and survival of primary breast tumors[J].Int J Cancer,2006,118(7):1609-1617.
[7]Ikeguchi M,Hirooka Y,Kaibara N.Heparanase gene expression and its correlation with spontaneous apoptosis in hepatocytes of cirrhotic liver and carcinoma[J].Eur J Cancer,2003,39 (1) : 86 - 90.
[8]Doweck I,Kaplan-Cohen V,Naroditsky I,et al.Heparanase localization and expression by head and neck cancer: correlation with tumor progression and patient survival[J].Neoplasia,2006,8(12):1055-1061.
[9]Jackson G,Einsele H,Moreau P,et al.Bortezomib a novel proteasones inhibitor in the treatment of hematologic malignancies[J].Cancer Treat Rev,2005,31(8):591-602.
[10]Yang Y,Macleod V,Miao HQ,et al.Heparanase enhances syndecan-1 shedding: a novel mechanism for stimulation of tumor growth and metastasis[J].J Biol Chem,2007,282(18):13326-13333.
[11]Purushothaman A,Uyama T,Kobayashi F,et al.Heparanase-enhanced shedding of syndecan-1 by myeloma cells promotes endothelial invasion and angiogenesis[J].Blood,2010,115(12):2449-2457.
[12]Purushothaman A,Chen L,Yang Y,et al.Heparanase stimulation of protease expression implicates it as a master regulator of the aggressive tumor phenotype in myeloma[J].J Biol Chem,2008,283(47):32628-32636.
[13]Andela VB,Schwarz EM,Puzas JE,et al.Tumor metastasis and the reciprocal regulation of prometastatic and antimetastatic factors by nuclear factor κB[J].Cancer Res,2000,60(23):6557-6562.
Effectofbortezomibonheparanaseexpressionandmigrationabilityofmultiplemyelomacells
ZHENG Dong,YUAN Mei,LI Juan,GU Jing-li,LU Bo,LIU Jun-ru,HUANG Bei-hui
(DepartmentofHematology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:zcxzd@tom.com)
AIM: To study the effects of bortezomib on heparanase (HPA) expression and migration ability of multiple myeloma cell line U266.METHODSThe U266 cells were cultured with different concentrations of bortezomibinvitro.CCK-8 assay was used to determine the cell viability.The mRNA expression of HPA was detected by reverse transcription-polymerase chain reaction (RT-PCR).The protein levels of HPA and IκB were determined by Western blotting.The migration ability of the cells was investigated by Transwell assay.RESULTSHPA was expressed in U266 cells.After treated with bortezomib at the concentrations of 0,3.125,and 12.5 and 50.0 nmol/L for 48 h,the expression of HPA at mRNA and protein levels was gradually reduced (Plt;0.01),and the migration ability of U266 cells was also gradually decreased (Plt;0.01).At the same time,the level of IκB expression negatively correlated with that of HPA expression (Plt;0.01).CONCLUSIONBortezomib inhibits the migration ability of multiple myeloma cell line U266 by suppressing the HPA expression through NF-κB signaling pathway.
Bortezomib; Multiple myeloma; Heparanase; Cell migration
1000-4718(2011)05-0865-04
R733.3
A
10.3969/j.issn.1000-4718.2011.05.007
2011-03-10
2011-04-28
广东省科技计划资助项目(No.2005B30301006)
△通讯作者 Tel:020-87755766-8831;E-mail:zcxzd@tom.com
