siRNA 沉默MIF基因抑制大细胞肺癌H460细胞增殖*
2011-11-20侯俊娜罗益锋王杜娟杨惠玲郭禹标
侯俊娜, 罗益锋, 王杜娟, 杨惠玲, 郭禹标△
(中山大学 1附属第一医院呼吸内科, 2中山医学院病理生理学教研室,广东 广州 510080)
siRNA 沉默MIF基因抑制大细胞肺癌H460细胞增殖*
侯俊娜1, 罗益锋1, 王杜娟2, 杨惠玲2, 郭禹标1△
(中山大学1附属第一医院呼吸内科,2中山医学院病理生理学教研室,广东 广州 510080)
目的: 研究小干扰RNA(siRNA)阻断巨噬细胞抑制因子(MIF)基因表达对大细胞肺癌细胞株H460细胞增殖的抑制效应并探讨其抑瘤机制。方法在体外培养的H460细胞中,采用免疫荧光法观测siRNA转染效率,Western blotting检测MIF蛋白的表达,MTT法和平板克隆形成实验检测 MIF siRNA对H460细胞活性和增殖的抑制作用,Hoechst染色出现后荧光显微镜观测转染后细胞的形态学变化,流式细胞仪观测细胞凋亡。结果与阴性对照组相比,siRNA能有效阻断MIF蛋白的表达,显著抑制H460细胞活性及增殖能力(Plt;0.05);Hoechst染色可见转染MIF siRNA后的H460细胞出现典型的凋亡形态学改变;流式细胞术结果显示转染MIF siRNA1和MIF siRNA2后细胞凋亡较阴性对照组显著增加[ (18.09±0.41)% 和(23.38±2.67)%vs(5.87±1.05)%,Plt;0.05]。结论MIF在大细胞肺癌的发生发展过程中发挥着重要作用,siRNA阻断MIF蛋白表达,可抑制H460细胞增殖,提示其极有可能成为肺癌的新治疗靶点。
巨噬细胞抑制因子; 小干扰RNA; 肺肿瘤
肺癌为当前世界各地最常见的恶性肿瘤之一,半个世纪以来世界各国肺癌的发病率和病死率都有明显增高的趋势。肺癌分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC占80%以上。NSCLC早期侵犯血管,易发生远处转移,且多数NSCLC对放化疗并不敏感,寻找新的诊疗方法迫在眉睫[1,2]。在多数肿瘤可见负调控因子的表达或功能异常,设法拮抗异常的细胞信号转导通路、提高负调控因子或沉默正调控因子,使其达到新的平衡,是治疗肺癌的新策略[3]。目前认为,巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种独特的促进恶性肿瘤发生的细胞因子。MIF不仅作为重要的炎症细胞因子参与机体的炎症及免疫反应,而且和细胞增殖、细胞分化及肿瘤血管生成等关键环节密切相关[4-7]。还有研究证明,靶向沉默MIF基因后,肺腺癌A549细胞的侵袭与迁移能力下降90%,若MIF过表达,则可观察到相反现象[7]。在NSCLC其它类型如大细胞肺癌中是否存在MIF表达及相关的作用,国内外尚未见报道。本研究采用小干扰RNA(small interfering RNA,siRNA)技术阻断MIF蛋白的表达,观察其对人大细胞肺癌H460细胞增殖的影响并探讨其可能机制,为研发NSCLC的新治疗靶点提供实验依据。
材 料 和 方 法
1材料
H460细胞株由中山大学实验动物中心提供。Lipofectamine 2000购自Invitrogen。MIF的siRNA序列由Invitrogen合成,MIF siRNA1: 正义链5′-AUAGUUGAUGUAGACCCUGUCCGGG-3′,反义链5′-CCCGGACAGGGUCUACAUCAACUAU-3′; MIF siRNA2:正义链5′- UUGGUGUUUACGAUGAACAUCGGCA-3′,反义链5′-UGCCGAUGUUCAUCGUAAACACCAA-3′; Opti-MEM培养基、BLOCK-iT Alexa Fluor Red Oligo和Stealth RNAi Negative Control Hi GC Kit均购自Invitrogen。MIF鼠抗人单克隆抗体购自Abcam,HRP标记的羊抗小鼠IgG(Ⅱ抗)购自Cell Signaling Technology。噻唑蓝[3-(4,5-dimethylthiahiazol-2-y1)-3,5-diphenyltetrazoliumromide,MTT]、二甲基亚砜(dimethyl sulfoxide,DMSO)为Sigma产品,RPMI-1640培养基为Gibco产品;小牛血清为杭州四季青产品。Leica DMI4000B 智能型倒置荧光显微镜购自Leica。Annexin V-FITC 细胞凋亡检测试剂盒购自凯基生物;ECL发光液购自北京普利莱基因技术有限公司;流式细胞仪购自BD。
2方法
2.1细胞培养 H460细胞株采用含10%小牛血清、无抗生素的RPMI-1640细胞培养基,置37 ℃、5%CO2、饱和湿度条件下培养。取对数生长期细胞进行实验。转染前24 h消化细胞,传代于6孔板,第2 d按Lipofectamine 2000转染试剂说明书操作。分别用Opti-MEM稀释siRNA及脂质体,室温静置5 min后混和,室温孵育20 min,转染细胞。实验分为阴性对照组(转染negative control siRNA,NC siRNA)和实验组(分别转染MIF siRNA1和MIF siRNA2)。
2.2免疫荧光法观测siRNA转染效率 转染前24 h 消化细胞,传代于6孔板,第2 d按Lipofectamine 2000转染试剂说明书操作,按照浓度梯度加入荧光标记的siRNA,荧光siRNA转染H460细胞,6 h后PBS冲洗1次,倒置荧光显微镜下观察并拍照。
2.3Western blotting法测定目的蛋白MIF的表达 转染后48 h,收集全细胞蛋白标本,常规BCA方法蛋白定量。制备15%聚丙烯酰胺凝胶,进行SDS-PAGE电泳(2-3 h),转移到PVDF膜(50 min),室温5%BSA封闭1 h,加MIF Ⅰ 抗(1∶750)孵育PVDF膜4 ℃过夜,后TBST洗膜3次,加HRP偶联的Ⅱ 抗(1∶2 000),孵育90 min,TBST洗膜3次,ECL发光液显色曝光,Qantity One 软件分析结果。
2.4MTT法测定细胞活性 胰酶消化对数生长期细胞,以每孔5×103细胞接种于96孔板,培养24 h后按Lipofectamine 2000转染试剂说明书操作转染siRNA,使液体终体积100 μL/well,每组设4个复孔,6 h后每孔加入含20%小牛血清、无抗生素RPMI-1640细胞培养基100 μL/well,孵育0、24、48、72 h后,弃去培养液,加入MTT溶液(20 μL/well)培养4 h,吸出孔内培养液后,加入DMSO液(150 μL/well),将培养板置于微孔板扳荡器上振荡10 min,使结晶物溶解,酶联免疫检测490 nm处测量其吸光度值(A值)。
2.5平板克隆实验检测细胞增殖能力 siRNA转染细胞24 h后,胰酶消化细胞,以200 cells/well接种于6孔板,加全培养基2 mL/well继续培养10 d,常规固定染色,显微镜下计数集落,以≥50个细胞作为一个集落,并计算克隆形成率。
克隆形成率=克隆数/接种细胞数×100%
2.6Hoechst染色法观察细胞形态学变化 胰酶消化细胞,按1.5×105cells/well接种于6孔板,第2 d转染,6 h后换液,48 h后弃上清,PBS洗涤2次,常规固定,Hoechst 33342染色(0.3 mL/well),染色10 min,PBS洗涤3次,荧光显微镜下观察并拍照。
2.7流式细胞仪检测细胞凋亡率 转染48 h后弃上清,无EDTA胰酶消化收集细胞,用膜联蛋白(Annexin V)/碘化丙啶(propidium iodide,PI)(Annexin V/PI)双染法检测细胞凋亡率。
3统计学处理
结 果
1免疫荧光法观测转染效率
免疫荧光结果表明,siRNA的成功转染效率可达70%以上,但是在siRNA浓度≥50 nmol/L后,随着siRNA浓度的增加,转染效率没有表现出相应的剂量依赖关系,因此我们选择50 nmol/L的浓度做后续功能研究实验,见图1。

Figure 1.The transfection efficiency of siRNA directed against MIF was assessed by immunofluorescence technique.A: 50 nmol/L siRNA; B: 100 nmol/L siRNA.
2Westernblotting检测靶向沉默MIF基因后,H460细胞中MIF蛋白的表达
与NC siRNA组相比,MIF siRNA1和MIF siRNA2均能有效阻断MIF蛋白的表达,见图2。
3靶向沉默MIF基因对H460细胞活性及增殖的影响
MTT结果表明,H460细胞转染siRNA 48 h后,与NC siRNA组相比,MIF siRNA能显著抑制H460细胞的活性,差异显著(Plt;0.05),见表1。平板克隆实验结果显示,MIF siRNA1和MIF siRNA2组细胞克隆形成率分别为(32.00±4.44)%、(22.00±3.46)%,显著低于NC组细胞克隆形成率(66.67±2.56)%,差异显著(Plt;0.05),见图3。
4MIFsiRNA对H460细胞凋亡的影响
4.1电镜形态学观察 Hoechest 33342染色结果显示,转染siRNA 48 h后,与NC组细胞相比,可见MIF siRNA1组和MIF siRNA2组细胞数减少,并且可见染色质浓缩、碎裂和边集,出现凋亡的形态学改变,见图4。
4.2细胞凋亡的流式检测 流式细胞仪检测转染siRNA 48 h后H460细胞的凋亡情况。结果显示,NC组凋亡率为5.87%,MIFsiRNA1和MIFsiRNA2组凋亡率分别为18.09%、23.38%。差异显著(Plt;0.05),见图5。
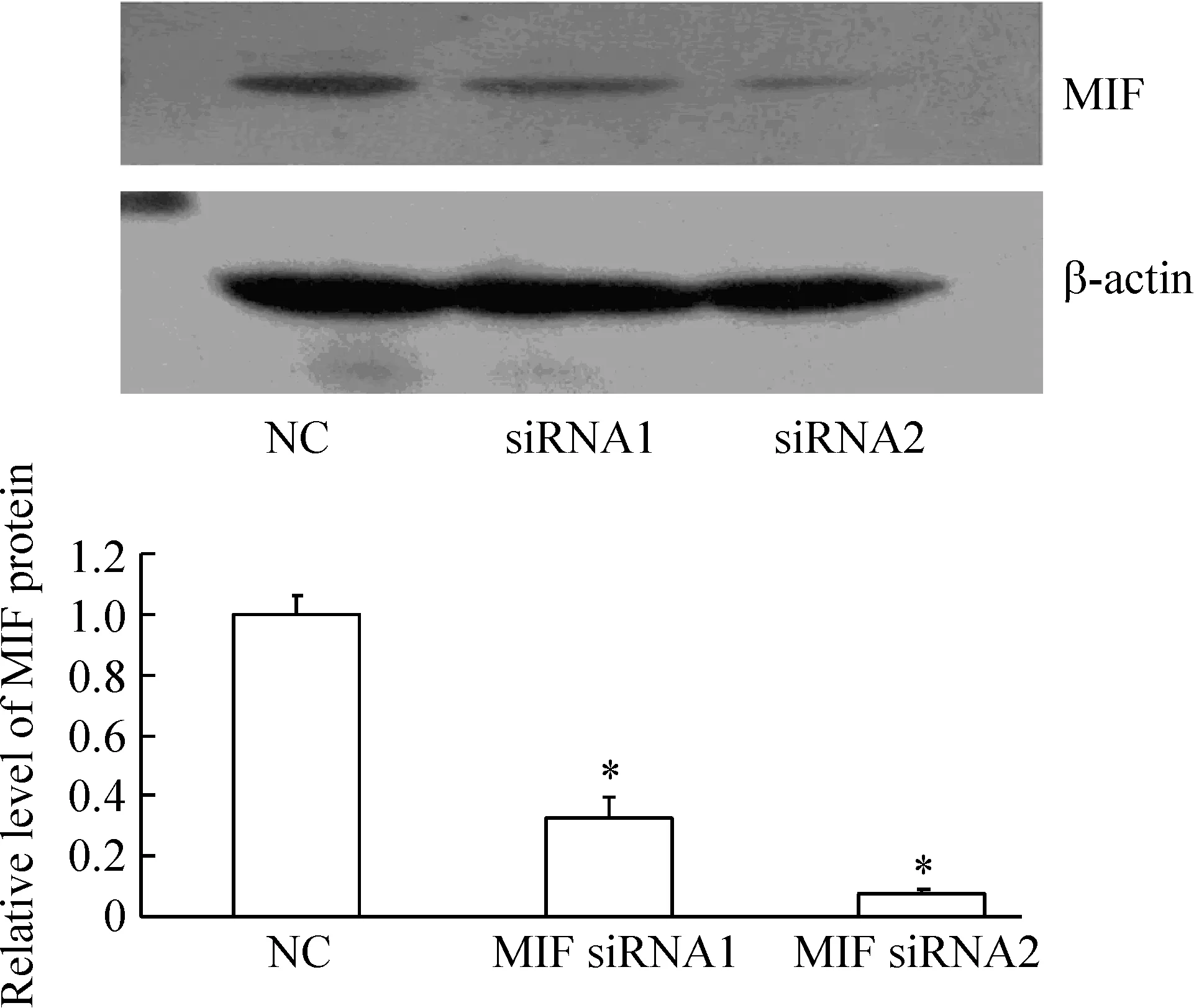
Figure 2.Expression of MIF protein detected by Western blotting in H460 cells after knockdown of MIF gene by siRNA.NC: negative control±s.n=3.*P lt;0.05 vs NC group.
表1 MTT法检测MIF siRNA对H460细胞活性影响
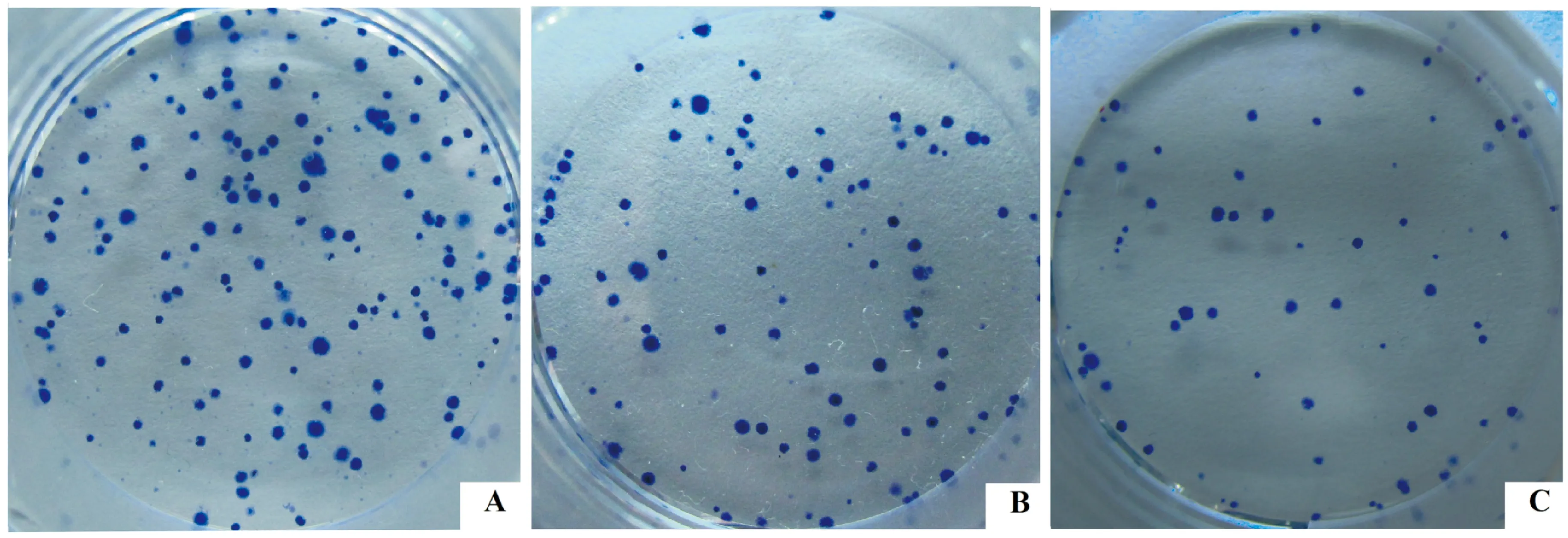
Figure 3.The proliferation of H460 cell induced by MIF siRNA.A: negative control group; B: MIF siRNA1 group ;C: MIF siRNA2 group.
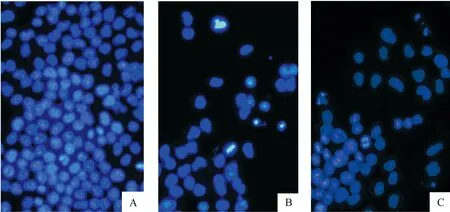
Figure 4.The morphological character of apoptosis in H460 cell induced by MIF-siRNA was detected by Hoechst 33342.A: negative control group;B: MIF siRNA1 group;C:MIF siRNA2 group.
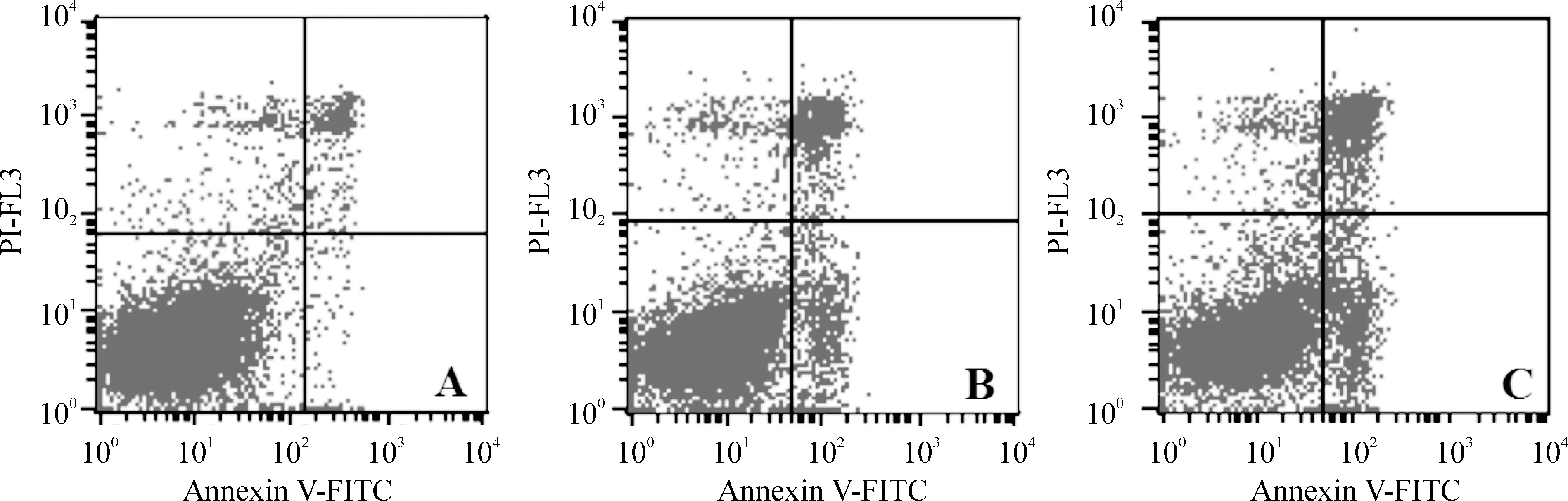
Figure 5.The apoptosis of H460 cell line after treatment with MIF siRNA for 48 h.±s.n=3.A: negative control group(5.87±1.05)%; B: MIF siRNA1 group(18.09±0.41)%*;C: MIF siRNA2 group(23.38±2.67)%*#.*Plt;0.05 vs negative control group;#Plt;0.05 vs MIF siRNA1 group.
讨 论
MIF是一个相对分子量为12.5 kD的非糖基化蛋白,最初它作为激活的T淋巴细胞产生的一种可溶性淋巴因子被发现,认为其有抑制巨噬细胞迁移作用。后来进一步研究表明,它在炎症及肿瘤的发生发展中发挥着重要作用。目前认为,巨噬细胞移动抑制因子是一种独特的促进恶性肿瘤发生的细胞因子。MIF在多种肿瘤如肝癌﹑结肠癌、肺腺癌﹑乳腺癌﹑膀胱癌、前列腺癌、神经母细胞瘤及慢性粒细胞白血病等肿瘤细胞过度表达[4-11]。
已有多项研究发现,MIF参与了肺癌特别是NSCLC的发生和发展,Khan等[11]研究发现,NSCLC病人的血清MIF和血清淀粉样蛋白-A(SAA)水平明显增高,提示MIF可作为肿瘤生物标志物检测早期肺癌;Kamimura等[12]通过免疫组化/原位杂交发现非小细胞肺癌病人的肺组织MIF过度表达且与预后明确相关;White 等[13]研究表明:NSCLC肺癌组织标本高表达MIF与血中血管内皮生长因子(vascular endothelial growth factor,VEGF)和肺癌组织CXC趋化因子(CXC chemokine)表达升高呈正相关,特别是与肿瘤组织微血管密度(mierovascular density,MVD)呈显著正相关。McClelland等[14]进一步发现,NSCLC组织标本中特异的MIF受体-CD74表达同样显著增高且诱导体内外促血管新生的CXC趋化因子表达升高;MIF这种诱导血管新生效应可被CD74抗体所拮抗。上述结果均提示MIF与NSCLC血管生成和肿瘤细胞转移有密切关系。至于肺癌细胞自分泌或旁分泌MIF究竟如何参与控制肿瘤细胞增殖、迁移以及促进血管生成,其信号通道与分子机制目前尚不清楚,我们在国内首次用siRNA阻断或减少MIF蛋白表达,探讨研究其抑瘤作用,对寻求治疗肺癌的新途径和新治疗靶点具有重要意义。
大量研究表明,MIF通过抑制抑癌基因p53的功能、持续激活胞外信号调节激酶(extracellular signal-regulated kinase,ERK)/ 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路、诱导环氧化酶(cyclooxygenase,COX)/前列腺素E2(prostaglandin E2,PGE2)激活、促进血管内皮细胞的增殖及分化等独特的生物学作用多层次促进肿瘤的生长、增殖及侵袭[15];并且在低分化肿瘤中,MIF表达与预后相关[16],提示MIF与肿瘤的发生、发展及预后关系密切,但具体的分子机制尚未完全阐明。Jung 等[9]研究表明,MIF阻止P53从胞浆转移至胞核,并且可抑制P53的活性,抑制细胞增殖、促进凋亡。Binsky等[10]在慢性淋巴细胞白血病的研究中发现,MIF表达明显升高,通过激活IL-8,继而Bcl-2表达增加,抑制肿瘤细胞凋亡,促进细胞增殖。Arenberg 等[17]发现,在C57BL/6小鼠肺损伤急性期,MIF表达增加,抑制在急性期注入小鼠体内的Louis癌细胞的凋亡,促进其增殖,而在敲除MIF基因的小鼠中则无此现象。
我们的研究结果表明:大细胞肺癌H460细胞株高表达MIF蛋白,体外应用siRNA靶向沉默MIF基因后,H460细胞的活性、增殖能力下降;继而用Annexin V - FITC/ PI 双染色凋亡检测发现,转染MIF siRNA部分阻断MIF表达后,H460细胞凋亡率显著增加,与之前Jung等[9]的研究结果相似,为MIF在人类恶性肿瘤特别是NSCLC中发挥着重要作用提供了更丰富的证据。
我们的研究首次证实在大细胞肺癌的生长、进展过程中,MIF可能通过促进细胞凋亡抑制肿瘤细胞的增殖,这也为研发大细胞肺癌新的治疗靶点提供了重要的实验依据,并且研究过程中所用的MIF siRNA也可能成为有效的抗癌药物。但是,目前关于MIF siRNA 促进细胞凋亡、抑制细胞增殖的具体信号通道与分子生物学机制尚不明了,基于之前国内外学者的大量研究,我们审慎地推测:MIF作为一种促炎、促癌的细胞因子,广泛参与非小细胞肺癌的各种细胞生物学行为,介导不同信号转导通路之间的交互对话(crosstalk),从而协同促进非小细胞肺癌的发生发展,当然这尚需要更完善的体内外实验来验证。通过特异的MIF siRNA阻断MIF表达,检测凋亡和增殖相关的上、下游信号转导分子,进一步探讨其可能的体内外抑癌机制,本课题组正在进行深入研究。
[1]阎春红,范小航,杨惠玲.等.2-甲氧雌二醇对人肺癌细胞的放射增敏作用[J].中国病理生理杂志,2010,26(1):137-141.
[2]张淑香,谢灿茂,高桥和久.毒蕈碱胆碱能受体3在小细胞肺癌增殖和迁移中的调节作用[J].中国病理生理杂志,2010,26(9):1679-1683.
[3]Lee MH,Yang HY.Regulators of G1 cyclin-dependent kinases and cancers[J].Cancer Metastasis Rev,2003,22(4): 435-449.
[4]Takahashi N,Nishihira J,Sato Y,et al.Involvement of macrophage migration inhibitory factor(MIF) in the mechanism of tumor cell growth[J].Mol Med,1998,4(11):707-714.
[5]Hira E,Ono T,Dhar DK,et al.Overexpression of macrophage migration inhibitory factor induces angiogenesis and deteriorates prognosis after radical resection for hepatocellular carcinoma[J].Cancer,2005,103(3): 588-598.
[6]Meyer-Siegler KL,Bellino MA,Tannenbaum M.macrophage migration inhibitory factor evaluation compared with prostate specific antigen as a biomarker in patients with prostate carcinoma[J].Cancer,2002,94(5): 1449-1456.
[7]Rendon BE,Roger T,Teneng I,et al.Regulation of human lung adenocarcinoma cell migration and invasion by macrophage migration inhibitory factor[J].J Biol Chem,2007,282(41): 29910-29918.
[8]Ren Y,Chan HM,Li Z,et al.Upregulation of macrophage migration inhibitory factor contribute to induced N-Myc expression by the activation of ERK signaling pathway and increased expression of interleukin-8 and VEGF in neuroblastoma[J].Oncogene,2004,23(23): 4146-4154.
[9]Jung H,Seong HA,Ha H.Critical role of cysteine residue 81 of macrophage migration inhibitory factor(MIF) in MIF-induced inhibition of p53 activity[J].J Biol Chem,2008,283(29):20383-20396.
[10]Binsky I,Haran M,Starlets D,et al.IL-8 secreted in a macrophage migration-inhibitory factor- and CD74-dependent manner regulates B cell chronic lymphocytic leukemia survival[J].Proc Natl Acad Sci USA,2007,104(33):13408-13413.
[11]Khan N,Cromer CJ,Campa M,et al.Clinical utility of serum amyloid A and macrophage migration inhibitory factor as serum biomarkers for the detection of nonsmall cell lung carcinoma[J].Cancer,2004,101(2):379-384.
[12]Kamimura A,Kamachi M,Nishihira J,et al.Intracellular distribution of macrophage migration inhibitory factor predicts the prognosis of patients with adenocarcinoma of the lung[J].Cancer,2000,89(2):334-341.
[13]White ES,Flaherty KR,Carskadon S,et al.Macrophage migration inhibitory factor and CXC chemokine expression in non-small cell lung cancer: role in angiogenesis and prognosis[J].Clin Cancer Res,2003,9(2): 853-860.
[14]McClelland M,Zhao L,Carskadon S,et al.Expression of CD74,the receptor for macrophage migration inhibitory factor,in non-small cell lung cancer[J].Am J Pathol,2009,174(2):638-646.
[15]Conroy H,Mawhinney L,Donnelly SC.Inflammation and cancer: macrophage migration inhibitory factor(MIF)-the potential missing link[J].QJM,2010,103(11):831-836.
[16]Tomiyasu M,Yoshino I,Suemitsu R,et al.Quantification of macrophage migration inhibitory factor mRNA expression in non-small cell lung cancer tissues and its clinical significance[J].Clin Cancer Res,2002,8(12):3755-3760.
[17]Arenberg D,Luckhardt TR,Carskadon S,et al.Macrophage migration inhibitory factor promotes tumor growth in the context of lung injury and repair[J].Am J Respir Crit Care Med,2010,182(8):1030-1037.
血管钙化转化医学研究进展研讨会第一轮通知
血管钙化是动脉粥样硬化、糖尿病、慢性肾衰的常见并发症,与上述疾病的心血管事件发生率和死亡率密切相关。为促进国内血管钙化领域临床工作者和基础科研人员的深入交流与广泛合作,提升我国在血管钙化领域的国际学术影响力,凝练血管钙化的转化医学研究队伍,由教育部分子心血管重点实验室、北京大学医学部生理与病理生理系、附属北医三院和人民医院、《生理科学进展》杂志、中日友好医院联合主办,兹定于2011年8月27日在北京大学医学部召开首届血管钙化转化医学研究进展研讨会,就血管钙化的临床流行病学、发病机制、诊治及预后等热点问题进行为期一天的探讨与交流。会议邀请了国内该领域知名专家与会作专题报告,欢迎从事临床、基础、预防和药学工作对血管钙化感兴趣的学者踊跃参会。
会议无需注册费。26号下午和27号早8点前报到,报名者请于6月1日之前将回执发至kongfanwei2000@gmail.com,由大会主席批准后确认参会名单。会议征集500字论文摘要,内容涉及血管钙化相关临床流行病学、诊断、发病机制、治疗等方面,请于7月15日之前提交至kongfanwei2000@gmail.com。
会 议 主 席: 唐朝枢 教授,王 宪 教授
会议筹备组: 王 悦 教授,王 梅 教授,齐永芬 教授,孔 炜 教授
会议联系人: 孔 炜 教授
电 话: 010-82805594
InhibitionofhumanlungcarcinomaH460cellproliferationbysiRNA-mediatedMIFknockdown
HOU Jun-na1,LUO Yi-feng1,WANG Du-juan2,YANG Hui-ling2,GUO Yu-biao1
(1DepartmentofPulmonaryandCriticalCareMedicine,TheFirstAffiliatedHospital,2DepartmentofPathophysiology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China.E-mail:guoyubiao@hotmail.com)
AIM: To investigate the inhibitory effect of siRNA-mediated MIF knockdown on the proliferation of human lung carcinoma H460 cells and to elucidate the molecular mechanism of anti-tumor effect of the siRNA.METHODSThe transfection efficiency was assessed by immunofluorescence technique.The expression of MIF after the gene knockdown was determined by Western blotting.The viability and proliferation of H460 cancer cells were detected by MTT assay and colony formation assay,respectively.The cell apoptosis and morphological changes were examined by flow cytometry and electron microscopy,respectively.RESULTSMIF siRNA significantly inhibited MIF expression in H460 cells,and decreased the proliferation of the cells(Plt;0.05).The morphological changes were detected in the nuclei of H460 cells induced by MIF siRNA.The apoptotic rates were much higher in the groups of MIF siRNA1 and MIF siRNA2 than that in negative control group[(18.09±0.41)% and(23.38±2.67)%vs(5.87±1.05)%,Plt;0.05].CONCLUSIONMIF might play an important role in the pathogenesis and progression of large cell lung cancer.siRNA-mediated knockdown of MIF results in the inhibition of H460 cell proliferation,indicating that MIF might be used as a potential therapeutic target in lung cancer.
Macrophage migration inhibitory factor; Small interference RNA; Lung neoplasms
1000-4718(2011)05-0853-06
R734.2
A
10.3969/j.issn.1000-4718.2011.05.005
2010-12-20
2011-03-07
广东省自然科学基金资助项目(No.10151008901000242);2010年广东省科技计划资助项目(No.2010B080701010)
△通讯作者 Tel: 020-87755766-8132; E-mail: guoyubiao@hotmail.com
