阻塞性黄疸对肠上皮细胞氯离子分泌影响的研究*
2011-11-20陈振勇戴红梅王延刚黄文广冯贤松
陈振勇, 戴红梅, 杨 鹏, 王延刚, 黄文广, 冯贤松
(华中科技大学同济医学院附属协和医院综合外科, 湖北 武汉 430022)
阻塞性黄疸对肠上皮细胞氯离子分泌影响的研究*
陈振勇△, 戴红梅, 杨 鹏, 王延刚, 黄文广, 冯贤松
(华中科技大学同济医学院附属协和医院综合外科, 湖北 武汉 430022)
目的探讨阻塞性黄疸(OJ)对肠上皮细胞氯离子分泌的影响。方法建立OJ大鼠模型,分别于胆管结扎7 d(OJ1组)和14 d(OJ2组)后,检测实验动物外周血Cl-浓度,取末端回肠上皮细胞体外培养,荧光分光光度法测量细胞内Cl-浓度,全细胞膜片钳技术检测Cl-电流的改变,并用Western blotting法分析电压门控氯离子通道蛋白2(ClC-2)表达的变化。结果OJ1组和OJ2组的血清Cl-浓度分别为(88.67±4.68)mmol/L 和(82.01±6.25)mmol/L,均低于对照组(均Plt;0.05)。细胞内Cl-相对浓度,OJ1组(3.14±0.38)和OJ2组(3.55±0.47)均高于对照组(均Plt;0.05)。对照组肠上皮细胞Cl-电流,从-80 mV的(-15.45±7.56)pA/pF升到80 mV的(5.85±0.81)pA/pF,呈外向整流趋势。OJ组Cl-平均电流密度绝对值逐渐减小,与对照组比较差异显著(均Plt;0.05)。Western blotting分析显示ClC-2蛋白表达条带在90 kD附近,对条带的定量分析表明,OJ1组为0.20±0.04,OJ2组为0.19±0.06,均低于对照组(0.27±0.06)(均Plt;0.05),但OJ1、2组间比较没有显著差异(Pgt;0.05)。结论OJ抑制肠腔氯离子分泌,缩小上皮细胞内外氯离子浓度差,减少Cl-外向电流,此作用与细胞膜上氯离子通道蛋白 2的表达降低有关。
黄疸, 梗塞性; 肠细胞; 氯化物通道
肠上皮具有离子运输和屏障功能,从数量上说,肠腔液体分泌最初由跨上皮的氯离子分泌所驱动,而液体的吸收主要由与营养素一起消化吸收的钠离子所提供,两者间维持平衡并精密调控。电解质跨上皮运输涉及到膜运输蛋白,氯通道蛋白即是与肠腔氯化物分泌有关的一种膜运输蛋白[1],其中2型电压门控道氯离子通道 (type 2 voltage-gated chloride channel,ClC-2)发挥重要生理作用[2]。尽管随着术前评估和术后护理的进展,阻塞性黄疸(obstructive jaundice,OJ)仍保持较高的发病率和死亡率,其中关键性的病理生理因素是肠屏障功能破坏,肠通透性增加,从而引起全身的内毒素血症[3]。其中的原因并不甚清楚,可能的机制包括肠上皮细胞紧密连接蛋白的改变、氧化应激、上皮细胞增殖和凋亡平衡的破坏等[4]。OJ能造成全身和肠腔局部的影响,临床上也可以观察到OJ患者肠蠕动减弱和肠腔液体分泌障碍[5],OJ对肠腔液体分泌的影响尚未见更多报道。我们从与肠腔氯离子分泌有关的ClC-2着手,探讨OJ对氯离子分泌的影响,为研究OJ影响肠腔离子分泌与屏障功能障碍提供研究基础。
材 料 和 方 法
1动物与分组
健康Wistar大鼠50 只,雌雄不限,体重250-330 g,由同济医学院实验动物中心提供。按随机数字表法分为3组:对照组(n=10),不作任何操作,14 d后拉脱法处死;OJ1组(n=10),采用10%水合氯醛(0.3 g/kg)腹腔注射麻醉,开腹手术结扎切断胆总管后关腹,7 d后处死;OJ2组(n=10)同法制造模型,14 d后处死。动物腔静脉穿刺抽血2 mL,应用CX5全自动生化分析仪(Beckman)测定血清氯离子浓度。距回盲部10 cm处环形切取回肠,取1 mm×1 mm×1 mm大小的组织数块。
2小肠上皮细胞体外培养[6]
组织块剪碎,使用DMEM培养基[达尔伯克(氏)改良伊格尔(氏)培养基,Gibco],加入0.15%胰蛋白酶10 mL,培养瓶垂直置于振荡仪上室温振荡消化30 min,用含10%FBS的培养基10 mL终止消化。反复吹打消化后的细胞液5 min,将消化溶液转移至15 mL离心管,1 000 r/min离心6 min,弃上清。加入细胞清洗液,再次吹打5 min,1 000 r/min,离心5 min。重复4次。用培养液重悬沉淀,种植于以2%明胶包被的24孔培养板,置于37℃、5%CO2细胞培养箱中培养,每48 h换液1次,培养7 d传3-4代后进行实验。
3肠上皮细胞内Cl-浓度的测定[7]
荧光分光光度法测量细胞内Cl-浓度。细胞悬液加入2 mL比色杯,加入氯离子敏感的荧光染料(MQAE, Molecular Probes)终浓度为5 mmol/L,于37 ℃2 h后用荧光光度计(RF-5301PC型荧光分光光度计,日本岛津公司)测量荧光强度,激发波长365 nm,发射波长450 nm,每10 min计数1次。通过荧光强度的比值计算Cl-浓度。
4全细胞膜片钳技术检测肠上皮细胞Cl-电流的改变
参照文献[8]方法,培养细胞静置48 h后细胞悬液滴片,孵箱中4 h细胞铺满盖玻片后开展膜片钳实验。拉制电极使其阻抗为3-4 MΩ。在全细胞模式下,用EPC-9膜片钳放大器(HEKA,Lambrecht)检测氯通道电流。钳制电压0 mV,测试电压-80 mV~+80 mV,阶跃10 mV,每个刺激保持500 ms,然后复极化到-80 mV。信号为Pulse软件收集并存储,实验图形采用Igor Pro分析软件(Version 3.3)进行分析处理。
5肠上皮细胞ClC-2蛋白表达的变化
Western blotting分析。取黏膜组织100 mg,采用BCA法用紫外可见分光光度仪(Waters)测定蛋白浓度,取样本10 μL预染,加入缓冲液;煮沸,经SDS-PAGE凝胶电泳分离。取出硝酸纤维膜(Costar),染色,用含TBS-T洗膜4次后封闭。加入兔抗鼠CLC-2Ⅰ抗蛋白(Sigma)(1∶300稀释),以β-actin(武汉博士德产品)为内参照。加入Ⅱ抗〔四甲基异硫酸罗丹明(TRITC)-山羊抗兔IgG,北京中山生物技术有限公司〕孵育。暗室下胶片显影,扫描。Olympus BX41图像采集系统收集图片信息分析灰度。
6统计学处理

结 果
1动物血清Cl-浓度的改变
血清Cl-浓度即是细胞外Cl-浓度,结果表明OJ后细胞外Cl-浓度均低于对照组,并且OJ2组更低于OJ1组,差异显著(均Plt;0.05),说明随时间推移,梗阻程度加深,细胞外Cl-浓度下降更严重,见表1。

表1 OJ前后血清Cl-浓度的变化
2体外培养肠上皮细胞内Cl-浓度的变化
荧光分光光度法测量的荧光强度间接反应上皮细胞内Cl-浓度的变化,见表2。OJ组的荧光强度均明显高于对照组,并且OJ2组高于OJ1组(均Plt;0.05)。

表2 体外培养肠上皮细胞内Cl-浓度的变化
3肠上皮细胞Cl-电流的改变
由于OJ后细胞内外Cl-浓度均发生改变,因此必然存在Cl-电流的变化。通过全细胞膜片钳技术检测肠上皮细胞Cl-电流,发现正常情况下氯电流随膜的去极化逐渐由负值向正值转化,从-80mV的(-15.45±1.70) pA/pF升到80mV的(5.85±0.81) pA/pF,呈外向整流趋势。同时,OJ1组从(-12.16±1.15)pA/pF上升到(4.69±0.65)pA/pF,OJ2组分别为(-11.55±1.26 )pA/pF和(4.57±0.76) pA/pF。Cl-平均电流密度变化的绝对值,OJ组均小于对照组(均Plt;0.05),但OJ1组与OJ2组间比较没有显著差异(Pgt;0.05),见图1。
4肠上皮细胞ClC-2蛋白表达的变化
细胞内外Cl-浓度和电流的变化与细胞表面的氯离子通道蛋白有关,ClC-2是广泛分布的氯通道家族之一,已证实在胃壁细胞和小肠、结肠上皮细胞有分布,定位于胃肠道上皮细胞膜尖端[8]。Western blotting结果发现ClC-2表达条带在90 kD附近,见图2A,与文献报道相似[9]。
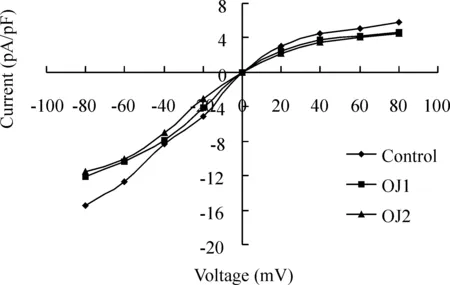
Figure 1. The changes of Cl- current among the three groups.
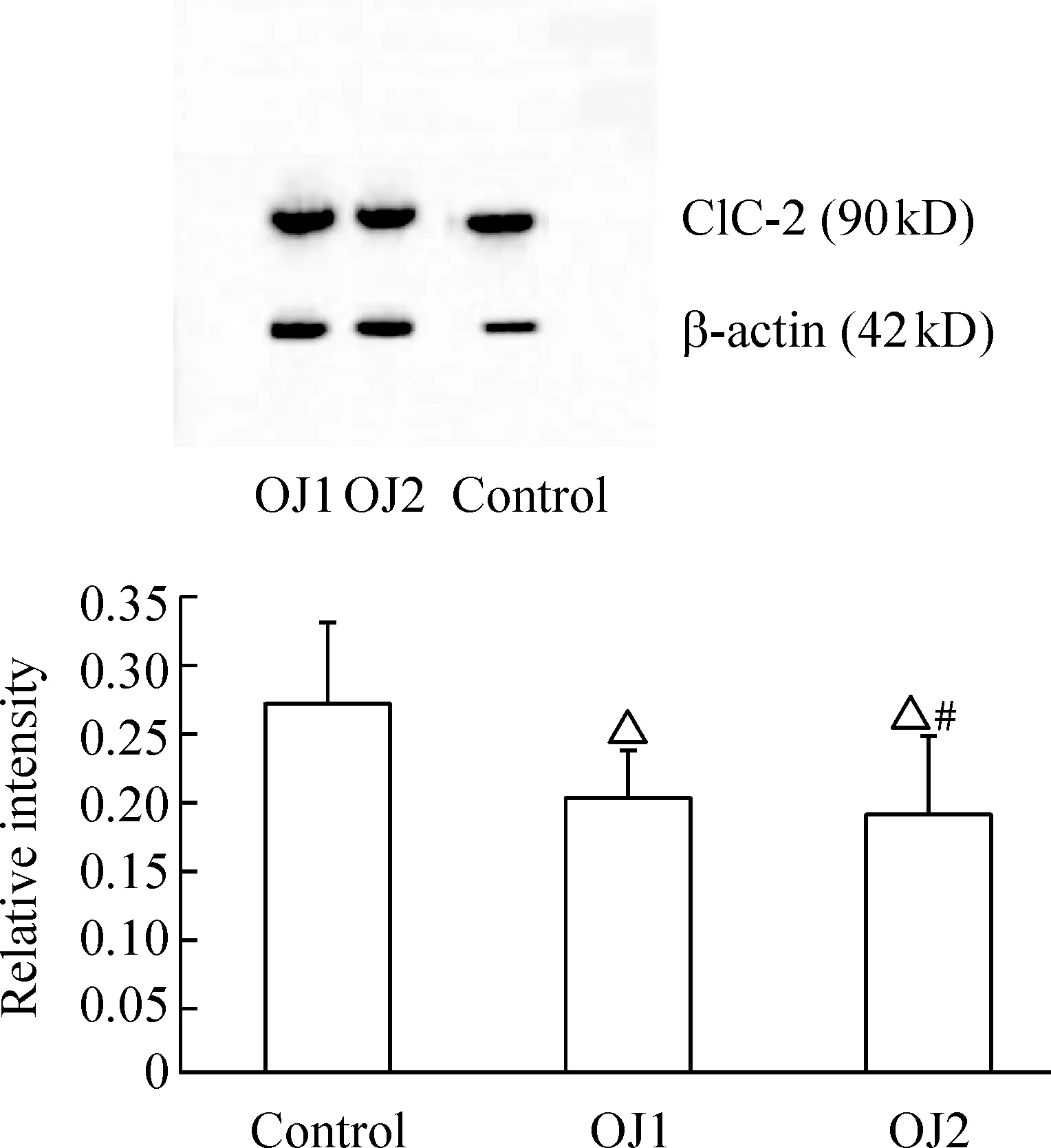
Figure 2. ClC-2 protein expression±s.n=10.△Plt;0.05 vs control group; #Plt;0.05 vs OJ1 group.
通过图像分析仪测量条带的相对灰度值,定量结果分析表明,OJ1组为0.20±0.04,OJ2组为0.19±0.06,均显著低于对照组(0.27±0.06),Plt;0.05,但两实验组间比较无差异显著(Pgt;0.05),见图2B。
讨 论
OJ对机体的影响是全方位的,仅就胃肠道而言,能破坏肠黏膜屏障,其作用与肠上皮细胞紧密连接蛋白数量的减少和再分布有关[10]。OJ对肠黏膜屏障的损伤是关键性启动因素,引起细菌及内毒素血症,进而引起炎性细胞因子的“瀑布样”效应,形成所谓“肠源性脓毒症”。临床上可以观察到OJ患者肠蠕动减弱和肠腔液体分泌障碍,OJ是如何影响肠腔离子分泌尚未见更多研究。氯离子通过跨膜转运和氯离子通道参与了几乎已知的各种生物过程[5],因此我们从氯离子入手,探讨OJ对肠腔离子分泌的影响。
肠腔液体分泌依靠细胞内外离子浓度差及肠上皮细胞的跨膜离子转运,氯离子的通透性受胞外氯离子浓度的影响,许多阳离子如K+、Na+等也可通过氯通道。我们研究发现OJ降低细胞外Cl-浓度,升高细胞内Cl-浓度,缩小细胞内外Cl-浓度差,且这种浓度差在OJ2组大于OJ1组,说明随OJ时间延长Cl-分泌影响更大。
临床上OJ患者出现水、电解质紊乱较常见,其中也包括Cl-失衡。原因在于液体、营养物质摄入不足;合并感染导致呕吐或发热,液体丢失过多;内毒素血症和高胆红素血症致肾脏受损等[11]。我们的研究也证实随OJ程度的加深,对Cl-分泌的抑制程度更大。
为更深入了解OJ影响Cl-分泌的机制,我们从氯离子电流和氯通道蛋白角度作进一步研究。细胞内外Cl-浓度的变化可激活一种外向电流,即氯离子电流,该电流具有典型的外向整流特性。通过全细胞膜片钳技术显示,对照组Cl-平均电流密度从-80 mV的(-15.45±7.56 )pA/pF升到80 mV的(5.85±0.81) pA/pF,而OJ1组从(-12.16±4.68)pA/pF升到(4.69±0.65)pA/pF,OJ2组从(-11.55±6.25) pA/pF升到(4.57±0.76) pA/pF,OJ后肠上皮细胞Cl-平均电流密度变化幅度明显小于对照组,说明OJ后Cl-外向电流受抑制,这也与细胞内外Cl-浓度差减小是一致的。这种外向电流普遍存在于哺乳动物细胞内,对维持细胞容积的动态平衡,调节细胞的电活动,以及对细胞内pH值、细胞增殖与分化、细胞凋亡等多种生物学功能发挥重要作用[12]。Cl-外向电流的破坏也将损害肠上皮细胞的各种生理功能。
肠腔氯化物分泌和氯离子电流的产生与肠上皮细胞氯通道蛋白有关。氯通道是指分布于细胞膜上的一种通道蛋白,其不仅运输氯离子,还广泛地转运其它阴离子或离子团。根据调节因子的差异,将氯通道分为6类:电压门控氯通道(voltage- gated chloride channel,ClC型氯通道)、囊性纤维跨膜转导调节因子、钙激活氯通道、p64相关氯通道、容积调控阴离子通道和配体门控氯通道[13]。ClC型氯通道包括9个亚型,研究比较多的是ClC-2通道。ClC-2广泛存在于机体的细胞膜和胞内细胞器膜上[14],在胃肠道上皮细胞内定位于细胞膜尖端[15],结构上为同源二聚体,受电压和H+、Cl-激活。在细胞电活动、容积调节、跨上皮物质运输、细胞内pH调节、细胞免疫应答[16]和细胞凋亡[17]中都发挥一定作用。
我们进一步研究OJ对肠上皮细胞ClC-2通道的影响。结果表明ClC-2蛋白表达条带在90 kD左右,通过对表达条带的定量分析也发现OJ组的ClC-2的表达量低于对照组,也说明OJ抑制了ClC-2的表达。这也与细胞内外氯离子浓度差缩小,氯离子外向电流减小一致。
ClC-2不仅存在细胞膜上,在细胞内也有大量存在,两者间的ClC-2能循环利用,其作用类似于起运输作用的脂质筏,因此ClC-2运输至膜及其在膜内传输是调节ClC-2活性的方式之一[18]。ClC-2氯通道在因缺血受损的肠黏膜修复中具有重要作用[19]。研究表明ClC-2与环绕黏膜上皮细胞顶侧的紧密连接具有共同的分布区域[20],OJ能同时破坏紧密连接蛋白和ClC-2,是否可以推测OJ损伤肠黏膜屏障与ClC-2有关。探讨OJ对肠腔离子分泌的影响,也将为OJ破坏肠黏膜屏障的机制寻找到新的突破方向。
[1] Barrett KE. New ways of thinking about (and teaching about) intestinal epithelial function[J]. Adv Physiol Educ, 2008, 32(1): 25-34.
[2] Rinke I,Artmann J,Stein V. ClC-2 voltage-gated channels constitute part of the background conductance and assist chloride extrusion[J]. J Neurosci, 2010, 30(13): 4776-4786.
[3] Wang N, Yu H, Ma J,et al. Evidence for tight junction protein disruption in intestinal mucosa of malignant obstructive jaundice patients[J]. Scand J Gastroenterol, 2010, 45(2): 191-199.
[4] Assimakopoulos SF, Scopa CD, Vagianos CE. Pathophysiology of increased intestinal permeability in obstructive jaundice[J]. World J Gastroenterol, 2007, 13(48):6458-6464.
[5] Assimakopoulos SF, Tsamandas AC, Louvros E,et al. Intestinal epithelial cell proliferation, apoptosis and expression of tight junction proteins in patients with obstructive jaundice[J]. Eur J Clin Invest, 2011, 41(2):117-125.
[6] 纪华英,陈其奎,曾 晖.小鼠小肠上皮细胞的体外原代培养[J].医学综述,2010,16(9):1417-1419.
[7] 周京红,吴德政.氟哌啶醇在K562/Dox细胞中对P-糖蛋白及氯离子通道的影响[J].中华肿瘤杂志,2005,27(2):81-85.
[8] 王昌明,高尚邦,余维巍,等.大鼠肺动脉平滑肌细胞钙激活氯通道电流的电生理检测[J].中国应用生理学杂志,2007,23(3):261-263,318.
[9] Cao L,Zhang XD,Liu X, et al.Chloride channels and transporters in human corneal epithelium[J]. Exp Eye Res, 2010,90(6):771-779.
[10]陈振勇,冯贤松,杨 鹏,等.不同营养方式对梗阻性黄疸大鼠肠紧密连接蛋白的影响[J].中华实验外科杂志,2010,27(1):78-80.
[11]Clarke DL,Pillay Y,Anderson F,et al.The current standard of care in the periprocedural management of the patient with obstructive jaundice[J].Ann R Coil Surg Engl,2006,88(7):610-616.
[12]袁振宇,叶春玲.体积调节性氯离子通道的研究进展[J].国外医学:生理、病理科学与临床分册,2004,24(3):295-298.
[13]Estévez R, Jentsch TJ. CLC chloride channels: correlatin structure with function[J]. Curr Opin Struct Biol, 2002, 12(4): 531-539.
[14]孔晓霞,李 扬,张宏宇,等.线粒体氯通道蛋白在过氧化氢诱导C6细胞损伤中的作用[J].中国病理生理杂志,2008, 24 (3):481-483.
[15]Michael C, Adil EB, Ryuji U, et al. Effect of a selective chloride channel activator, lubiprostone, on gastrointestinal transit, gastric sensory, and motor functions in healthy volunteers[J]. Am J Physiol Gastrointest Liver Physiol,2006, 290(5): G942-G947.
[16]Yoshise Y, Ito K,Tsubone H, et al. Functional and molecular characterizations of chloride channels in rat pleural mesothelial cells[J]. Eur J Pharmacol, 2009,614(1-3): 22-29.
[17]苏 静,周 磊,孔晓霞,等.抑制氯通道CLCN2基因表达对顺铂诱导胶质瘤U251细胞损伤的影响[J].中国病理生理杂志,2009, 25(5):859-863.
[18]Isabel C, Maria IN, Leandro Z, et al. Rapid recycling of ClC-2 chloride channels between plasma membrane and endosomes: Role of a tyrosine endocytosis motif in surface retrieval[J]. J Cell Physiol, 2009, 221(3): 650-657.
[19]Nighot PK, Moeser AJ, Ryan KA,et al. ClC-2 is required for rapid restoration of epithelial tight junctions in ischemic-injured murine jejunum[J]. Exp Cell Res, 2009, 315(1): 110-118.
[20]Adam JM, Prashant KN, Kory JE, et al. Recovery of mucosal barrier function in ischemic porcine ileum and colon is stimulated by a novel agonist of the ClC-2 chloride channel, lubiprostone[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 292(2):G647-G656.
AD大鼠模型中tau基因缺失引起轴突变性
Tau病变包括各种以细胞内存在tau蛋白聚合物、有进行性痴呆和锥体外系症状为特征的进行性神经退行性病变,如额颞叶痴呆、FTDP-17、PSP、CBD、Pick's病以及阿尔茨海默病(AD)。Tau病变发病机制的一个中心问题是tau蛋白功能障碍如何导致神经退化。Dawson HN等早前已经证实tau 蛋白的缺失与微管失稳有关,并损伤轴突的外向生长。他们由此推测有功能的tau蛋白缺失可能使中枢神经系统更易于发生例如突变的β-淀粉样前体蛋白(β-APP)的过度表达以及外伤性脑损伤等的继发性损伤。为此,他们将敲除tau基因的小鼠与过度表达突变人类APP(APP670,671,Asw)的小鼠杂交,建立了一个新的小鼠模型Asw/mTau-/-,用以证实tau基因的缺失可引起神经退行性病变。在tau基因被敲除的小鼠中,APP670,671的过度表达引出轴突球状体的广泛形成。他们注意到,能自身产生tau的小鼠若过度表达APP670,671,其球状体的形成仅仅与Aβ沉积斑块有关,而Asw/mTau-/-小鼠的球状体不仅形成于Aβ沉积斑块周围,还形成于白质束和神经纤维网中,与Aβ沉积斑块相关和营养障碍性神经网轴突球状体形成均为AD的显著特征。因此,tau的缺失可以造成神经退行性病变,过度表达突变的APP动物模型中tau的缺失加重神经元的损伤,应考虑针对tau 病变为靶点的神经退行性疾病的治疗方法。
Neuroscience, 2010, 169(1):516-531(逯 丹)
Effectsofobstructivejaundiceonenterocytechloridionsecretioninrats
CHEN Zhen-yong, DAI Hong-mei, YANG Peng, WANG Yan-gang, HUANG Wen-guang, FENG Xian-song
(DepartmentofGeneralSurgery,UnionHospital,HuazhongUniversityofScienceandTechnology,Wuhan430022,China.E-mail:xhczy@126.com)
AIM: To investigate the effects of obstructive jaundice (OJ) on enterocyte chloridion secretion in rats.METHODSThe OJ model of rats was set up. The rats were divided into OJ1 group and OJ2 group randomly. The animals in OJ1 group were sacrificed by exsanguination 7 days after operation and the rats in OJ2 group were sacrificed 14 days after operation. The Cl-concentration in peripheral blood was detected. The epithelial cells in the terminal ileum mucosas were culturedinvitro. The concentration of intracellular Cl-was detected by fluorospectrophotometry. The Cl-current was measured by whole-cell patch clamp experiments. Western blotting was used to examine the change of voltage-gated Cl-channel 2 protein (ClC-2) and the images were analyzed by image analysis system and statistical software quantitatively.RESULTSThe serum Cl-concentration in OJ1 group and OJ2 group were obviously lower than that in control group [(88.67±4.68) mmol/L and (82.01±6.25) mmol/Lvs(95.57±7.51) mmol/L, bothPlt;0.05]. The intracellular Cl-relative concentrations in OJ1 group and OJ2 group were higher than that in control group (3.14±0.38 and 3.55±0.47vs2.69±0.41,bothPlt;0.05). The Cl-current of normal epithelial cells displayed outward rectification, and transformed negative value into positive value following cell membrane depolarization. The Cl-current was (-15.45±7.56) pA/pF and (5.85±0.81) pA/pF when voltage was -80 mV and 80 mV. The ranges of upgrade of absolute values of average electric current density in OJ groups were lower than those in control group (allPlt;0.05). Western blotting analysis showed that the ClC-2 protein generated a broad band about 90 kD. The average gradations of Western blotting images were lower in OJ groups than that in control group (0.20±0.04 and 0.19±0.06vs0.27±0.06, bothPlt;0.05). However, no difference between the 2 OJ groups was observed (Pgt;0.05).CONCLUSIONThe chloridion secretion of intestinal epithelium is restrained in rats with OJ. The concentration gradient between exterior and interior of epithelial cells is decreased, and the Cl-outward current is reduced. All of above are concerned with downregulation of ClC-2 protein in cell membrane.
Jaundice,obstructive; Enterocytes; Chloride channels
1000-4718(2011)11-2194-05
R364.5
A
10.3969/j.issn.1000-4718.2011.11.030
2011-05-17
2011-08-30
湖北省自然科学基金资助项目(No.2010CDB08005)
△ 通讯作者 Tel:027-85351530;E-mail:xhczy@126.com
