β-酪蛋白单克隆抗体的制备及鉴定
2011-11-05卢士英任洪林李岩松柳增善刘文迪郝亚明
宋 芳,周 玉,卢士英,任洪林,李岩松,柳增善,刘文迪,郝亚明
(人兽共患病研究教育部重点实验室,吉林大学畜牧兽医学院,吉林长春130062)
牛奶具有丰富的营养价值,牛奶中含有多种人类赖以生存的营养素,包括水、蛋白质、脂肪、碳水化合物、矿物质、维生素等,是人类最理想的天然食品。然而近些年来,随着乳制品产量的逐渐上升,乳品掺假现象也时有发生,严重危害消费者健康。牛奶中最重要的营养指标是蛋白质,蛋白质的传统测定方法是凯氏定氮法,该方法只能测出氮的总量而不能确定氮的来源和种类,所以存在一定的缺欠,这使得不法商人将低价含氮物质如尿素、三聚氰胺、硝酸盐、亚硝酸盐、白矾、豆浆等[1]掺入牛奶中,以达到牛奶中蛋白质含量的检测标准。
牛奶中的蛋白质是奶中主要含氮物质,含量为2.8%-3.8%,其中95%是乳蛋白质,牛乳蛋白质中大约80%是酪蛋白,β-酪蛋白在酪蛋白中比例恒定,结构相对稳定[2]。因此,如果能直接检测牛奶中β-酪蛋白的含量,可使得在牛奶中添加含氮类非食品添加剂的行为变得毫无“意义”。
目前,牛奶中β-酪蛋白的检测方法有酪蛋白等电点沉淀法[3]、毛细管电泳法[4]、酶联免疫吸附测定法[5]等,这些方法的缺点是依靠昂贵的仪器设备和专业化的实验操作人员,不便以普及和推广。基于单克隆抗体的ELISA检测方法具有特异性强、操作简单、不需要昂贵的仪器设备和专业化的实验操作人员等优点。本试验制备了β-酪蛋白的单克隆抗体并对其特性进行了鉴定,为牛奶中蛋白质的ELISA检测方法奠定基础。
1 材料和方法
1.1 主要试剂与仪器
牛乳β-酪蛋白(纯度为98%)、弗氏完全佐剂、弗氏不完全佐剂、牛血清白蛋白(BSA)、卵清白蛋白(OVA)、HAT选择性培养基、HEPES和50%PEG购自美国sigma公司;四季清胎牛血清为长春宝泰克生物制品有限公司产品;PRM I-1640培养基购自GIBCO公司;辣根过氧化物酶(HRP)标记山羊抗小鼠IgG为鼎国生物技术有限公司产品;小鼠单抗亚类鉴定试剂盒购自洛阳赛尔维公司;8周龄雌性健康BALB/c小鼠购自吉林省长春市生物制品所,本实验室饲养;小鼠骨髓瘤细胞SP2/0,由本室保存;其他试剂均为分析纯。
BIO-RAD Model680酶联免疫检测仪(USA);二氧化碳培养箱(SANYO);倒置显微镜(Olympus);AKTA purifier100(GE);1mL的A蛋白层析柱(上海悦克生物技术有限公司);离心机(科大中佳公司);移液器(Thermo);96孔酶标板(JET);96孔、24孔、6孔细胞培养板(美国Costar公司)。
1.2 动物免疫
β-酪蛋白的分子量为24000,属于大分子物质,因此可以直接刺激动物机体产生免疫反应。免疫方案如下:本试验采用足垫免疫方法,首次免疫用β-酪蛋白(1μg/mL)与弗氏完全佐剂各200μL乳化后免疫6-8周龄BALB/c小鼠3只,每只注射50μL;一周后第二次免疫,用β-酪蛋白(1μg/mL)与弗氏不完全佐剂各200μL乳化后注射,每只50μL;一周后再进行第三次免疫,剂量与方法同第二次免疫;第三次免疫后一周检测小鼠血清效价,融合前3天用不加佐剂的β-酪蛋白抗原腹腔注射加强免疫,50μg/只。
1.3 血清效价检测
小鼠断尾进行尾尖采血,4℃,3 000 r/min离心5min,取上清。利用间接 ELISA方法检测血清效价,同时设阴性和空白对照,选取血清效价大于8 000的小鼠进行细胞融合。
1.4 细胞融合
选择生长状态良好的SP2/0骨髓瘤细胞与免疫小鼠的脾细胞以1∶5-1∶10混合,1 000 r/min,离心4min,弃上清,用手指轻弹离心管底部,敲散细胞团以使细胞均匀松散,40℃水浴1 min,左手缓慢转动离心管,右手用移液器沿转动的管壁缓缓加入1 mL 37℃预热的50%的PEG1000,加入PEG后再水浴30 s,然后立即加入PRM I-1640培养基,1 min内加入3 mL,最后加到50 mL,800 r/min离心4 min后弃上清,加入含20%血清的1640培养液少许,把细胞吹起倒入盛有50mL 20%血清1640培养液的平皿中,再向其中加入37℃预热的HAT 1mL,混匀后铺于事先铺有饲养层的4块96孔细胞培养板,每孔120 μL。最后将细胞培养板用酒精棉擦净,放入37℃,5%的CO2培养箱中培养。
1.5 阳性杂交瘤细胞的筛选与亚克隆
融合5-6天后观察融合效果并换液,待细胞长到细胞培养孔体积的1/10时,用间接ELISA方法检测杂交瘤细胞上清液,选择阳性值高且细胞堆数目少的孔通过有限稀释法进行亚克隆,每次克隆使每个孔内的细胞数目理论值为1-2个,经过3-4次亚克隆后,杂交瘤阳性达100%,即可获得能够稳定分泌β-酪蛋白抗体的细胞株,将此细胞株扩大培养后一部分用于下面的单克隆抗体的生产,一部分放入液氮罐内冻存。
1.6 单克隆抗体的生产
采用小鼠体内诱生腹水的方法生产单克隆抗体,7只8-10周龄雌性Bablc小鼠,先腹腔注射无菌石蜡油,每只0.5 mL,一周后向腹腔内注入杂交瘤细胞,每只小鼠大约注射106个细胞,8-10天后即开始采集腹水。
1.7 单克隆抗体的亚类鉴定
利用小鼠单抗亚类鉴定试剂盒鉴定单克隆抗体的亚类类型,方法按试剂盒说明书进行。
1.8 单克隆抗体的纯化
应用Protein A亲和层析法纯化单克隆抗体,利用AKTA explorerl00进行监测。首先取腹水,在4℃,12 000 r/min条件下离心30 min,以除去较大的凝块,再用0.22μm的滤器过滤;用磷酸盐缓冲液pH7.0(A液)流洗平衡柱子,流速为1 mL/min;取预处理过的腹水10mL,每次上样700-800μL,流速为1mL/min;用上样缓冲液进行流洗,10倍柱床体积,流速为1mL/min;随后用0.02M,Ph4.0的柠檬酸缓冲液(B液)洗脱抗体,同时应用AKTA exp Iorerl00进行监测,并用干净的玻璃管收集,玻璃管内事先加入计算好的1M pH 9.0的Tris—Hcl缓冲液使pH值至7.0,以防洗脱下来的蛋白变性;当洗脱峰回到基线后,继续用上样缓冲液平衡5-10倍柱床体积,流速仍为1 mL/min。
1.9 腹水效价的测定
用1μg/mL的β-酪蛋白包被 ELISA酶标板,用ELISA方法检测未纯化及纯化腹水的抗体效价。以阳性值与阴性值的比值大于2.0的最大抗体稀释倍数定为抗体效价。
1.10 单抗亲和力的测定
采用非竞争性间接ELISA方法来测定抗体亲和力 ,抗原β-酪蛋白的包被浓度分别为 3、2、1.5、1、0.5、0.25、0μg/mL,100μL/孔 ,4℃过夜 ,每孔加入 100 μL 0.1M NH4Cl封闭液,将单抗从4 000倍开始倍比稀释,在同一个坐标系内,以抗体浓度(mol/L)的对数值为横坐标,以其相对应的吸光度值为纵坐标,做出反应曲线,找出各条曲线的ODmax和50%ODmax所对应的抗体浓度。根据公式计算出该株单抗的亲和常数[6]。
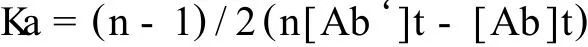
注:n为每组中两个包被浓度的倍数,[Ab‘]t和[Ab]t分别为每组中两个50%ODmax所对应的抗体浓度。
2 结果
2.1 阳性杂交瘤的筛选与克隆
融合5-6天后计算融合率,本次试验融合率为71.9%。利用间接ELISA和有限稀释法筛选阳性杂交瘤细胞,经过3-4次亚克隆后,获得了一株能够稳定分泌β-酪蛋白单克隆抗体的细胞株,将其命名为4H1。
2.2 单抗亚类鉴定
经小鼠单抗亚类鉴定试剂盒鉴定,杂交瘤细胞株4H1分泌的抗体亚类为IgG2a。
2.3 蛋白A层析柱纯化腹水
利用Protein A亲和层析法纯化腹水,利用AKTA explorerl00进行监测,结果显示杂蛋白峰值很高,只有一个目的蛋白峰,目的蛋白与杂蛋白得到很好的分离,结果如图2.1所示。
2.4 腹水纯化的SDS-PAGE鉴定
经SDS-PAGE电泳后结果如图2.2所示,20倍稀释的未纯化腹水SDS-PAGE结果为多条带,同样倍数稀释的纯化后的腹水IgG2a只有两条带,分别为IgG2a的重链(50 KD)和轻链(26 KD),证明蛋白A层析柱纯化效果较好。
2.5 单抗亲和力的测定
经A蛋白层析柱纯化后的腹水效价为2.56×106,采用非竞争间接ELISA方法测定单克隆抗体的亲和力,其亲和常数为5.29×108mol/L,结果如图2.3。
3 讨论
3.1 免疫方法
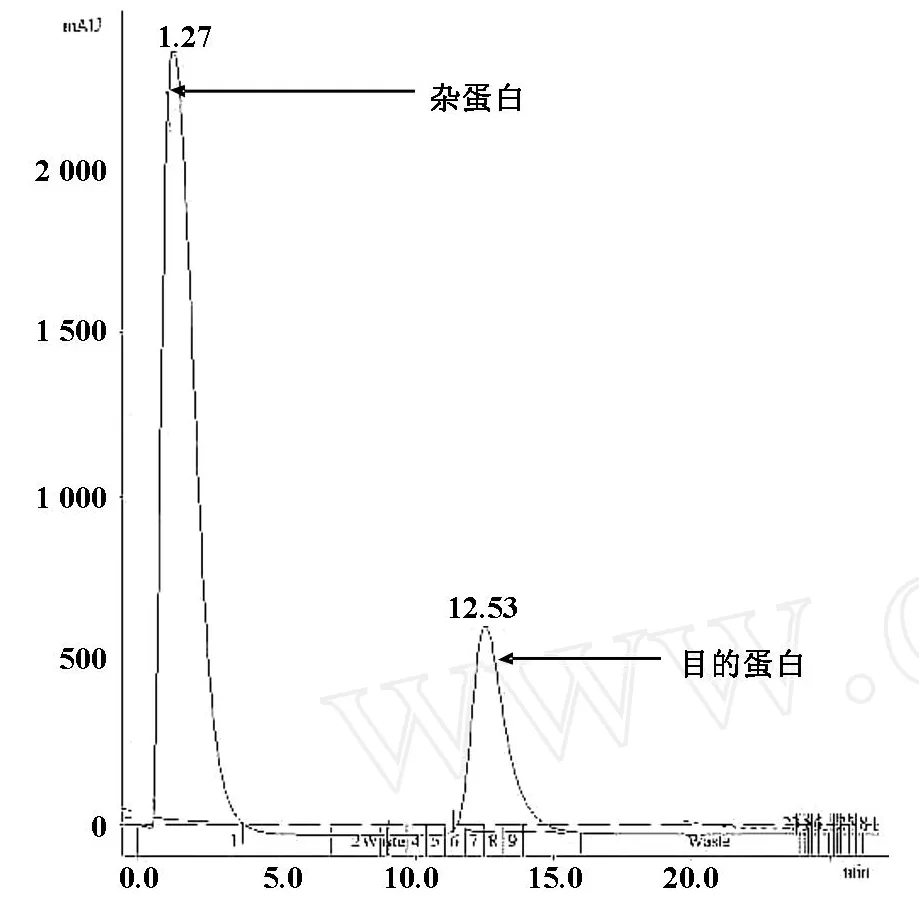
图2.1 腹水纯化的蛋白A层析图
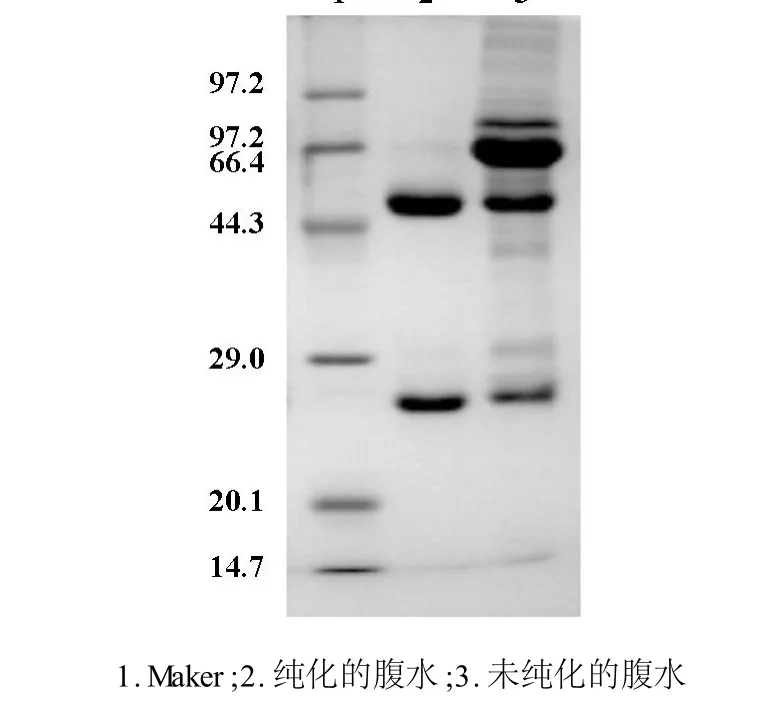
图2.2 腹水纯化SDS-PAGE图
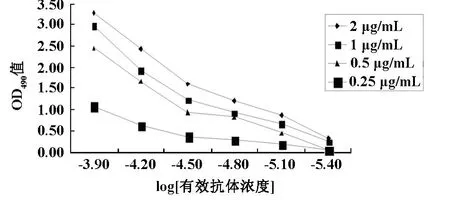
图2.3 单抗亲和力
生产单克隆抗体的常规免疫方法是腹腔注射免疫原,免疫剂量为每只小鼠100μg,每隔2周免疫一次,经2-3次免疫后取小鼠脾细胞与骨髓瘤细胞融合,常规免疫方法的缺点是免疫剂量大、免疫周期长。本试验采用足垫免疫,免疫剂量为每只小鼠50 μg,免疫间隔为1周,与常规免疫相比足垫免疫有两个优势[7]:一是免疫剂量小,尤其是对价格昂贵的免疫原来说这一优势更加明显;二是免疫周期短,缩短了β-casein单克隆抗体的生产周期。
3.2 影响细胞融合的关键因素
影响细胞融合的因素有很多,但最关键的因素是SP2/0骨髓瘤细胞的状态、PEG的作用时间与PEG分子量的大小。首先,要选择生长状态良好且处于对数生长期的SP2/0骨髓瘤细胞;其次,PEG的作用时间不要超过2分钟,并且PEG的分子量不要太大,一般为 PEG1000-1500,PEG分子量越大,对细胞的毒害作用越大。而且尽量缩短PEG的作用时间也是为了减小PEG对细胞的毒害作用。此外,融合时的水浴温度一般为38-39℃,离心机的转速为800-1 000 r/min,这些都是影响此本次试验融合率(71.9%)的因素。
3.3 单克隆抗体的纯化
采用杂交瘤技术生产的小鼠单克隆抗体免疫球蛋白的类型有 IgG1、IgG2a、IgG2b、IgG3、IgA和 IgM。一般初次免疫应答主要是诱导产生IgM分子,对抗原的结合力低,为低亲和性抗体,而再次免疫应答后主要产生高亲和性抗体IgG类分子,本试验经过多次免疫后得到高亲和性IgG2a型抗体。目前,单克隆抗体的纯化方法有很多,如辛酸—硫酸铵法[8]、离子交换层析[9]、亲和层析[10]、疏水层析、凝胶过滤法及高压液相层析法等。本试验采用A蛋白层析柱纯化单克隆抗体,纯化后单抗腹水抗体效价达2.56×106,纯化效果较好。
[1]吴茹怡.牛奶掺假物检验方法研究[J].大众科技,2005,83(9):91.
[2]SteǜPhanie Muller-Renaud,Didier Dupont,Philippe Dulieu,et al.Quantification of○-Casein in Milk and Cheese Using an Optical Immunosensor[J].Food Chemical,2004,52:659.
[3]李宏梁,焦茜楠,黄峻榕,等.酪蛋白沉淀检测方法及其在牛乳经济掺假鉴定中的应用[J].食品科技,2008,33(12):262.
[4]张东送,庞广昌,高法国,等.毛细管电泳在牛乳中酪蛋白含量测定及掺假检测方面的应用[J].食品发酵工业,2005,31(1):130.
[5]卢蓉蓉,孙 震,许时婴,等.乳铁蛋白的免疫化学分析法-酶联免疫吸附测定法[J].食品科学,2002,23(4):102.
[6]李春媛.三聚氰胺单克隆抗体制备及其在ELISA检测中的应用[D].吉林大学,2009,(08).
[7]Yu Zhou,Yuan-Yuan Zhang,Qing-Feng Shen,et al.Development of a novel antibody probe useful for domoic acid detection[J].Biosensors and Bioelectronics,2009,24:3159.
[8]周 玉,李岩松,潘凤光,等.小鼠腹水IgG类单克隆抗体纯化方法的研究[J].黑龙江畜牧兽医,2006,10:14.
[9]G.Corthier,E.Boschetti,J.Charley-Poulain.Improvedmethod for IgGpurification from various animal species by ion exchange chromatography[J].Journalof Immunological Methods,1984,66(1):75.
[10]周华蕾,吕茂民,王 娜,等.应用A蛋白亲和层析法纯化单克隆抗体[J].生物技术通报,2005,5:72.
