黄芪丹参合剂对小鼠CCl4急性肝损伤保护作用的实验研究
2011-06-13刘文艺
刘文艺,吴 鸿
(遵义医学院附属医院肝胆外科,贵州遵义563003)
急性肝损伤是急性肝功能衰竭的基础,严重或持续的肝损伤最终导致肝功能衰竭。引起肝急性损伤的原因很多,主要有病毒感染、用药不当、食物添加剂、乙醇摄入过多及接触、食入有毒食物、放射性损伤等[1]。黄芪丹参复方制剂的主要成分黄芪及其有效成分黄芪皂苷能保护细胞结构特别是线粒体结构,提高细胞内超氧化物歧化酶活性,减轻氧自由基对细胞膜的损伤;丹参可抑制白细胞的趋化性和聚集反应,防止和驱散白细胞在毛细血管内的聚集,因而减少氧自由基的产生;黄芪丹参复方制剂可能通过增加超氧化物歧化酶、谷胱甘肽过氧化物酶活力,减轻氧自由基损伤[2],但其是否具有保护肝细胞的作用尚未确定。本实验旨在用CCl4复制急性肝损伤模型,以观察黄芪丹参合剂的保肝作用。本试验研究黄芪丹参合剂对小鼠CCl4急性肝损伤的保护作用。
1 材料与方法
1.1 材料
1.1.1动物 ICR雄性小鼠48只,清洁级,体重18-22 g,由第四军医大学实验动物中心饲养。
1.1.2药品和试剂 黄芪丹参合剂(由山西太行药业股份有限公司提供,批号Z20090252)、CCl4(由国药集团化学试剂有限公司提供,批号20061114)、橄榄油(由国药集团化学试剂有限公司提供,批号F20040614)、甲醛(由国药集团化学试剂有限公司提供,批号JH20060110)。
1.1.3仪器包括自动生化分析仪、组织包埋机、光学显微镜、组织自动脱水机、摊片机、烘片机、石蜡切片机等。
1.2 方法
1.2.1动物分组 将48只小鼠随机分为正常组、CCl4模型组、黄芪丹参合剂低剂量组、黄芪丹参合剂高剂量组,每组12只。
1.2.2给药方法 设定温度为20-22℃,湿度为48-50%,置于实验室4 d后进行试验。自试验之日起各黄芪丹参合剂组小鼠每天给与相应的中药灌胃1次,灌胃量0.25 ml/10 g体重,给药量见表 1。除黄芪丹参合剂高剂量组给药量相当于成人常用量的70倍,而低剂量组相当常用量30倍。正常组和CCl4模型组给予等量蒸馏水,同样每天灌胃1次,连续灌胃6 d后检测指标。
1.2.3小鼠造模 最后一次给药完毕1 h后,给予正常组腹腔注射生理盐水(10 ml/kg体重),其它三组小鼠均给予一次性腹腔注射CCl4(0.125%溶液,10 ml/kg体重)完成急性肝损伤小鼠造模[4]。
1.2.4肝组织取样 造模成功1 d后称小鼠体重,摘去眼球取血以自动生化分析仪作肝功能检测,使用脊柱脱臼法处死,迅速称取肝脏重量,计算肝指数(公式肝指数=肝脏重量/小鼠体重),留取肝组织样本作病理学观察。
1.2.5肝脏病理学观察 留取相同部位约5 mm×5 mm×3 mm的肝组织,厚4 μ m,使用10%中性福尔马林固定,逐级进行酒精脱水,最后石蜡包埋,作常规H-E染色,在光镜下观察肝脏样品组织结构、肝细胞变性坏死和炎症细胞浸润等病理变化。
1.2.6数据分析方法 计量资料以s表示,用统计分析软件SPSS14.0中的ANOVA程序进行单因素方差分析,P<0.05提示差异有统计学意义。
2 结果与分析
2.1 各组肝指数比较[3,4]
由表1可见,模型组与正常组比较,差异无统计学意义(P>0.05);黄芪丹参合剂组与模型组比较,肝指数之间差异亦无统计学意义。
表1 黄芪丹参合剂对小鼠肝指数的影响(s)

表1 黄芪丹参合剂对小鼠肝指数的影响(s)
组别 n 各组因灌胃死亡数(只)给药量(g/kg.b.w)相当于生药量(g/kg.b.w)肝指数正常组 7 5 - - 0.0491±0.00687模型组 7 5 - - 0.0489±0.00390低剂量组 7 5 1.33 10.50 0.0454±0.00509高剂量组 9 3 3.10 24.50 0.0497±0.00499
2.2 血清 TBiL、ALT、AST含量变化
由表2可见,模型组与正常组比较,差异无统计学意义(P>0.05),各给药组与模型组比较,所检测的指标值差异亦无统计学意义(P>0.05)。
表2 黄芪丹参合剂对小鼠 CCl4急性肝损伤的TBiL、ALT、AST含量的影响(s)

表2 黄芪丹参合剂对小鼠 CCl4急性肝损伤的TBiL、ALT、AST含量的影响(s)
组别 n TBiL(mmol/L)ALT(IU/L)AST(IU/L)正常组 7 9.20±1.62 43.00±8.28 103.60±7.44模型组 7 7.72±2.03 52.00±14.78 138.50±40.55低剂量组 7 8.04±1.30 133.80±81.34 140.20±10.76高剂量组 9 8.68±0.73 45.00±21.86 157.40±63.44
2.3 各组肝脏样品的病理改变
2.3.1正常组肝脏病理 小鼠的肝脏结构正常,肝索排列规则,总体观察,肝细胞形态无改变。
2.3.2模型组肝脏病理 小鼠的肝脏结构紊乱,小叶间界限不清,肝细胞有较广泛的胞浆疏松,部分呈小泡状脂肪变性;肝窦扩张,库普佛细胞增生。
2.3.3黄芪丹参合剂组肝脏病理 小鼠肝脏结构改变较轻,变性肝细胞的程度和范围也略低,肝窦有不同程度的扩张,其中黄芪丹参合剂高剂量组小鼠的肝窦充血较明显,详见图1。
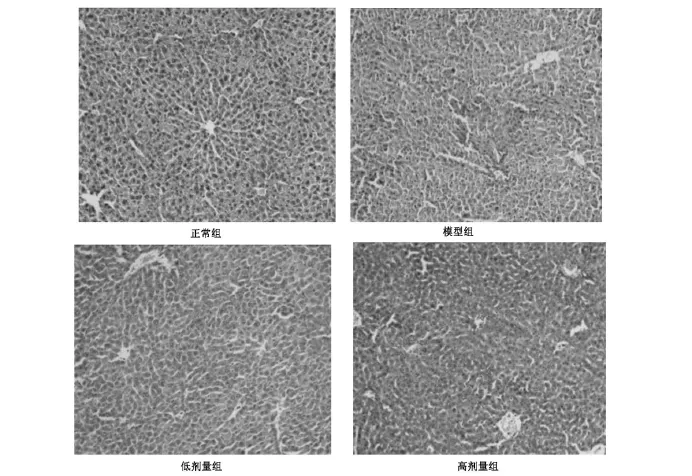
图1 小鼠的肝脏病理改变(HE,×200)
3 讨论
肝细胞损伤的机制非常复杂,可因各种有害因子物质,例如病毒、药物、乙醇、缺氧、免疫等作用于肝细胞,继而产生一系列介质最终造成肝细胞损伤。肝细胞损伤大致可分为化学性和免疫性肝损伤,两者也可相互作用。肝细胞损伤的化学机制主要通过细胞色素P450(CYP)及结合反映产生的中间代谢引起的,如细胞膜完整性发生改变、线立体功能失调、细胞内离子浓度变化以及自由基核降解酶的作用[5,6]。肝细胞损伤的免疫机制通过细胞因子、NO、补体及变态反应等引起损伤,病理性细胞凋亡也属于免疫损伤机制之一。黄芪丹参复方制剂可能通过增加超氧化物歧化酶、谷胱甘肽过氧化物酶活力,减轻氧自由基损伤。本研究结果显示,其对小鼠CCl4急性肝损伤的保护作用不确切。
[1]中华医学会消化病学分会肝胆疾病协作组.急性药物性肝损伤诊治建议(草案)[J].中华消化杂志,2007(11):112.
[2]Huang YS Genetic polymorphisms of drug-metabolizing enzymes and the susceptibility to antituberculosis drug-induced liver injury 2007(01):34-35.
[3]王宝恩,张定凤主编.现代肝脏病学[M].北京:科学出版社,2003.
[4]Xinhui Tang,Jing Gao,Yanping Wang.Effective protection of Terminalia catappa L.leaves from damage-induced by carbon tetrachloride in liver mitochondria[J].Journal of Nutritional Biochemistry,2006,17(3):177.
[5]汤新慧,高 静.实验性肝损伤的损伤机制[J].中西医结合肝病杂志,2002,12(1):53.
[6]Xin Hui Tang,Jing Gao,Feng Fang.Hepatoprotection of oleanolic acid is related to its inhibition onmitochondrial permeability transition[J].American Journal of Chin Med,2005,33(4):627.
