应用常规MRI和ADC值鉴别中青年脑内多发急性、亚急性缺血梗死与急性脱髓鞘斑块
2011-06-13李郁欣鲍奕舫耿道颖
李郁欣,鲍奕舫,张 军,耿道颖
(复旦大学附属华山医院放射科,上海200040)
颅内多发病灶的诊断与鉴别诊断是临床工作中经常遇到的难题之一。尤其是急性或亚急性起病的中青年患者,以脑缺血性梗死和炎性脱髓鞘两种疾病最为常见。由于部分患者临床表现缺乏特异性,影像上均可表现为颅内多发病灶,急性期弥散加权成像(DWI)均为高信号,无论对于神经科医生还是影像科医生,其鉴别诊断都是十分棘手的问题。然而,首诊时如能做到正确诊断,对于患者的治疗和预后都会起到至关重要的作用。因此,本研究通过回顾性分析已确诊的缺血性梗死与脱髓鞘患者的脑内多发病灶在常规MRI上的表现特点,以及量化分析病灶内及病灶周围表现正常脑白质的表观弥散系数(ADC)值,力图发现两者之间的鉴别诊断要点。
1 材料与方法
1.1病例资料搜集我院住院治疗的缺血性梗死患者15例,男性11例,女性4例。入组标准如下:①年龄≤50岁;②MRI扫描时间距发病时间≤10天;③颅内病灶≥2个,且排除如出血等其他性质的病灶。急性脱髓鞘组患者12例,符合 2005“McDonald”[1]诊断标准的多发性硬化患者10例,男性5例,女性5例。入组标准:①年龄≤50岁;②有再发的新症状出现,MRI增强扫描出现强化病灶;③排除脑血管疾病和颅内其他病灶。此外还包括视神经脊髓炎颅内脱髓鞘病例1例(女性,26岁)和经活检证实的颅内脱髓鞘病例1例(男性,45岁)。
1.2MRI扫描所有扫描均使用GE Signa 3.0T磁共振成像系统,8通道头颅线圈。常规MRI包括:矢状位T1WI-FLAIR和轴位的T1WI-FLAIR(TR/TI/TE=2 025/860/15 ms)、T2WI(TR/TE=3 600/115 ms)、T2WI-FLAIR(TR/TI/TE=8 500/2 250/120 ms)扫描。扫描范围从颅顶至枕骨大孔,层厚6 mm,间隔2 mm。DWI使用单次激发的自旋回波的平面回波序列(spin echo echo-planar imaging,SE-EPI),TR=4 800 ms,TE=74 ms,FOV=24 cm,矩阵128×128,NEX=1,复制常规MRI扫描轴位扫描层面。b值分别为0和1000 s/mm2。平扫完成后全部行静脉注射钆喷酸葡胺(GD-DTPA)的T1WI增强扫描。
1.3ADC值测量和统计分析DWI的原始数据导入GE functool4的diffusion软件进行后处理,在校正变形,选定阈值后计算获得EPI序列的T2WI、DWI、ADC图。缺血梗死组病例选取DWI高信号区域,急性脱髓鞘组选取增强后明显强化的区域测量。感兴趣区(ROI)大小>30 mm2,以保证测量的准确性和避免部分容积效应的影响。同时对距病灶10-15 mm的周围正常表现脑白质(NAWM)选取ROI进行测量。ADC值单位为 mm2/s。统计分析采用PASW statistics18,非配对t检验,比较两组之间是否存在差异,P≤0.001具有统计学意义。
2 结果
2.1急性或亚急性缺血梗死组患者15例,年龄21-48岁,男性11例,女性4例。经过CTA或DSA以及临床实验室检查确诊的脑血管发育畸形5例,动脉粥样硬化4例(3例大脑中动脉狭窄,1例颈内动脉狭窄),血管炎4例,颈动脉夹层1例,心房粘液瘤脑栓塞1例(图1)。常规MRI表现为颅内多发病灶,病灶分布以基底节、侧脑室旁及皮层为主,其次为分水岭区。1例颈动脉夹层的病例病灶位于前中循环和中后循环的分水岭区;1例脑栓塞的病灶主要分布于脑干、延髓和双侧小脑半球,以后循环受累为主。小病灶主要呈斑片状,大病灶形态不规则,皮层受累为主的病灶呈楔形。80%患者(12/15例)的病灶位于单侧或以单侧为主。病灶呈 T1WI等低信号,T2WI高信号,陈旧性病灶FLAIR及DWI低信号或等信号,急性期病灶DWI均呈高信号。
2.2急性脱髓鞘组患者12例,年龄17-45岁,男性6例,女性6例。病灶分布以两侧侧脑室旁,额叶、顶叶及枕叶白质为主,其次为胼胝体,脑干和小脑,亦见累及基底节,丘脑及皮层。双侧均可见病灶。病灶新旧不一,急性期病灶呈圆形或卵圆形,T1WI低信号,T2WI高信号,周围可见水肿呈晕环样改变,增强后主要呈结节状、环形、弧线样及条片状强化。DWI呈结节状高信号或环形高信号(图2)。
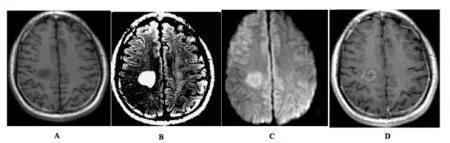
图2 患者男性45岁,右侧额叶圆形病灶,T1WI低信号(A),FLAIR高信号(B),DWI高信号(C),增强后病灶呈环形强化,壁较厚(D)。该病灶经活检后证实为炎性脱髓鞘。
2.3ADC值量化分析急性或亚急性缺血梗死灶22个,急性脱髓鞘病灶25个。两组ADC值具有明显统计学差异(P<0.001),前者(6.08×10-4mm2/s±1.49)明显低于后者(9.68×10-4mm2/s±2.27)。梗死灶周围正常表现脑白质的ADC值(7.75×10-4mm2/s±0.55)与脱髓鞘组周围正常表现脑白质(7.92×10-4mm2/s±1.03)无明显差异(P=0.48)。(图3)
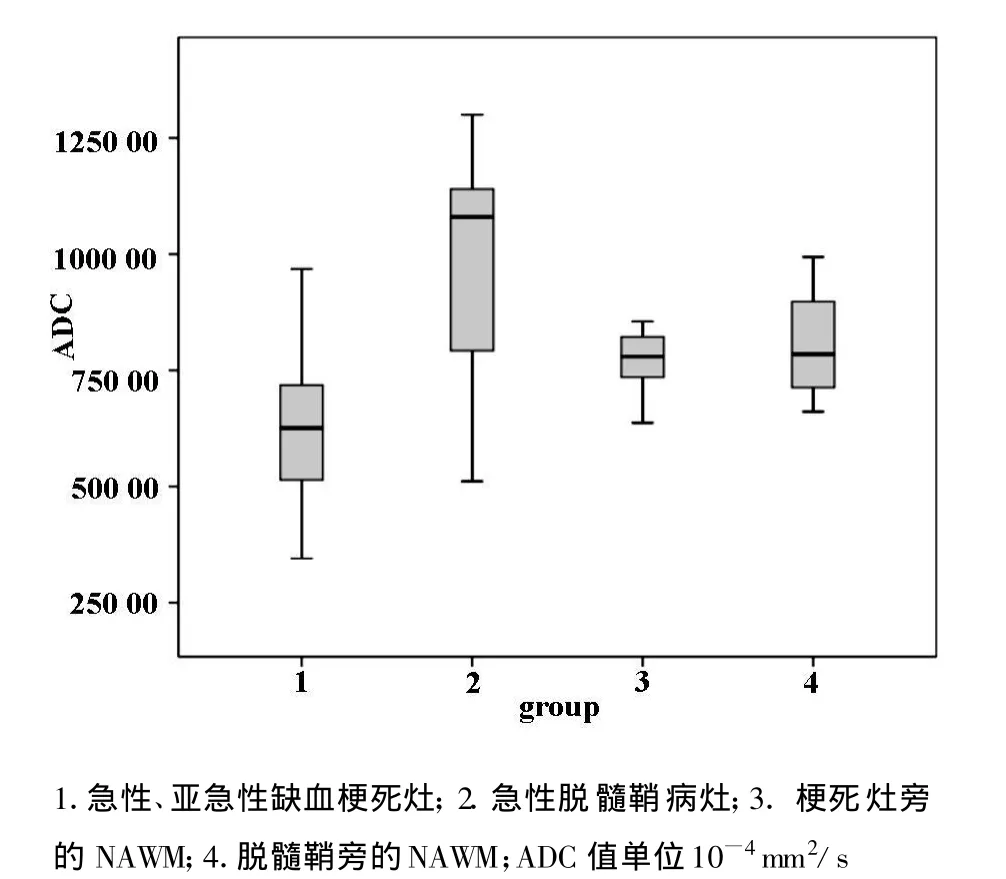
图3 急性、亚急性缺血梗死和急性脱髓鞘病灶及病灶周围NAWM的ADC值箱式图
3 讨论
缺血性梗死常好发于中老年人,然而在中青年人群中也并非少见。主要病因以脑血管畸形、血管炎、有高危因素如糖尿病或高血压等导致的动脉粥样硬化为主。本研究搜集的15例病例中大部分(13/15例)为以上三种原因致病。脑梗塞如果为单发病灶且DWI呈高信号时容易做出诊断,但是当出现多发病灶,病灶新旧不一时则容易与炎性脱髓鞘性疾病混淆。后者好发于中青年人,以多发性硬化最为常见。而对于首次发病,或是以脑卒中样发作的病例[2]则需要与缺血性梗死进行鉴别。
颅内动脉粥样硬化所致的缺血性梗死病灶位于责任血管的供血区,由于大脑中动脉供血的脑梗死约占全部脑梗死的75%,大部分病灶分布于该区的额叶、顶叶、颞叶前部及基底节,MRI常表现为斑片状,典型表现为底位于脑表面、尖指向脑室的楔形区。先天性血管发育不良以烟雾病最常见,病变主要累及双侧颈内动脉的虹吸部和大脑前、中动脉的近端,导致管腔进行性狭窄或闭塞,故缺血性梗死主要位于大脑前、中动脉供血区。中枢神经系统血管炎包括原发性和继发性两种,后者主要见于自身免疫性疾病如系统性红斑狼疮、白塞氏病和干燥综合征等。主要累及颅内中小动脉,血管壁出现纤维素样坏死、淋巴细胞及单核细胞浸润,导致管腔狭窄。MRI可见病灶主要位于皮层或深部核团,且多发。颈动脉夹层为血液从内膜撕裂处进入疏松的中膜,管腔发生狭窄或闭塞,脑组织处于低灌注状态,因此缺血性梗塞常发生在末梢血管供血且侧支循环代偿不足的分水岭区。本文搜集的中青年缺血性梗死患者15例,其中12例病变位于单侧或以单侧为主,说明缺血性梗死的部位与供血动脉有关。脱髓鞘性病变中最常见的为多发性硬化,病灶好发部位以双侧侧脑室旁白质为主,其次为胼胝体,亦可累及灰质[3]。形态呈圆形或椭圆形,边界清晰,典型者病灶的长轴与侧脑室长轴相垂直。因此,仔细观察与分析常规MRI上病灶的分布特点和形态,可以作为缺血性梗死与脱髓鞘病灶的鉴别诊断要点之一。
急性或亚急性缺血性梗死和急性脱髓鞘病灶在DWI均呈高信号,因此有必要通过量化分析ADC值的差异来进行鉴别。本研究发现急性或亚急性缺血梗死组ADC值明显低于急性脱髓鞘组,与文献报道一致[4,5]。急性梗死DWI高信号的病理基础为细胞毒性水肿,水在细胞内弥散远慢于细胞外间隙的水的弥散,故ADC值降低。亚急性期梗死除细胞毒性水肿外,还存在血管源性水肿、神经细胞坏死等因素导致细胞外间隙扩大,ADC开始升高,但此时由于T2的透过效应DWI仍呈高信号。本研究发现脱髓鞘病灶的ADC值明显升高,其病理基础为病灶内出现髓鞘脱失和轴索损伤,导致细胞外间隙扩大,水分子弥散增加。组织病理学和MRI的对照研究[8]发现,髓鞘密度和轴索数目与ADC值呈明显的负相关。有研究[7]发现急性期病灶的平均ADC值明显低于慢性期病灶,可见慢性期病灶内髓鞘丢失和轴索损伤更明显。而急性期病灶病理更为复杂,包括髓鞘脱失、轴索损伤、炎症反应、水肿等。目前文献报道的急性期脱髓鞘病灶ADC值均见升高[8-10],与本文结果一致。具体数据如表1所示。因此我们认为ADC值是鉴别急性或亚急性缺血梗死与急性脱髓鞘病变的有力手段。

表1 本文与文献报道的急性缺血梗死和急性脱髓鞘病灶的ADC值mean(sd)对比。 (单位×10-4mm2/s)
本研究对缺血梗死及脱髓鞘周围正常表现脑白质(NAWM)的ADC值进行测量后发现,后者较前者略高,但两者之间并无统计学差异。缺血后周围脑组织由于Wallerian变性,导致细胞外间隙扩大,ADC值升高。脱髓鞘病灶周围的脑白质ADC值升高,主要是由于弥漫的胶质细胞增生、血管周围的细胞浸润、髓鞘异常变薄、轴索缺失和斑片样水肿,导致了水分子运动的结构屏障出现弥漫性的损伤。有学者[8]应用磁共振灌注成像(PWI)发现缺血梗死周围NAWM的平均通过时间(MTT)较急性脱髓鞘病灶的延长,如果联合病灶区ADC和MTT值分析,可以提高鉴别诊断的可靠性。本研究并未发现两者NAWM的ADC值差异,可能与选取感兴趣距病灶的距离有关,或者与病变的时间及病理改变不同有关,今后仍需要大样本研究和随访观察。
总之,通过分析常规MRI上病灶的分布及形态特点,联合ADC值综合判断,可以成为鉴别急性或亚急性缺血性梗死和急性脱髓鞘病灶的有效方法。
[1]Polman CH,Reingold SC,Edan G,et al.Diagnostic criteria for multiple sclerosis:2005 Revisions to the“McDonald Criteria”[J].ANNALS OF NEUROLOGY,2005,58(6):840.
[2]张冠群,崔 晓,刘 君,等.脑卒中样多发性硬化38例临床特点及诊治[J].中国老年学杂志,2010,30(23):3571.
[3]李郁欣,初曙光,李振新,等.多发性硬化患者脑灰质损害的MRI表现及扩散张量成像定量研究[J].中华放射学杂志,2008,42(7):709.
[4]Schlaug G,Benfield A,Baird A,et al.The ischemic enumbra:Operationally defined by diffusion and perfusion MRI[J].Neurology,1999,53:1528.
[5]Rovaris M,Gass A,Bammer R,et al.Diffusion MRI in multiple sclerosis[J].Neurology,2005,65:1526.
[6]Schmierer K,Wheeler-Kingshott CA,Boulby PA.Diffusion tensor imaging of post mortem multiple sclerosis brain[J].Neuroimage,2007,35(2):467.
[7]李郁欣,初曙光,李振新,等.多发性硬化脑内病灶的扩散张量成像[J].国际医学放射学杂志,2008,31(3):145.
[8]Zivadinov R,Bergsland N,Stosic M,et al.Use of perfusion-and diffusionweighted imaging in differential diagnosis of acute and chronic ischemic stroke and multiple sclerosis[J].Neurological Research,2008,30(8):816.
[9]Tallantyre EC,Dixon JE,Donaldson I,et al.7 Tesla MR Imaging Marker distinguishes between MS and Ischemic Brain Lesions[J].Neurology,2010,74(9):A288.
[10]韩鸿宾,王 俭,谢敬霞,等.高扩散敏感系数扩散加权像异常高信号疾病的鉴别诊断[J].中华放射学杂志,2002,36(9):812-816.
