固相转染HPV16-siRNA对荷宫颈癌细胞SiHa小鼠瘤体体积及P53、P16表达的影响*
2011-10-24廖百花冯亦军曾禄贤肖小敏
廖百花, 冯亦军, 曾禄贤, 肖小敏
(1 广东省第二人民医院妇科, 广东 广州 510317;2暨南大学第一临床学院妇产科, 广东 广州510633)
固相转染HPV16-siRNA对荷宫颈癌细胞SiHa小鼠瘤体体积及P53、P16表达的影响*
廖百花1, 冯亦军1, 曾禄贤1, 肖小敏2△
(1广东省第二人民医院妇科, 广东 广州 510317;2暨南大学第一临床学院妇产科, 广东 广州510633)
目的观察靶向基因治疗后不同时点荷宫颈癌细胞小鼠HPV16-DNA、瘤体体积、P53及P16蛋白的变化,探讨在体固相转染HPV16-siRNA的有效性。方法采用 SiHa细胞皮下注射建立荷宫颈癌细胞SCID小鼠模型。制备HPV16靶向siRNA-Lipo2000-卡波姆凝胶。将40只荷宫颈癌细胞SCID小鼠随机分为对照组8只和研究组32只和研究组使用HPV16靶向siRNA-Lipo2000-卡波姆凝胶进行基因治疗,对照组仅使用Lipo2000-卡波姆凝胶处理;分别于治疗后4 d、8 d、12 d、16 d处死小鼠,每个时点研究组处死8只、对照组处死2只。PCR检测两组小鼠瘤体中HPV16-DNA滴度,测各时点的瘤体体积,常规病理切片检测肿瘤细胞形态,免疫组化检测P16及P53的表达。结果(1)研究组治疗后8 d及12 d时点瘤体内HPV16-DNA明显降低,与对照组之间的差异显著(P<0.05),4 d及16 d 2个时点与对照组之间的差异不显著(P>0.05);(2)治疗后12 d瘤体平均体积明显缩小,与对照组之间的差异显著(P<0.05);(3)转染后12 d肿瘤细胞核异质性较对照组减轻,核浆比例减小;(4)P16的表达强度在各时点研究组与对照组之间的差异不显著(P>0.05);治疗后8 d及12 d研究组P53 的表达强度明显降低,与对照组之间的差异显著(P<0.05)。结论SCID小鼠所荷宫颈癌细胞瘤体经靶向转染HPV16-siRNA后8 d及12 d时点瘤体内HPV16-DNA和P53均较对照组明显下降,12 d瘤体体积较对照组明显下降;在体固相转染siRNA可以在一定时段内有效抑制HPV-DNA的复制及肿瘤的生长速度。
宫颈肿瘤; RNA干扰; 人乳头状瘤病毒; P53蛋白; P16蛋白
人乳头状瘤病毒(human papilloma virus,HPV)感染与宫颈癌关系密切,但无有效临床治疗方法;近年来的研究发现,RNA干扰(RNA interference,RNAi)能有效抑制HPV复制[1-3],为宫颈持续性HPV感染的治疗提供了新的策略及理论依据。但目前众多的研究均是在液相条件下对离体细胞进行转染实验,在体细胞进行固相siRNA转染的研究目前鲜见报道。前期我们设计了一种含HPV16 靶向siRNA的局部外用药,并证实可以经固相途径转染siRNA进入宫颈上皮;利用该法对荷宫颈癌SCID小鼠瘤体进行基因治疗,发现转染后7 d治疗组小鼠瘤体组织中HPV 16-DNA的滴度较对照组明显降低[4]。由于宫颈HPV感染动物模型目前尚未建立,同类研究多采用HPV阳性肿瘤细胞(如SiHa细胞)对SCID小鼠皮下注射建立荷宫颈癌模型进行[5,6];本研究继续利用荷宫颈癌细胞小鼠模型进行固相转染基因治疗,检测治疗后不同时点(转染后4 d、8 d、12 d、16 d)HPV16-DNA,结合宫颈癌瘤体体积、病理以及P16、P53的表达等情况,进一步探讨在体细胞固相转染siRNA的有效性。
P16是近年来发现的多种肿瘤抑制基因,参与细胞周期的调控,控制细胞的生长与分化,直接参与肿瘤的形成与进展。有研究[7]探讨了CIN及子宫颈癌中P16表达及其意义,结果显示:P16阳性表达率从子宫颈正常组、CIN I组、CIN II组、CINⅢ组呈上升趋势,与子宫颈正常组比较,P16的阳性表达率差异均显著(P<0.01),提示P16的高表达是子宫颈正常组织向CIN、宫颈癌发生过程中的早期事件,研究者认为P16蛋白表达异常可作为临床评价肿瘤生物学行为及判断预后的辅助指标。P53基因是重要的抑癌基因,作为转录因子,通过阻止细胞复制和发动细胞凋亡保持基因组的稳定性,维持细胞正常生长,抑制细胞恶性增殖,对生长起负调节作用。若该基因由于突变、丢失或重排而失活,细胞可能发生恶性转变;它的失活表现为突变型P53的过度表达。突变型P53蛋白不仅失去了正常的抑癌作用,而且具有促进正常细胞恶性转化的作用[8,9]。所以,我们把P16及P53蛋白作为本次研究的检测指标之一。
材 料 和 方 法
1材料
1.1siRNA的设计及标记 siRNA由广州锐博生物科技有限公司设计并合成(针对HPV16,设计长度为21nt),正义链5′-GAGGTATATGACTITGCTTdTdT-3′,反义链3′-AAGCAAAGTCATATACCTCdTdT-5′,批号为siL09330161940, 20 nmol/瓶, MV: 13797.91,-20 ℃密封保存。
1.2材料 LipofectamineTM2000, Invitrogen产品(批号为534294;规格:1.5 mL/支,1 g/L;-20 ℃保存)。 三乙醇胺:天津市富宇精细化工有限公司(批号为 090407);卡波姆940为Mbchem产品(批号为 20080228)。 SiHa细胞由南方医科大学妇产科教研室尹倩硕士馈赠。SCID纯系小鼠40只,购自中山大学动物实验中心,4-6周龄,雌性,按普通级清洁饲养(合格证号为2008A153)。单克隆小鼠抗人P16/P53蛋白Ⅰ抗、Ⅱ抗试剂均购自Dako。
2方法
2.1建立荷宫颈癌裸鼠模型[10]SiHa细胞于RPMI-1640全培养基中培养, 其中含胎牛血清浓度为10%,青霉素1×105U/L, 链霉素100 mg/L,在恒温培养箱中以5% CO2、37 ℃及饱和湿度条件下培养4-5 d,胰酶消化,用PBS重悬细胞并调细胞密度为5×1010cells/L,于SCID小鼠侧肋部接种,接种量为0.1 mL,饲养21 d,制作宫颈癌裸鼠模型。成瘤期平均 18 d,成瘤率100%。
2.2药物配制 第1步:取6 μL LipofectamineTM2000加注射双蒸水稀释至100 μL。第2步: HPV16-siRNA加双蒸水1 mL稀释,稀释后取50 μL HPV16-siRNA溶液加50 μL LipofectamineTM2000的溶液配成HPV16-siRNA-LipofectamineTM2000混合液。第3步: HPV16-siRNA-LipofectamineTM2000-卡波姆凝胶剂配制:取卡波姆940凝胶1 g,甘油10 g,置于研钵中研匀,并加适量蒸馏水,慢慢滴加三乙醇胺,边加边搅,使成凝胶, 加蒸馏水至20 g,刚好形成凝胶。取0.5 g凝胶,加人 10 μL HPV16-siRNA-脂质体适量搅匀,配制成HPV16-siRNA-LipofectamineTM2000-卡波姆凝胶剂(每天治疗前30 min配制好即可)。
2.3方法 将40只荷瘤SCID小鼠随机分为研究组(n=32)及对照组(n=8),以游标卡尺分别测量瘤体的最长径线(a)和最短径线(b),并记录相关数据;研究组小鼠每天在瘤体表面涂HPV16-siRNA-LipofectamineTM2000-卡波姆凝胶剂0.5 mL,再以无菌输液贴覆盖瘤体,避免凝胶脱失,共7 d;对照组瘤体表面仅涂LipofectamineTM2000-卡波姆凝胶,每天1次,共7 d,方法同研究组。对照组与研究小鼠均随机分为4组(研究组n=8、对照组n=2),分别于治疗结束后4 d、8 d、12 d和16 d处死,按治疗前方法测瘤体径线后取瘤体组织,一部分石蜡包埋供免疫组化检测P16、P53蛋白及常规病理检查观察细胞形态,其余部分存-20℃冰箱待检HPV-DNA。常规酚、氯仿法抽提组织DNA,PCR 检测HPV16-DNA滴度,免疫组化检测P16及P53表达,图像分析采用申洪[11]方法测阳性单位(PU值)。肿瘤体积 (tumor volume, TV)的计算公式为:TV=ab2/2[12]。
3统计学处理
结 果
1治疗后研究组与对照组不同时点宫颈癌瘤体内HPV16-DNA的变化
研究组小鼠瘤体内HPV16-DNA在治疗后8 d和12 d明显下降,与对照组之间的差异显著(P<0.01),见表1。
表1研究组与对照组SCID小鼠治疗后4d、8d、12d和16d瘤体内HPV16-DNA的变化


GroupHPV16-DNAsiRNAtransfection(4d)15.10±7.11siRNAtransfection(8d)3.23±3.86∗siRNAtransfection(12d)6.00±4.37∗siRNAtransfection(16d)10.80±7.58Control17.90±4.36
*P<0.05vscontrol group.
2对照组与研究组治疗后4d、8d、12d和16d宫颈癌瘤体体积的变化
研究组转染siRNA后12 d瘤体平均体积缩小,与对照组之间差异显著(P<0.05);转染siRNA 8 d和16 d瘤体体积虽然也缩小,但与对照组之间无显著差异,见表2。
表2对照组与研究组治疗后4d、8d、12d和16d宫颈癌瘤体体积的变化

GroupBeforetreatmentAftertreatmentsiRNAtransfection(4d)404.15±17.26415.50±12.31siRNAtransfection(8d)412.01±15.11389.89±14.71siRNAtransfection(12d)399.22±21.18361.22±11.91∗siRNAtransfection(16d)422.04±19.56382.49±24.16Control409.52±15.95443.21±43.33
*P<0.05vscontrol group.
3对照组与研究组治疗后12d病理改变
研究组转染后12 d肿瘤细胞体积较对照组缩小,细胞核变小,核异质性较对照组减轻,核浆比例减小,胞浆染色较对照组变浅, 见图1。
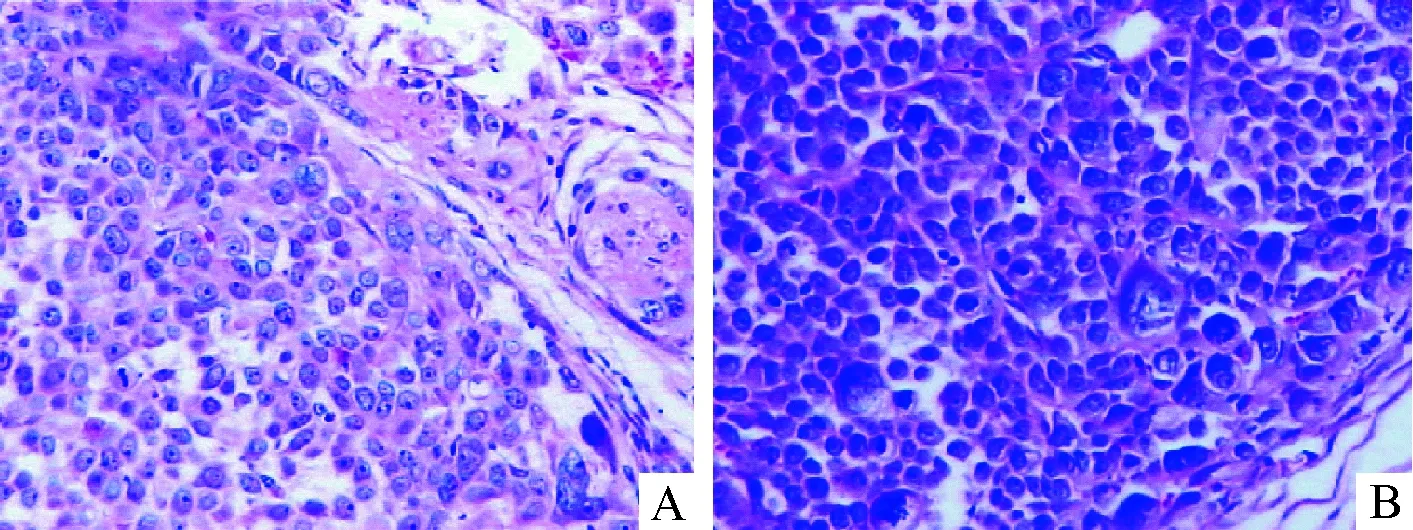
Figure 1. The dyskaryosis of tumor cells in experimental group became mild,and karyoplasmic ratio diminished at 12d after transfection (HE staining,×100). A: experimental group; B:control group.
图1转染后12d研究组与对照组肿瘤细胞形态
4治疗后研究组和对照组宫颈癌瘤体内P16和P53蛋白的表达
P16的表达强度在各时点对照组与研究组之间均无显著差异(P>0.05),研究组P53的表达强度在转染后8 d和12 d较对照组明显降低,差异显著(P<0.05),见表3,图2、3。
表3研究组与对照组治疗后不同时点宫颈癌瘤体内P16和P53蛋白的表达

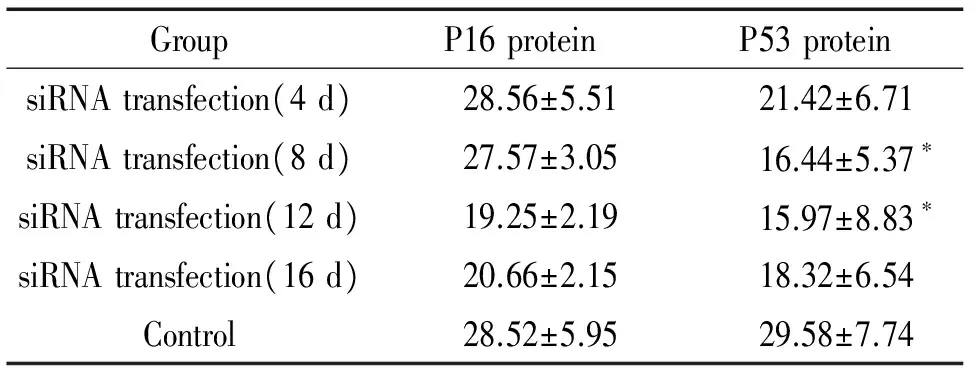
GroupP16proteinP53proteinsiRNAtransfection(4d)28.56±5.5121.42±6.71siRNAtransfection(8d)27.57±3.0516.44±5.37∗siRNAtransfection(12d)19.25±2.1915.97±8.83∗siRNAtransfection(16d)20.66±2.1518.32±6.54Control28.52±5.9529.58±7.74
*P<0.05vscontrol group.

Figure 2. The expression of P16 proteins in cervical tumor of SCID mice in control group and experimental group(×400). A:4 d after siRNA transfection; B: 8 d after siRNA transfection; C: 12 d after siRNA transfection; D: 16 d after siRNA transfection; E: control group.
图2P16蛋白表达
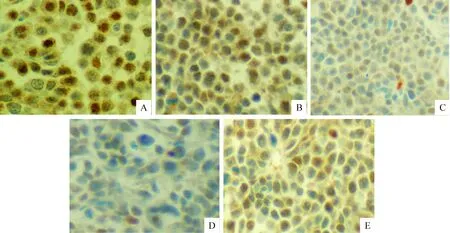
Figure 3. The expression of P53 protein in cervical tumor of SCID mice in control group and in experimental group(×400). A: control group; B:4 d after siRNA transfection; C: 8 d after siRNA transfection; E: 12 d after siRNA transfection; F: 16 d after siRNA transfection.
图3P53蛋白表达
讨 论
RNA干扰可有效引起靶向基因沉默[13],液相离体细胞转染siRNA的许多研究[14,15]均已证实靶向转染RNA可有效抑制HPV的复制,但目前在体固相转染的研究报道不多见。
我们前期的实验[4]结果提示,siRNA可由固相经脂质体转染入兔宫颈上皮组织中。本研究结果显示,HPV-DNA的滴度在染后4 d开始下降,到8 d达到最低、持续到转染后12 d开始回升,转染后16 d达新高。转染后8 d及12 d时瘤体内HPV-DNA的滴度较对照组明显降低,差异显著,这与Jiang等[1]研究一致;说明经基因治疗后8 d可使HPV的复制明显抑制、持续时间可达4 d。如果利用靶向siRNA技术对宫颈高危型HPV持续性感染的患者进行基因治疗,这段时间足以使病毒基因表达所抑制的细胞调节机制恢复,有利于机体选择性杀死病毒感染细胞,清除宫颈鳞-柱交界处的HPV。
研究还显示:随瘤体内HPV16复制活性的降低,治疗后12 d宫颈癌瘤体体积较对照组明显减小;常规病理检查细胞形态发现研究组在治疗后12 d肿瘤细胞的异质性减轻、核浆比例减小。肿瘤体积是评价化学或生物治疗肿瘤效应的常用指标,我们的实验结果显示研究组转染HPV16-siRNA后8 d、12 d、16 d时瘤体平均体积均较对照组缩小;其中转染后12 d的瘤体平均体积与对照组之间差异显著,说明固相转染HPV16-siRNA可在一定时段内有效抑制肿瘤生长。
P53基因突变在多种恶性肿瘤常见,一般免疫组化方法检测出的P53蛋白均显示为突变型,它的结构改变与表达异常可能是肿瘤发生发展的重要环节[16,17];我们研究显示P53蛋白也在转染靶向siRNA后8 d及12 d出现下降趋势;上述指标出现改变的时间与HPV16-DNA下降相一致。
本研究发现,P16蛋白的表达强度虽然在治疗后随HPV16-DNA的下降也出现降低趋势,与Prowse等[18]在探讨宫颈鳞癌高危HPV和P16表达关系中的发现一致,说明P16的过表达是继发于HPV表达的事件。但其在治疗后各个时点与对照组之间均无显著差异,与Mulvany等[7]的研究不相一致,可能的原因还需进一步研究;但从我们对P53蛋白的表达对比来看,P16蛋白作为临床评价肿瘤生物学行为及判断预后的辅助指标,其稳定性还有待探讨。
总之,实验证实固相转染靶向HPV16-siRNA在一定的时段内能有效抑制瘤体中HPV16的复制和瘤体的生长速度, 改善肿瘤细胞的异质性,降低P53蛋白表达,从侧面证实了固相转染靶向HPV16-siRNA的有效性。可为临床使用RNA干扰治疗宫颈持续性HPV感染,预防宫颈癌提供理论依据。
(致谢:在本实验进行过程中,南方医科大学病理教研室的申洪教授在百忙中给我们提供了诸多的帮助,在此表示衷心的感谢。)
[1] Jiang M, Milner J. Selective silencing of viral gene exp-ression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference [J].Oncogene, 2002, 21 (39): 6041-6048.
[2] Bousarghin L, Touze A, Gaud G, et al. Inhibition of cervical cancer cell growth by human papillomavirus virus-like particles packaged with human papillomavirus oncoprotein short hairpin RNAs[J]. Mol Cancer Ther, 2009, 8(2): 357-365.
[3] 官立丽, 彭芝兰, 牛晓宇. HPV16 E6小干扰RNA对人宫颈癌裸鼠移植瘤的抑制作用[J]. 中华肿瘤杂志,2007, 29 (12): 894-897.
[4] 廖百花,冯亦军,肖小敏.兔宫颈固相转染靶向HPV16 siRNA抑制荷宫颈癌SCID小鼠HPV的复制[J]. 中国病理生理杂志,2010, 26 (4): 695-699.
[5] Bermúdez-Morales VH, Peralta-Zaragoza O, Guzmán-Olea E,et al. HPV 16 E2 protein induces apoptosis in human and murine HPV 16 transformed epithelial cells and has antitumoral effectsinvivo[J]. Tumor Biol,2009,30(2):61-72.
[6] 赵艳忠,张为远.人宫颈鳞状细胞癌裸鼠移植模型的建立及分析[J]. 中国妇幼保健,2010,25(27):3970-3973.
[7] Mulvany NJ,Mien DG,Wilson SM.Diagnostic utility of p16lNK4a:a reappraisal of its use in cervical biopsies[J].Pathology,2008,40(4):335-344.
[8] Lung FW, Shu BC, Kao WT, et al. Association of DRD4 uVNTR and TP53 codon 72 polymorphisms with schizophrenia: a case-control study [J]. BMC Med Genet, 2009,10:147.
[9] Michalak EM, Villunger A, Adams JM, et al. In several cell types tumor suppressor P53 induces apoptosis largely via Puma but Noxa can contribute [J]. Cell Death Differ, 2008, 15(6):1019-1029.
[10]周坚红, 陈怀增, 程 琪,等.HPV16 E7肽疫苗对人免疫重建荷人宫颈癌细胞株SiHa细胞SCID鼠免疫功能的影响[J].现代妇产科进展,2005,14(5):353-357.
[11]申 洪.免疫组织化学染色定量方法研究(Ⅲ)[J].中国组织化学与细胞化学杂志,1995,4(1):89-92.
[12]Park R, Chang CC, Liang YC,et al.Systemic treatment with tetra-O-methyl nordihydroguaiaretic acid suppresses the growth of human xenograft tumors[J]. Clin Cancer Res,2005,11(12):4601-4609.
[13]Tijsteman M, Ketting RF, Okihara KL, et al. RNA heli-case MUT-14-dependent gene silencing triggered inC.elegansby short antisense RNAs[J]. Science, 2002, 295(5555): 694-697.
[14]张美红, 周克元. RNA干扰阻抑Bax inhibitor-1(bi-1)基因表达对卵巢癌细胞凋亡的影响[J]. 中国病理生理杂志, 2009, 25 (4):670-675.
[15]练 兵, 王继群, 金 琳. 靶向PCNA基因的小干扰RNA对鼻咽癌CNE2细胞周期的影响[J]. 中国病理生理杂志, 2009, 25 (8): 1533-1537.
[16]Takimoto R,Wang W,Dicker DT,et al.The mutant P53-conformation modifying drug,CP-31398,can induce apoptosis of human cancer cells and can stabilize wild-type P53 protein[J].Cancer Biol Ther,2002,1(1):47-55.
[17]朱凤琴,凤 林,胡向阳.P16、P53在宫颈上皮内瘤变和浸润性鳞癌中的表达及意义[J].安徽医科大学学报, 2009,44(2):201-204.
[18]Prowse DM,Ktori EN,Chandrasekaran D,el al.Human papillomavirus-associated increase in p16lNK4Aexpression in penile lichen sclemsus and squamous cell carcinoma [J].Br J Dermatol,2008,158(2):261-265.
siRNAinhibitsHPV16-DNAreplication,tumorvolumeandexpressionofP16andP53inSCIDmicewithSiHacellcervicalcarcinomainvivo
LIAO Bai-hua1, FENG Yi-jun1, ZENG LU-xian1, XIAO Xiao-min2
(1DepartmentofGynecology,GuangdongNo. 2ProvincialPeople’sHospital,Guangzhou510317,China;2DepartmentofGynecologyandObstetrics,TheFirstAffiliatedClinicalCollege,JinanUniversity,Guangzhou510632,China.E-mail:xiaoxiaomin55@hotmail.com)
AIM: To investigate the effect of targeting gene therapy on mouse SiHa cell cervical carcinoma by transfecting siRNA into the tumor with solid-phase methodinvivo.METHODSA sense strand siRNA (21 nt) for human papilloma virus type 16 (HPV16) was designed. siRNA-Lipo2000-carbomer gum was prepared. Forty SCID mice with SiHa cell cervical carcinoma were divided into experimental group (n=32) and control group (n=8). The diameter and volume of the tumors were measured before treatment. The mice in experimental group were treated with siRNA-Lipo 2000-carbomer gum for 7 d. The control mice were treated with Lipo 2000-carbomer gum for 7 d. The mice in experimental group and control group were sacrificed at the time points of 4 d, 8 d, 12 d and 16 d after treatment. The diameter and volume of the tumors were measured again. The HPV16-DNA in the tumor tissues was measured by PCR. The protein levels of P16 and P53 in the tumors were determined by the method of immunohistochemistry.RESULTSCompared with control group, the titer of HPV16-DNA decreased significantly at the time points of 8 d and 12 d after transfection in experimental group (P<0.05). The protein expression of P16 in experimental group showed decreased tendency 8 d and 12 d after transfection, but without statistical difference. The protein expression of P53 significantly decreased 8 d and 12 d after transfection. The tumor volume in experimental group was significantly decreased as compared to that in control group at the time point of 12 d (P<0.05). Transfection of siRNA for 12 d resulted in attenuating dyskaryosis and karyoplasmic ratio of the tumor cells.CONCLUSIONSolid-phase transfaction of siRNAinvivoinhibits HPV-DNA replication and growth of SiHa cell cervical carcinoma.
Cervix neoplasms; RNA interference; Human papilloma virus; Protein P53; Protein P16
R737.33
A
1000-4718(2011)03-0509-05
2010-10-01
2011-01-19
广东省医学科研基金资助项目(No.A2008142)
△通讯作者 Tel:020-38688607;E-mail: xiaoxiaomin55@hotmail.com
10.3969/j.issn.1000-4718.2011.03.017
