Pax-8基因真核表达载体的构建及其功能的初步研究*
2011-10-24黄晓燕陈长曦陈必成龚永生杨德业
周 希, 黄晓燕, 陈长曦, 陈必成, 龚永生, 杨德业△
(温州医学院1附属第一医院心内科, 心血管生物和基因研究所,2附属第一医院外科实验中心,3基础学院机能实验中心,浙江 温州 325000)
Pax-8基因真核表达载体的构建及其功能的初步研究*
周 希1, 黄晓燕1, 陈长曦1, 陈必成2, 龚永生3, 杨德业1△
(温州医学院1附属第一医院心内科, 心血管生物和基因研究所,2附属第一医院外科实验中心,3基础学院机能实验中心,浙江 温州 325000)
目的构建大鼠Pax-8基因全长序列的真核表达载体pcDNA3.1(+),并将重组质粒转染至心肌细胞系H9c2中进行表达,测定转染后Pax-8基因对心肌细胞增殖及凋亡的影响。方法酶切pCMV sport6-Pax-8获得大鼠Pax-8全长基因,通过基因重组技术将其插入到真核表达载体pcDNA3.1(+)中,构建重组质粒pcDNA3.1(+)-Pax-8。限制性酶切鉴定和DNA测序鉴定插入片段。将重组质粒经脂质体法转染至大鼠心肌细胞系H9c2细胞中,RT-PCR法及Western blotting法分别检测转染后Pax-8 mRNA及蛋白表达水平。CCK-8法检测细胞增殖;以血清饥饿诱导心肌细胞凋亡,同时进行Pax-8质粒转染,流式细胞仪检测细胞凋亡指数,Western blotting法检测活化caspase-3的表达。结果成功构建了大鼠pcDNA3.1(+)-Pax-8真核表达载体,且证实转染后心肌细胞的Pax-8 mRNA 及蛋白表达均明显高于空白对照组(P<0.05)及空质粒组(P<0.05)。转染Pax-8基因能提高心肌细胞的增殖能力(P<0.05),明显抑制血清饥饿引起的细胞凋亡(P<0.01),同时下调活化caspase-3的表达(P<0.01)。结论通过基因重组技术成功使得Pax-8基因在心肌细胞中过表达。Pax-8基因可能通过促进心肌细胞增殖及抑制心肌细胞凋亡从而参与胚胎心脏发育的过程。
基因,Pax-8; 真核表达; 细胞凋亡; 细胞增殖
室间隔缺损是最常见的先天性心脏病之一。尽管胚胎心脏发育已成为近年来国内外学者的研究热点,但其确切的分子机制至今仍然知之甚少。近年,国外的研究表明:骨形态发生蛋白受体ⅠA(bone morphogenetic protein receptorⅠA,BMPRⅠA,又名ALK3)在心脏发育及心肌细胞的分化中起重要作用,并与室间隔缺损形成有关[1,2]。Gaussin等使用Fukushipe等创立的α-MHC-Cre/lox P系统完成了心脏特异的ALK3基因敲除,发现纯合子小鼠皆死于胚胎中期,并伴有室间隔缺损,心内膜垫和肌小梁发育不全[3,4]。杨德业等[5,6]利用基因芯片筛选ALK3下游基因,获得候选基因Pax-8表达下调7.1倍;且Pax-8基因敲除的纯合子小鼠心脏存在室间隔缺损,凋亡增加的现象。通过RNA干扰技术体外干扰心肌细胞Pax-8基因的表达,高瞻等[7]则发现心肌细胞凋亡增加,增殖受到抑制。
本研究则通过克隆Pax-8基因全长序列,并对其进行基因重组,从而构建含有Pax-8基因全长序列的真核表达载体,并将其转染至大鼠H9c2心肌细胞中,用RT-PCR及Western blotting方法分别在mRNA和蛋白水平证实其在心肌细胞的过度表达,并测定转染Pax-8基因后对心肌细胞增殖和凋亡蛋白caspase-3的影响,从正面进一步证实Pax-8在心肌细胞凋亡中的作用。
材 料 和 方 法
1细胞与试剂
质粒pCMV sport6-Pax-8 购自ATCC;KpnI、NotI和PmeI限制性内切酶购自NEB;胶回收试剂盒购自Axygen;DH5α菌种,超级感受态细胞制备试剂盒购自碧云天生物技术研究所;LB培养液、LB/Amp液体及固体培养基均购自上海生工生物工程有限公司;质粒抽提试剂盒购自Omega;T4连接酶购自Promega;pcDNA3.1(+)质粒和Lipofectin2000购自Invitrogen,大鼠H9c2心肌细胞株购自中科院上海细胞库;DMEM高糖培养基、胎牛血清和胰酶均购自Gibico;逆转录PCR试剂盒购自Fermanats;CCK-8细胞计数试剂盒购自日本株式会社同仁化学研究所;抗大鼠caspase-3抗体购自Cell Signaling;抗大鼠Pax-8抗体和辣根过氧化物酶(HRP)标记的兔抗鼠IgG购自Abcam。
2方法
2.1超级感受态细胞的制备 根据超级感受态制备试剂盒制备E.coliDH5α感受态,并测定转化效率。
2.2重组pcDNA3.1(+)-Pax-8真核表达载体的构建 质粒pCMV sport6-Pax-8于LB/Amp固体培养基上划线,37 ℃过夜培养,挑取单个克隆,LB/Amp液体培养基中37 ℃、150-170 r/min培养16 h,提取质粒。根据pCMV sport6和pcDNA3.1(+)多克隆位点图谱及基因序列的酶切位点选择KpnI、NotI对2个质粒分别进行酶切,分别获得Pax-8全长基因序列,及带有同样黏性末端的pcDNA3.1(+)空载体。胶回收纯化后,T4连接酶连接目的片段与pcDNA3.1(+)载体,4 ℃连接过夜,转化E.coliDH5α感受态细胞, LB/Amp培养基上筛选阳性克隆,根据质粒抽提试剂盒说明书抽提质粒,经PmeI酶切鉴定后,送上海Invitrogen公司测序。
2.3H9c2心肌细胞的培养 大鼠心肌细胞株(H9c2)用含10%胎牛血清的高糖DMEM 培养基,于37 ℃、5% CO2条件下培养,待细胞生长至约70%-90%的融合状态用于实验。
2.4脂质体转染 实验分空白对照组:即未作任何处理(图中命名wild-type组);空质粒组:转染1 μg pcDNA空载体组(图中命名H9c2-pcDNA3.1组);实验组:转染1 μgPax-8重组质粒组(图中命名H9c2-Pax-8组)。根据Invitrogen公司提供的转染操作说明书进行。转染前24 h将细胞以2×105的密度接种于6孔板中,转染时用无血清DMEM洗涤细胞3次,加入质粒与脂质体的复合物,37 ℃、5% CO2培养箱中培养,6 h后更换含有10%胎牛血清的DMEM培养基,24 h后进行下一步实验检测。
2.5转染效率测定 以上述相同条件方法转染带绿色荧光蛋白的pEGFP质粒1 μg,48 h后,共聚焦拍照,计数发绿色荧光细胞数及相同视野下细胞总数,转染效率=(绿色荧光细胞数/相同视野普通光镜下细胞总数)×100%。
2.6细胞总RNA 提取 按实验室常规方法进行。弃培养液,加1 mL Trizol/2×106cells,裂解细胞;细胞裂解物转移到2 mL Eppendorf 管中,室温放置5 min;加0.2 mL 氯仿/1 mL Trizol,剧烈震荡15 s,室温放置3 min,4 ℃离心,细胞裂解液分为3层;小心吸取上层水相转移到新的1.5 mL Eppendorf 管中,加0.5 mL 异丙醇/1 mL Trizol,室温放置10 min,4 ℃离心;小心去掉上清,加1 mL 75%乙醇洗白色沉淀物,离心后去掉乙醇,空气干燥约10 min;用10-20 μL DEPC 处理过的水重悬RNA,测量1∶100 稀释样品的吸光度(A260),RNA浓度(mg/L)=稀释度×40 mg/L×A260,琼脂糖凝胶电泳浓度鉴定RNA质量,重悬的RNA 放置-80 ℃冰箱保存。
2.7逆转录聚合成第1链 使用逆转录酶MMLV合成第1链,根据公司提供的说明书进行。取3 μg总RNA与Oligo dT在70 ℃反应5 min,置于冰上,加入dNTP、5×buffer、RNase inhibitor,37 ℃反应5 min,加入逆转录酶MMLV,42 ℃反应1 h,72 ℃反应10 min终止反应。测量1∶100 稀释样品的A260来计算浓度,样品浓度(mg/L)=稀释度×40 mg/L×A260。以1 μg的逆转录产物作为模板,按如下条件进行PCR反应。
2.8PCR扩增目的基因 根据基因编号在GenBank中寻找该基因对应的cDNA全序列,使用Primer5.0筛选出分数较高的引物;运用Oligo 6.2评价引物的GC含量、Tm值、引物二聚体和错配等参数,选择较好的引物;再通过PubMed-Blast比较同源性,确保引物的特异性。Pax-8上游引物序列5’-CGGCAACGCATTGTGGA-3’,下游引物序列5’- TCCTGGGCTCAGAGATTTGG-3’,产物378 bp。GAPDH 作为内参照, 上游引物为5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物为5’-TGTAGACCATGTAGTTGAGGTCA -3’, 产物 123 bp。Pax-8 反应条件:94 ℃ 5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35 个循环,72 ℃10 min。GAPDH 反应条件:94 ℃ 5 min,94 ℃ 30 s,54 ℃30 s,72 ℃1 min,28个循环,72 ℃ 10 min。在PCR反应达到平台期之前终止以达到半定量作用。每组取10 μL PCR 产物用于1.5 %琼脂糖凝胶电泳,用Quantity One 凝胶成像分析系统(Bio-Rad)进行半定量分析。
2.9Western blotting 检测Pax-8 蛋白质表达 转染后48 h,裂解细胞提取蛋白质,BCA 法测定蛋白浓度,各组上样50 μg,行10%SDS-PAGE 电泳,转膜, 5 %脱脂牛奶室温封闭1.5 h。小鼠抗大鼠Pax-8 抗体(1∶100) 4 ℃孵育过夜,TBST 溶液洗膜3次,每次10 min。室温下加入兔抗小鼠IgG抗体(1∶2 000) 孵育1.5 h,洗膜3 次。用增强化学发光法显色,X 线片曝光显影。以GAPDH 作为内参照标化Pax-8 蛋白质表达。用Quantity One 凝胶成像分析系统进行半定量分析。
2.10CCK-8检测转染后细胞增殖能力 本实验分转染重组Pax-8质粒组、相同量空质粒转染组及空白组,转染后48 h,以0.05%胰蛋白酶消化收集贴壁细胞,加入1 mL培养液重悬后计数。以6 000 cells/well接种到96孔培养板, 分组再培养24 h后,每孔加入10 μL CCK-8 细胞计数试剂,于37 ℃孵育4 h,酶标仪450 nm下读取吸光度A450值。
2.11细胞凋亡的流式检测 以不含胎牛血清的DMEM培养基培养心肌细胞48 h,造成血清饥饿诱导心肌细胞凋亡模型,同时进行Pax-8质粒及相同量空质粒转染,分组:(1)正常细胞组;(2)阴性对照组:转染相同量空质粒的正常细胞组;(3)转染重组Pax-8质粒的心肌细胞凋亡模型组;(4)转染相同量空质粒的心肌细胞凋亡模型组。转染后48 h,将培养基中悬浮的细胞以及用0.05%胰酶消化下来的贴壁细胞收集在一起,用PBS将细胞重悬,计数1×105个细胞按照Annexin V-FITC凋亡试剂盒说明书对细胞进行Annexin V-FITC和碘化丙啶(propidium iodide, PI)染色。使用流式细胞仪进行检测(激发波长488 nm,发射波长530 nm),Annexin V单阳性为早期凋亡细胞,以对照组早期凋亡率为100%,计算各组与对照组早期凋亡率之比。
2.12Western blotting 检测activated caspase-3蛋白表达 取方法2.11中各组细胞,裂解细胞提取蛋白质,BCA 法测定蛋白浓度,各组上样50μg,行10%SDS-PAGE 电泳,转膜,7.5 %脱脂牛奶室温封闭2.5 h。兔抗大鼠活化caspase-3 抗体(1∶1 000) 4 ℃孵育过夜,TBST 溶液洗膜3 次,每次10 min。室温下加入山羊抗兔IgG抗体(1∶1 000) 孵育1.5 h,洗膜3 次。用增强化学发光法显色,X 线片曝光显影。以GAPDH 作为内参照标化活化caspase-3蛋白表达。用Quantity One 凝胶成像分析系统进行半定量分析。
3统计学处理
结 果
1Pax-8基因全长序列的获得
pCMV sport6-Pax-8质粒经KpnI及NotI双酶切后获得Pax-8全长序列,可见在2 500 bp与3 000 bp之间出现1条清晰单一的条带,与GenBank报道Pax-8基因全长碱基数2 567 bp相符,见图1A。凝胶回收全长片段后纯化,重新电泳鉴定,与酶切结果位置一致,条带清晰单一,见图1B。

Figure 1. The full length of ratPax-8 gene. A :the plasmid vector pCMV sport6 and the full length cDNA fragment ofPax-8 were cleaved byKpnI andNotI; B: the full length ofPax-8 cDNA was purified by gel extraction. Gel electrophoresis showed a single clear 2 567 bp fragment.
图1大鼠Pax-8基因全长序列电泳图
2pcDNA3.1(+)-Pax-8重组质粒的获得及鉴定
pcDNA3.1(+)与全长Pax-8序列经T4连接
酶连接、转化感受态筛选获得阳性克隆,提取质粒,Pax-8引物对质粒进行PCR获得1条长约378 bp的目的片段(图2A)、PmeI酶切鉴定(图2B箭头所指)初步证实插入的片段为Pax-8基因,测序确认(图2 C)。
3重组pcDNA3.1(+)-Pax-8质粒转染H9c2心肌细胞
激光共聚焦显微镜测定转染效率:转染带绿色荧光蛋白(green fluorescent protein,GFP)的pEGFP质粒,通过检测发绿色荧光细胞数与同一视野下普通光镜细胞总数的比率,测定转染效率平均约为72%,见图3。过表达效率:与对照组(mRNA为0.57±0.12,蛋白为0.82±0.04)相比,转染Pax-8组 (mRNA为1.47±0.34,蛋白水平为1.21±0.25)其Pax-8表达在mRNA和蛋白水平均显著升高(P<0.05);与空质粒组(mRNA为0.43±0.19,蛋白为0.84±0.06)相比,转染组Pax-8表达mRNA与蛋白水平也显著升高(P<0.05)。空质粒组与空白组的Pax-8 mRNA 和蛋白质表达均无显著差异,见图4、5。

Figure 2. Recombinant plasmid construction and identification. A:screening for the positive colonies containing the inserted fragment by colony-PCR-a 378 bp fragment was obtaind by gel electrophoresis; B: The positive colonies were amplified, extracted, purified and identified byPmeI endonuclease cleavage; C: the sequences of the inserted fragments were confirmed by automated sequencing using ABI Prism 7700 sequence detector.
图2pcDNA3.1(+)-Pax-8重组载体鉴定
4Pax-8对心肌细胞增殖的影响
采用CCK-8法检测心肌细胞增殖,结果显示(图6)与转染空质粒组相比,转染Pax-8组可促进心肌细胞的增殖,且差异显著(P<0.01)。
5Pax-8对血清饥饿诱导心肌细胞凋亡的影响
与空白对照组及阴性对照组比,血清饥饿能诱导心肌细胞凋亡(P<0.01),而转染Pax-8基因能明显抑制血清饥饿所引起的细胞凋亡(P<0.01),见图7。
6Pax-8对损伤的心肌细胞活化caspase-3蛋白表达的影响
与正常组比,血清饥饿组活化caspase-3的表达明显上调,而Pax-8基因转染能有效抑制活化caspase-3的表达,差异显著,见图8。而正常组与空质粒转染组比则无显著差异。

Figure 3. Detecton of the transfection efficiency. pEGFP vector was transfected into the H9c2 cells. After 48 h incubating, GFP was detected by laser confocal microscopy. The transfection efficiency was about 72%.n=3.
图3转染带绿色荧光蛋白质粒pEGFP,48h后激光共聚焦显微镜测定转染效率

Figure 4. Expression of Pax-8 mRNA in the wild-type(lane 1) and transfected H9c2 cells. H9c2 cells were transfected with an empty pcDNA3.1 expression vector(lane 2) or containing thePax-8 gene(lane 3),GAPDH served as the internal control.**P<0.01vswild-type and H9c2-pcDNA3.1.
图4Pax-8mRNA在心肌细胞内的表达
讨 论
先天性心脏病是一类由于胎儿时期心脏发育障碍而导致心脏形态、功能异常的疾病。目前通过对心脏发育的研究来揭示先天性心脏病的发病机制已经成为热点之一,但其根本原因尚未彻底明了。尽管如此,近年来科学研究表明先天性心脏病的主要原因可分为遗传因素和环境因素连累,其中染色体畸变如21-三体综合征可出现心内膜垫缺损、室间隔缺损、房间隔缺损和法乐氏四联症等。1条染色体包含很多基因,因此精确定位异常基因为基因治疗先天性心脏病奠定了基础。

Figure 5. Expression of Pax-8 protein in the wild-type(lane 1) and transfected H9c2 cells. H9c2 cells were transfected with an empty pcDNA3.1 expression vector(lane 2) or containing thePax-8 gene(lane 3).GAPDH served as the internal control.*P<0.05vswild-type and H9c2-pcDNA3.1.
图5Pax-8蛋白在心肌细胞内的表达
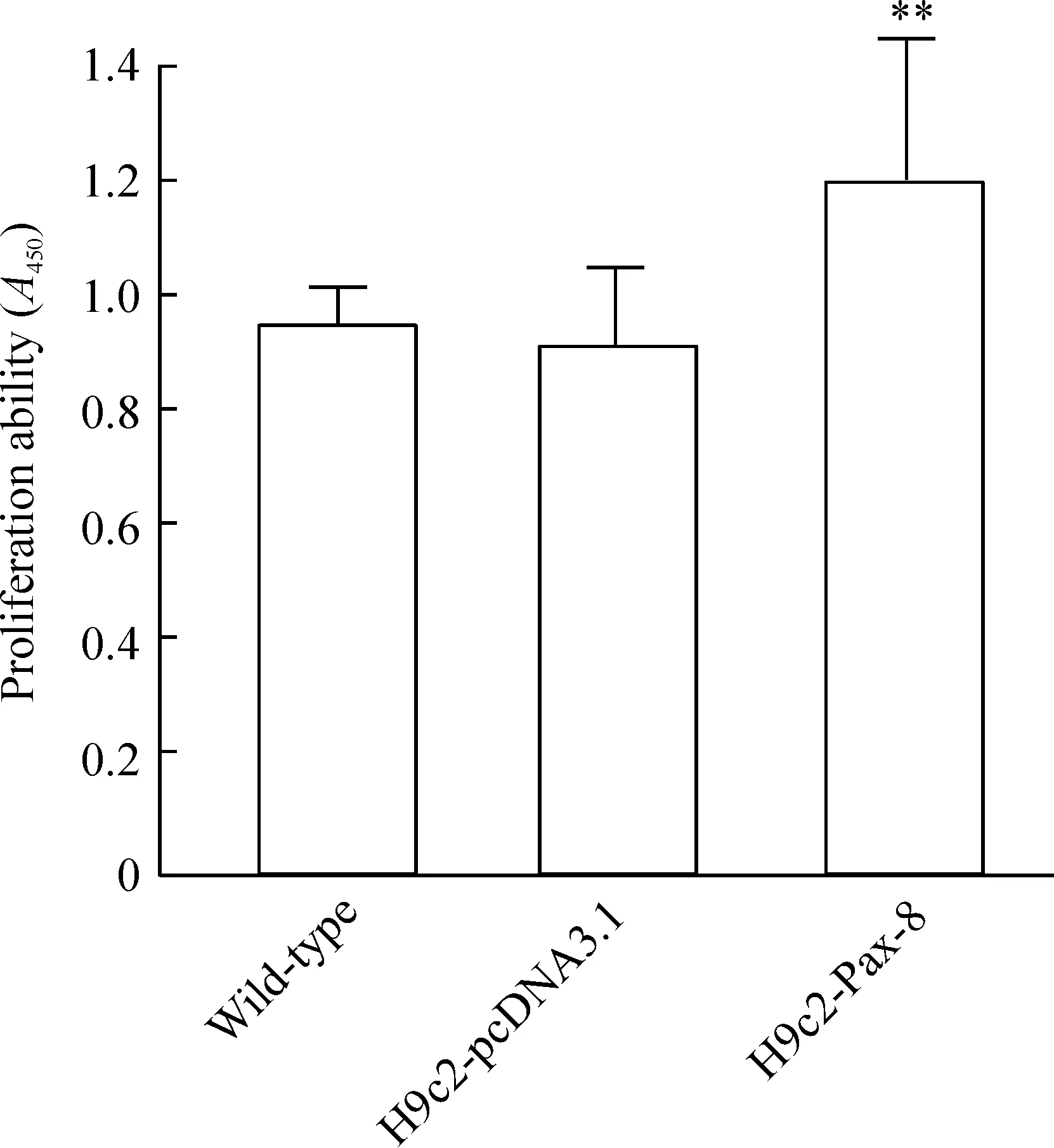

图6Pax-8对心肌细胞增殖的影响
转化生长因子β(transforming growth factor β,TGF-β)在胚胎发育、细胞分化、器官的形态发生和图式发育过程中起重要作用。ALK3属于TGF-β超家族,在心脏发育及心肌细胞分化中起重要作用。

图7Pax-8对饥饿诱导的心肌细胞凋亡的影响
美国Baylor医学院心脏发育中心Michael D. Schneider教授使用了α-MHC-Cre/loxP系统创建了心脏特异性ALK3基因敲除,发现纯合子小鼠死于胚胎中期,并伴有室间隔缺损,心内膜垫和肌小梁发育不全,根据他们的研究,ALK3与室间隔缺损的关系已经被阐明。杨德业等[5,6]利用心脏特异性ALK3敲除纯合子小鼠筛选出可能的ALK3下游基因-转录因子Pax-8,发现其在基因ALK3敲除纯合子小鼠胚胎心脏中下调了7.1倍,并较特异地表达在纯合子小鼠胚胎心脏中。

Figure 8. Effects ofPax-8 transfection on the caspase-3 protein expression of H9c2 cells.It shows that serum deprivation could increase the protein expression of activated caspase-3, while such effect is attenuated byPax-8 transfection.**P<0.01vspcDNA3.1+model;△△P<0.01vsnormal group.
图8Pax-8对饥饿诱导心肌细胞活化caspase-3蛋白表达的影响
Pax是一个与发育密切相关的转录因子基因家族,Pax基因表达的蛋白在胚胎发育中对组织和器官的特化起着重要的调控作用。Pax-8属于哺乳类Pax家族,基因在人类定位于染色体2q12-14,在小鼠定位于染色体2,人和小鼠的Pax-8基因的保守区结构特征相似,都编码128个氨基酸的成对结构域(PD),人的Pax-8基因还编码了保守的八肽(OP)[8,9]。国外研究指出,Pax-8基因在发育中的甲状腺、肾脏、脑和成年后甲状腺、肾脏、Wilm’s瘤中均有表达[10],且Pax-8基因的时空表达提示其参与了上述器官的形态发生。研究发现Pax-8基因敲除纯合子小鼠存在室间隔缺损的现象,与杂合子相比纯合子小鼠心脏舒张功能下降。
研究表明在胚胎器官发育中,细胞凋亡扮演着关键角色,一旦细胞凋亡规律失常,心脏发育也将出现异常甚至导致先天性心脏缺损。Pax-8作为转录因子,对甲状球蛋白启动子有活化作用, 氧化还原因子-1(Ref-1)增强Pax-8对其的活化作用,免疫反应数据显示,在甲状腺细胞的细胞核提取物中发现,Ref-1的含量与Pax-8的量呈正相关,Pax-8的DNA结合活化受Ref-1的调节[11],而Ref-1在人体组织中广泛存在,具有修复损伤DNA和调节多种转录因子,间接抗凋亡的作用,因此,Pax-8基因和细胞凋亡存在一定的关系。章佳颖等[12]检测了Pax-8基因敲除小鼠的心肌细胞凋亡情况,发现Pax-8基因敲除纯合子小鼠其心肌细胞凋亡程度明显高于杂合子及正常小鼠,且以室间隔和左右心室壁最甚。
研究发现,Pax-8基因的RNA干扰可引起H9c2心肌细胞增殖减少,细胞凋亡增加[7]。本研究则成功地通过基因重组技术构建含有Pax-8基因全长序列的真核表达载体,将其转染至H9c2大鼠心肌细胞中使Pax-8基因过表达。Pax-8基因过表达后心肌细胞的增殖能力增强并能抵抗由血清饥饿引起的凋亡及下调活化caspase-3蛋白的表达。
在胚胎心脏室间隔发育过程中,心肌细胞凋亡和增殖的平衡是一种有效的生物学调节机制。据此我们推测Pax-8基因正是由于参与了心肌细胞的增殖与抗凋亡从而调节心脏胚胎正常发育,可能是先天性心脏病-室间隔缺损的重要致病相关基因之一。 然而,Pax-8基因在成年大鼠心肌细胞及原代心肌细胞中是否具有同样的作用,及其与ALK3基因相关的信号转导通路,仍有待进一步的研究。
[1] Schlange T,Andrée B, Arnold H, et al. BMP2 is required for early heart development during a distinct time period [J]. Mech Dev,2000, 91(1-2): 259-270.
[2] Mishina Y, Suzuki A, Ueno N, et al. Bmpr encodes a type I bone morphogenetic protein receptor that is essential for gastrulation during mouse embryogenesis [J]. Genes Dev, 1995, 9(24):3027-3037.
[3] Fukushige S, Ikeda JE. Trapping of mammalian promoters by Cre-loxsite-specific recombination [J]. DNA Res, 1996, 3(2):73-80.
[4] Gaussin V, Behringer RR, Schneider MD, et al. Endocardial cushion and myocardial defects after cardiac myocyte-specific conditional deletion of the bone morphogenetic protein receptor ALK3[J]. Proc Natl Acad Sci USA, 2002, 99(5):2878-2883.
[5] 杨德业, 张怀勤, 黄晓燕,等. 室间隔缺损相关基因-BMPR下游基因的探讨[J].温州医学院学报, 2003,33(2):76-78.
[6] 杨德业,宋后燕,张怀勤,等.心肌组织Pax-8 基因的研究[J].中华儿科杂志,2003, 41(10):770-772.
[7] 高 瞻,来丹丹,杨德业,等.Pax-8 基因在大鼠心肌细胞凋亡中的作用[J]. 解放军医学杂志,2009,34(9):1082-1084.
[8] Walther C, Grusss P. Pax-6, a murine paired box gene, is expressed in the developing CNS [J]. Development, 1991, 113(4):1435-1449.
[9] Stapleton P, Weith A, Urbanek P, et al. Chromosomal localization of seven PAX genes and cloning of a novel family member,PAX-9[J].Nat Genet,1993,3(4):292-298.
[10]Poleev A, Fickenscher H, Mundlos S, et al. PAX-8, a human paired box gene: isolation and expression in developing thyroid, kidney and Wilms’ tumors[J]. Development, 1992, 116(3):611-623.
[11]Tell G, Pellizzari L, Cimarosti D, et al. Ref-1 controls pax-8 DNA-binding activity [J]. Biochem Biophys Res Commun, 1998, 252(1):178-183.
[12]章佳颖,来丹丹,杨德业,等.Pax-8基因在胚胎心脏发育中的作用[J]. 中国病理生理杂志,2009, 25(7):1292-1297.
ConstructionofPax-8generecombinantplasmidandstudyofitsfunction
ZHOU Xi1, HUANG Xiao-yan1, CHEN Chang-xi1, CHEN Bi-cheng2, GONG Yong-sheng3, YANG De-ye1
(1DepartmentofCardiology,TheFirstAffiliatedHospital,InstituteforCardiovascularBiology&Gene,2CenterofExperimentalSurgery,TheFirstAffiliatedHospital,3ExperimentalCenterofFunction,SchoolofBasicMedicalSciences,WenzhouMedicalCollege,Wenzhou325000,China.E-mail:Deyeyang203@hotmail.com)
AIM: To investigate the effects of over-expression ofPax-8 gene on the proliferation and apoptosis of H9c2 cells(a cardiomyocyte cell line).METHODSThe full length of ratPax-8 gene was restrictively digested byKpnI andNotI from the pCMV sport6-Pax-8 vector, and then inserted into the eukaryotic expression vector pcDNA3.1(+). The recombinant plasmid pcDNA3.1(+)-Pax-8 was confirmed by restriction endonuclease digestion and sequencing. The pcDNA3.1(+)-Pax-8 was transfected into H9c2 cells. The expression ofPax-8 at mRNA and protein levels was identified after transfection by RT-PCR and Western blotting. The cell proliferation was measured by CCK-8. Cell apoptosis was induced by serum deprivation in H9c2 cells transfected withPax-8 gene. The apoptosis rate of the cells was determined by flow cytometry with annexin V-FITC and propidium iodide double staining. The protein expression of activated caspase-3 was measured by Western blotting.RESULTSThe full length ofPax-8 gene was successfully cloned into pcDNA3.1(+) expression vector and over-expression ofPax-8 at mRNA and protein levels was observed in H9c2 cells transfected withPax-8 gene as compared to the wild-type cells and the cells transfected with an empty vector (bothP<0.05). Transfection ofPax-8 gene promoted the proliferation of the cardiomyocytes (P<0.05) and inhibited the apoptosis rates induced by serum deprivation (P<0.01). The expression level of activated caspase-3 was increased by serum deprivation and attenuated byPax-8 transfection (P<0.01).CONCLUSIONThe pcDNA3.1(+)-Pax-8 expression vector was successfully constructed and over-expression ofPax-8 gene in cardiomyocytes is obtained.Pax-8 gene acts as an anti-apoptotic factor in cardiomyocytes by promoting cell proliferation and inhibiting apoptosis.
Genes,Pax-8; Eukaryotic expression; Apoptosis; Cell proliferation
R363
A
1000-4718(2011)03-0430-07
2010-08-26
2010-12-17
国家自然科学基金资助项目(No.30571050);浙江省温州市科技发展计划资助项目(No.Y2006A017)
△通讯作者 Tel: 0577-88069213; E-mail: Deyeyang203@hotmail.com
10.3969/j.issn.1000-4718.2011.03.003
