大鼠肺动脉平滑肌细胞Rho激酶对p-Smad1核迁移的作用及机制*
2011-10-24李春香李福海汪大琨
李春香, 李福海, 夏 伟△, 时 庆, 汪大琨
(山东大学齐鲁医院1儿科,2低温医学研究室,山东 济南250012)
大鼠肺动脉平滑肌细胞Rho激酶对p-Smad1核迁移的作用及机制*
李春香1, 李福海1, 夏 伟1△, 时 庆2, 汪大琨2
(山东大学齐鲁医院1儿科,2低温医学研究室,山东 济南250012)
目的研究Rho激酶对p-Smad1核迁移的作用及信号转导途径,探讨它们在肺血管重构中的作用机制。方法分离培养大鼠远端肺动脉平滑肌细胞,应用血小板源性生长因子BB(PDGF-BB)启动肺动脉平滑肌细胞Rho激酶信号通路,应用骨形态发生蛋白2(BMP-2)启动BMP信号通路,并用Rho激酶抑制剂Y-27632、MEK抑制剂U0126进行干预。培养细胞分成5组:(1)对照组;(2)BMP-2组;(3)BMP-2+PDGF-BB组;(4)BMP-2+PDGF-BB+Y-27632组;(5)BMP-2+PDGF-BB+U0126组。免疫荧光染色标记p-Smad1在细胞核内外的分布并计算p-Smad1核迁移阳性细胞百分数(即核迁移率)。分离平滑肌细胞核蛋白和胞浆蛋白,Western blotting分析p-Smad1在细胞内的总量和细胞核内外相对含量的变化。Kit-WST-8试剂盒检测细胞增殖。结果BMP-2组p-Smad1在细胞内的总量、在细胞核中的相对含量和核迁移率明显高于对照组(P<0.05);BMP-2+PDGF-BB 组p-Smad1的核迁移率和在细胞核中的相对含量明显低于BMP-2组(P<0.05),但是细胞内p-Smad1总量无明显改变(P>0.05);BMP-2+PDGF-BB+ Y-27632组和BMP-2+PDGF-BB+U0126组细胞内p-Smad1的总量、在细胞核中的相对含量和核迁移率与BMP-2组基本相似(P>0.05)。BMP-2组的A值明显小于对照组(P<0.05);PDGF-BB+BMP-2组的A值明显大于BMP-2组(P<0.05)且大于对照组(P<0.05);BMP-2+PDGF-BB+Y-27632组和BMP-2+PDGF-BB+U0126组的A值均小于PDGF-BB+BMP-2组(P<0.05)。结论在大鼠肺动脉平滑肌细胞,PDGF-BB激活的Rho激酶通过MEK/ERK1/2抑制BMP-2引起的p-Smad1核迁移,促进平滑肌细胞增殖。
肺动脉; 平滑肌细胞;Rho激酶;骨形态发生蛋白质2;p-Smad1核迁移
肺动脉高压(pulmonary artery hypertension,PAH) 的发生,先是肺微小动脉平滑肌细胞增生及表型的转变,导致血管壁增厚、内径狭小、张力增高[1],而后不但引起肺血管收缩性改变,而且导致肺小动脉结构重构。文献资料表明Rho激酶信号通路和骨形态发生蛋白(bone morphogenetic protein,BMP)信号通路在PAH肺血管结构重构过程中发挥了相反的调节作用。促有丝分裂因子(PDGF、5-羟色胺、血管紧张素Ⅱ等)通过激活RhoA/Rho激酶/MEK/ERK1/2信号通路促进肺血管中膜平滑肌细胞的增生和肥大[2,3],而骨形态发生蛋白受体2(bone morphogenetic protein receptor2,BMPR 2)基因突变和表达降低是原发性PAH和各种继发性PAH的重要发生机制[4-6]。MAPK (MEK/ERK1/2)可以磷酸化BMP下游信号分子p-Smads(1 /5 /8)的中间链接区,抑制其向细胞核内的迁移,从而抑制BMP信号通路的转导[7]。本研究假定这2条通路之间存在相互作用,通过体外培养大鼠肺动脉平滑肌细胞,分别应用BMP-2和血小板源性生长因子BB(platelet-derived growth factorBB,PDGF-BB)启动BMP信号通路和激活Rho激酶,并用Rho激酶抑制剂Y-27632和MEK抑制剂U0126进行干预,免疫荧光染色观察p-Smad1在细胞核内外的分布;提取分离胞浆和胞核蛋白,Western blotting检测p-Smad1在细胞内的总量和细胞核内外的分布;旨在揭示Rho激酶对p-Smads核迁移的作用及机制,探讨它们在PAH肺血管重构中的作用机制。
材 料 和 方 法
1大鼠远端肺动脉平滑肌细胞的分离培养
Wistar大鼠(约180 g),开胸取心肺,用显微剪及显微镊在放大镜下循肺动脉主干逐级追入肺实质,取肺动脉2级及以下分支,冷PBS液中剥除外膜纤维脂肪层,纵向剪开血管,内面朝上弯头小镊子自上而下刮除内膜,留中膜平滑肌层。分次酶消化法收集细胞(0.25%胰酶)。加入含10%FBS-LDMEM(Gibco)的培养基,置37 ℃、5%CO2培养箱内静置培养,3-5 d后换培养基。采用平滑肌α-actin单克隆抗体(Santa Cruz)对培养的细胞进行鉴定[8]。
2免疫荧光标记p-Smad1在细胞核内外的分布
2.1分离培养原代大鼠肺动脉平滑肌细胞 传代培养至3-5代时备用。
2.2肺动脉平滑肌细胞Rho激酶信号转导通路和BMP信号转导通路的干预 肺动脉平滑肌细胞种植到48孔细胞培养板,10%FBS-LDMEM中培养至70%-80%融合,然后在含1% FBS基质中静止24 h,使细胞生长周期同步到G0期,肺动脉平滑肌细胞分为5组,在再次加入10%FBS-LDMEM启动细胞生长的同时,不同分组细胞分别加入相应试剂孵育:(1)对照组:加入10%FBS-LDMEM孵育;(2)BMP-2组:在10%FBS-LDMEM孵育30 min后,再加入2 μg/L BMP-2 (Peprotech);(3)BMP-2+PDGF-BB组: 在10%FBS-LDMEM中孵育15 min,然后加入10 μg/L PDGF-BB孵育15 min,最后加入2 μg/L BMP-2;(4)BMP-2+PDGF-BB+Y-27632组:在10%FBS-DMEM中孵育的同时加入10 μmol/L Y-27632孵育15 min,然后加入10 μg/L PDGF-BB孵育15 min,最后加入2 μg/L BMP-2;(5)BMP-2+PDGF-BB+U0126组: 在10%FBS-DMEM中孵育的同时加入10 μmol/L U0126孵育15 min,然后加入10 μg/L PDGF-BB孵育15 min,最后加入2 μg/L BMP-2。每组的不同干预点均设3个复孔。
2.3肺动脉平滑肌细胞p-Smad1细胞核内外分布量检测 加入上述试剂后,在10%FBS-DMEM 中继续孵育5 min至24 h,每隔5-60 min收取细胞做免疫荧光染色p- Smad1(5-60 min内间隔5 min,1-6 h间隔20 min,6-12 h间隔40 min, 12-24 h间隔60 min)。染色方法为:多聚甲醛固定细胞,含0.1% Triton X-100 PBS缓冲液中透化处理,羊抗p-Smad1抗体(Santa Cruz)孵育、罗丹明标记兔抗山羊Ⅱ抗(中杉金桥公司)染色,倒置相差荧光显微镜观察p-Smad1在细胞核内外的分布。4,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI,Roche分装)对细胞核进行对比染色。实验先后重复了4次。每组在不同时点的3个复孔中随机取10个视野拍照。将4次实验的拍照结果进行汇总,每组随机取10张免疫荧光照片(n=10),观察分析p-Smad1在细胞核内外的分布,计算p-Smad1核迁移阳性的细胞百分数,即核迁移率。同一细胞,p-Smad1在细胞核中浓聚,即在细胞核中分布明显浓于细胞质,就视为p-Smad1核迁移阳性,见图1。

Figure 1. The cell p-Smad 1 nuclear translocation (immunofluorescent staining,×200).
图1p-Smad1核迁移阳性的细胞
3Westernblotting检测p-Smad1在细胞核内外的分布
细胞于培养瓶中培养至4-5代,在含1% FBS基质中静止24 h,在再次加入10%FBS-LDMEM启动细胞生长的同时进行分组并加入相应试剂孵育(同免疫荧光)。 在加入所有试剂孵育1h后,每组取至少2瓶细胞,分离核蛋白和细胞浆蛋白,操作参照核蛋白提取试剂盒(Bestbio)。Western blotting简要步骤是:加蛋白提取物进行12%SDS-PAGE凝胶电泳,电转到NC膜、封闭、滴加Ⅰ抗。所用Ⅰ抗为鼠抗β-actin(1∶1 000,中杉金桥公司)抗体和羊抗p-Smad1(1∶500,Santa Cruz)抗体。滴加辣根过氧化物酶标记的山羊抗鼠Ⅱ抗孵育(1∶20 000,中杉金桥公司)及兔抗山羊Ⅱ抗孵育(1∶20 000,中杉金桥公司)。免疫反应条带用电化学发光(electrochemiluminescence,ECL,Millipore),然后直接对印记膜进行荧光CCD扫描。用Quantity One软件进行辉度分析。以β-actin作内参照,目的蛋白色条带辉度与β-actin显色条带辉度比值代表目的蛋白相对表达量。5组实验均重复4次。
4CellCountingKit(CCK)-WST-8试剂盒检测细胞增殖
接种细胞悬液于96孔板中,100μL/well,在培养箱内稳定过夜。第2 d对细胞进行分组并每隔2 h加入相应试剂孵育(分组情况及加试剂浓度同免疫荧光),连续24 h。做细胞数目测定时每孔加入10 μL CCK-8溶液,将培养板在培养箱内继续孵育2 h,用酶标仪测定在450 nm处的吸光度(A值),测定的A值与增殖细胞数量呈线性关系。
5统计学处理
结 果
1细胞鉴定
大鼠肺动脉平滑肌细胞免疫荧光结果可见,细胞质α-actin均匀发红色荧光、细胞核发蓝色荧光,细胞纯度平均达98%以上,见图2。

Figure 2. Morphology and purity of rat pulmonary artery smooth muscle cells(immunofluorescent staining,×200).
图2大鼠肺动脉平滑肌细胞的鉴定
2免疫荧光标记p-Smad1在细胞核内外的分布
免疫荧光染色显示,对照组p-Smad1在大部分细胞浆中(95%以上)显色很弱并分布均匀,而且随着时间延长变化不大,30 min后在少数细胞核内有较弱的浓聚,核迁移率仅占10.00%±0.71%。BMP-2组,在5 min后p-Smad1在细胞核内的浓聚即开始,30 min到高峰期,最大核迁移率达到68.00%±1.05%,与对照组相比差异显著(P<0.01),且这种高峰期可持续2 h,浓聚现象虽逐渐衰退,但24 h后仍可存在,且p-Smad1在细胞核内浓聚的细胞数目24 h内始终大于20%。BMP-2+PDGF-BB组,5 min后p-Smad1在细胞核内的浓聚也开始,但与BMP-2组比较,没有明显高峰期出现,p-Smad1的最大核迁移率为29.40%±2.52%,与BMP-2 组相比差异显著(P<0.01),大部分细胞细胞质与细胞核中的p-Smad1分布均匀如对照组。BMP-2+PDGF-BB+Y-27632组和BMP-2+PDGF-BB+U0126组,在5min后p-Smad1在细胞核中的浓聚亦开始,30 min达到高峰期,p-Smad1的最大核迁移率分别为64.20%±1.43%和65.80%±1.83%,与BMP-2+PDGF-BB组相比差异显著(P<0.05),浓聚表现类似BMP-2组(P>0.05),只是高峰期持续时间略短,见图3-5。
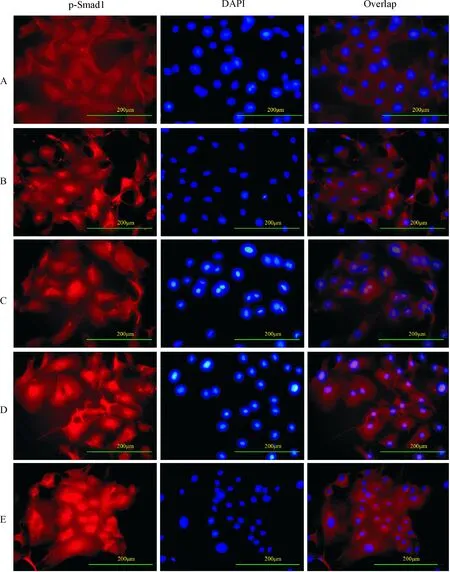
Figure 3. Distribution of p-Smad1 in pulmonary artery smoth muscle cells 1 h after BMP-2 exposure(immunofluorescent staining,×200). A:control group;B: BMP-2 group;C:BMP-2+PDGF-BB group;D: BMP-2+PDGF-BB+ Y-27632 group; E:BMP-2+ PDGF-BB+ U0126 group.
图3免疫荧光标记p-Smad1在细胞核内外的分布
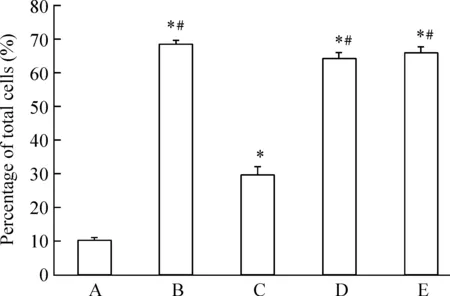
图4免疫荧光标记p-Smad1核迁移阳性细胞百分数

图5细胞核内p-Smad1核迁移随时间变化趋势
3Westernblotting结果
据免疫荧光的结果,选择p- Smad1在细胞核中浓聚达到高峰期(BMP-2作用1 h)时进行Western blotting检测。与对照组相比,BMP-2组p-Smad1在细胞浆的总量以及在细胞核的相对含量明显增多(P<0.05);BMP-2+PDGF-BB 组p-Smad1在细胞核的相对含量明显低于BMP-2组(P<0.05),细胞内p-Smad1总量有减少趋势,但无显著差异(P>0.05);BMP-2+PDGF-BB+ Y-27632组和BMP-2+PDGF-BB+U0126组p-Smad1的总量以及在细胞核中的相对含量与BMP-2组基本相似(P>0.05),其细胞核内相对含量明显高于BMP-2+PDGF-BB组(P<0.05),见图6、7。
4CCK-WST-8试剂盒检测细胞增殖结果
加试剂作用12 h,BMP-2组A值(1.924±0.086)明显小于对照组A值(2.032±0.176)(P<0.05),说明BMP-2明显抑制了细胞增殖;PDGF-BB+BMP-2组A值(2.456±0.045)显著大于BMP-2组(P<0.05),且A值亦大于对照组(P<0.05),说明PDGF-BB阻断了BMP-2对细胞增殖的抑制作用而且促进了细胞的增殖;BMP-2+PDGF-BB+Y-27632组A值(2.312±0.079)和BMP-2+PDGF-BB+U0126组A值(2.204±0.207)均小于PDGF-BB+BMP-2组(P<0.05),说明Y-27632和U0126抑制了PDGF-BB的促细胞增殖作用,见图8。
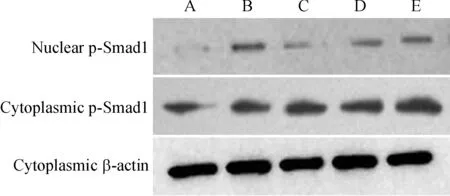
Figure 6. Western blotting analysis of p-Smad1 1 h after BMP-2 exposure. A: control group;B: BMP-2 group;C:BMP-2+PDGF-BB group;D:BMP-2+PDGF-BB+ Y-27632 group; E:BMP-2+ PDGF-BB+ U0126 group.
图6BMP-2作用1h细胞浆及细胞核内p-Smad1相对含量
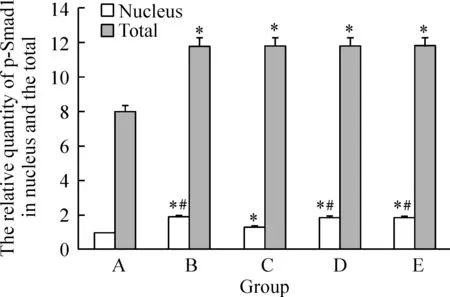
图7BMP-2作用1h细胞核中p-Smad1的相对表达量


图8BMP-2作用12h各组细胞的增殖情况
讨 论
综合实验结果,加入BMP-2后:免疫荧光显示p-Smad1往细胞核中迁移明显增多,Western blotting也显示p-Smad1在细胞核中的含量较对照组明显增多,而CCK-WST-8试剂盒检测细胞增殖结果显示BMP-2明显抑制细胞的增殖;再加入PDGF-BB后p-Smad1往细胞核中迁移被明显抑制,在细胞核中的含量也明显减少,细胞增殖结果显示细胞增殖明显;再加入Y-27632和U0126后p-Smad1又恢复了往细胞核中迁移,p-Smad1在细胞核中的含量也显著增加,细胞增殖结果显示细胞增殖的趋势被抑制。以上的结果充分说明,在大鼠肺动脉平滑肌细胞,PDGF-BB激活的Rho激酶通过MEK/ERK1/2抑制BMP-2引起的p-Smad1核迁移来促进平滑肌细胞增殖。
BMPs属于转化生长因子-β(transforming growth factor-β,TGF-β)超家族,能够调节多种生物过程。在心血管生理方面,BMPs对血管平滑肌细胞主要发挥促进分化和凋亡、抑制增生作用,以维持血管结构的稳定。Smads是BMP信号通路的细胞内信号转导分子,BMPs与其受体结合后,磷酸化其下游信号转导分子Smad1/5/8的受体活化区(C末端),磷酸化的Smads(p-Smads)迁移到细胞核内,
调节基因转录。在该研究中,分离培养的大鼠肺动脉平滑肌细胞,加入10%FBS-LDMEM启动细胞生长的同时,加入BMP-2后,免疫荧光染色观察到明显的p-Smad1核迁移,在细胞核中浓聚的细胞达到70%,Western blotting的检测结果亦表明细胞内总量和细胞核内p-Smad1显著增多,提示BMP-2成功启动了BMP信号通路的转导。Kit-WST-8试剂盒检测细胞增殖结果证实BMP-2确实抑制了细胞的增殖。
PDGF是一种作用很强的促有丝分裂因子,在各种原因所致的肺动脉高压肺血管结构重构过程中,表达增强的PDGF对肺动脉中膜平滑肌细胞发挥了很强的促分裂、促增生作用[9,10]。在本研究中发现,PDGF-BB能够有效抑制p-Smad1的核迁移,在加入PDGF-BB后,免疫荧光和Western blotting结果均显示细胞核内p-Smad1明显减少,而加入Y-27632抑制Rho激酶活性或U0126 (MEK抑制剂)抑制ERK1/2激活后,p-Smad1的核迁移得到很大程度的恢复,阻断了PDGF-BB对BMP-2启动的p-Smad1核迁移的抑制作用,表明PDGF-BB通过激活RhoA/Rho激酶/MEK/ERK1/2信号通路抑制了p-Smad1核迁移。在该研究中虽然PDGF-BB能够有效抑制p-Smad1的核迁移,而细胞内的p-Smad1总量却没有减少,提示PDGF-BB并非通过干扰p-Smad1 C末端的磷酸化抑制其核迁移,应该是通过激活RhoA/Rho激酶MEK/ERK1/2信号通路磷酸化p-Smads的中间连接区,致p-Smads被Smurf1降解[11],抑制p-Smads的核迁移, p-Smads被Smurf1降解量,相对于细胞核内的含量,发生显著改变,而相对于细胞浆和细胞内总量,影响甚微,所以p-Smad1总量虽有减少趋势,但无显著差异。细胞增殖结果充分显示PDGF-BB阻断了BMP-2对细胞增殖的抑制作用,促进了细胞的增殖,而加入Y-27632抑制Rho激酶活性或U0126 (MEK抑制剂)抑制ERK1/2后,PDGF-BB的促进细胞增殖作用又被抑制。所以,PDGF-BB通过抑制p-Smad1的核迁移阻断BMP信号通路对平滑肌细胞的稳定作用进而促进了细胞的增殖,这有可能是RhoA/Rho激酶信号通路促进平滑肌细胞增殖的作用机制之一,见图9。

Figure 9. The cross talk of Rho kinase signaling pathway and BMP signaling pathway. Rho kinase and BMP-2 cross talking at p-Smad1 by phosphorylating its link region and C-terminal, respectively.
图9Rho激酶信号通路和BMP信号通路的相互作用,它们分别磷酸化p-Smad1连接区和羧基末端
[1] Barbera JA,Peinado VI,Santos S.Pulmonary hypertension in chronic obstructive puImonary disease[J].Eur Respir J,2003,21(5):892-905.
[2] Nossaman BD,Kadowitz PJ.The role of the RhoA/rho-kinase pathway in pulmonary hypertension[J].Curr Drug Discov Technol,2009,6(1):59-71.
[3] Chen XY,Dun JN,Miao QF,et al.Fasudil hydrochloride hydrate,a Rho-kinase inhibitor, suppresses 5-hydroxytryptamine-induced pulmonary artery smooth muscle cell proliferation via JNK and ERK1/2 pathway[J].Pharmacology,2009,83(2):67-79.
[4] Takahashi H,Goto N,Kojima Y,et al.Downregulation of type II bone morphogenetic protein receptor in hypoxic pulmonary hypertension[J].Am J Physiol Lung Cell Mol Physiol,2006,290(3):L450-L458.
[5] Ramos MF,Lamé MW,Segall HJ,et al.Smad signaling in the rat model of monocrotaline pulmonary hypertension[J].Toxicol Pathol,2008,36(2):311-320.
[6] Rondelet B,Kerbaul F,van Beneden R,et al.Signaling molecules in overcirculation-induced pulmonary hypertension in piglets:effects of sildenafil therapy[J]. Circulation,2004,110(15):2220-2225.
[7] Kretzschmar M,Doody J,Massagué J.Opposing BMP and EGF signalling pathways converge on the TGF-β family mediator Smad1[J].Nature, 1997,389(6651):618-622.
[8] 洪 城,王 健,李 冰,等.大鼠远端肺动脉平滑肌细胞分离与原代培养[J].中华生物医学工程杂志,2007,13 (3):176-179.
[9] Szewczyk NJ,Peterson BK,Jacobson LA.Activation of Ras and the mito protein kinase pathway promotes protein degradation in muscle cells ofCaenorhabditiselegans[J].Mol Cell Biol,2002,22(12):4181-4188.
[10]Chang F,Steelman LS,McCubrey JA.Raf-induced cell cycle progression in human TF-1 hematopoietic cells[J].Cell Cycle,2002,1(3):220-226.
[11]Sieber C,Kopf J,Hiepen C,et al.Recent advances in BMP receptor signaling[J].Cytokine Growth Factor Rev,2009,20(5-6):343-355.
EffectsofRhokinaseonp-Smad1nucleartranslocationinratpulmonaryarterysmoothmusclecells
LI Chun-xiang1, LI Fu-hai1, XIA Wei1, SHI Qing2, WANG Da-kun2
(1DepartmentofPediatrics,2CryomedicineLaboratory,QiluHospitalofShandongUniversity,Jinan250012,China.E-mail:cicql@163.com)
AIM: To explore the mechanism of bone morphogenetic protein (BMP) and Rho kinase signal pathways on the proliferation of pulmonary artery smooth muscle cells.METHODSPulmonary smooth muscle cells were isolated from the rat distal pulmonary artery and cultured. BMP and Rho kinase pathways were activated by BMP-2 and platelet-derived growth factor BB(PDGF-BB),respectively. Rho kinase inhibitor Y-27632 and MEK inhibitor U0126 were also used. Immunofluorescent staining was applied to observe p-Smad1 distribution across the nucleus, and the cells with positive p-Smad1 nuclear accumulation were counted and the nuclear translocation rate was calculated. The total p-Smad1 and its distribution across the nucleus were quantitatively determined by Western blotting. The cell proliferation was analyzed by CCK-8 assay.RESULTSExposure to BMP-2 significantly increased both the total amount of p-Smad1 and its nuclear accumulation in pulmonary smooth muscle cells. Pretreatment with PDGF-BB significantly decreased the nuclear accumulation of p-Smad1 induced by BMP-2 without decrease of total p-Smad1. However, pretreatment with Y-27632 or U0126 reversed the inhibitory effect of PDGF-BB on p-Smad1 nuclear accumulation. BMP-2 significantly inhibited the cell proliferation, but PDGF-BB blocked the effect of BMP-2 and significantly increased the cell proliferation. After pretreated with Y-27632 or U0126, the PDGF-BB-activated cell proliferation was suppressed.CONCLUSIONPDGF-BB-activated Rho kinase inhibits BMP-2-induced p-Smad1 nuclear translocation via MEK/ERK1/2, and increases pulmonary artery smooth muscle cell proliferation.
Pulmonary artery; Smooth muscle cells; Rho kinase; Bone morphogenetic protein-2; p-Smad1 nuclear translocation
R363
A
1000-4718(2011)03-0443-07
2010-09-26
2011-01-12
山东省优秀中青年科学家科研奖励基金资助项目(No.2008BS03017)
△通讯作者 Tel:0531-82169940;E-mail:cicql@163.com
10.3969/j.issn.1000-4718.2011.03.005
