槲皮素抑制内皮素-1诱导的人脐动脉平滑肌细胞T型钙通道的表达*
2011-10-24商战平司艳红李卫红于凤秀王家富
周 晓, 商战平, 司艳红, 李卫红, 于凤秀, 王家富
(1 泰山医学院病理生理教研室, 山东 泰安 271000; 2 山东医学高等专科学校病理教研室, 山东 临沂 276002)
槲皮素抑制内皮素-1诱导的人脐动脉平滑肌细胞T型钙通道的表达*
周 晓2, 商战平1△, 司艳红1, 李卫红1, 于凤秀1, 王家富1
(1泰山医学院病理生理教研室, 山东 泰安 271000;2山东医学高等专科学校病理教研室, 山东 临沂 276002)
目的通过观察原代培养的人脐动脉平滑肌细胞在内皮素(ET-1)作用下对T型钙通道(TCC)的影响,进一步探讨槲皮素(Que)对心血管的保护作用。方法原代培养人脐动脉平滑肌细胞,经鉴定于2-3代用于实验。将细胞随机分成对照组、Que组、模型组和实验组。对照组:不加入任何药物;Que组:加入Que 80 μmol/L培养24 h模型组:加入100 nmol/L ET-1培养24 h;实验组:加入Que培养1 h后,再加入100 nmol/L ET-1共同培养24 h,其中Que的浓度为20、40、80 μmol/L。采用RT-PCR和Western blotting检测TCC的主要亚基α1G在mRNA和蛋白水平的表达。利用全细胞膜片钳技术,检测TCC电流(ICaT)。结果模型组α1GmRNA和蛋白的表达均强于对照组和实验组(P<0.05),模型组ICaT密度明显大于对照组和实验组(P<0.01),而对照组和Que组的实验结果无明显差别(P>0.05)。结论ET-1诱导人血管平滑肌细胞中TCC的表达和ICaT的增强,Que能抑制这种增强效应。这可能是Que发挥保护心血管功能的机制之一。
槲皮素; 钙通道,T型; 血管平滑肌细胞; 内皮缩血管肽1
槲皮素(quercetin,Que)为天然蜂胶中类黄酮的一种,具有防治心血管疾病的功能。内皮素-1 (endothelin-1,ET-1)是一种内源性血管活性肽,属于促有丝分裂原性激素。T型钙通道(T-type calcium channels,TCC)属于电压依赖型钙通道(voltage- dependent calcium channel,VDCC)之一,具有低电压激活的特性。据文献报道,三者都和血管平滑肌细胞(vascular smooth muscle cells,VSMCs) 的增殖活化有关[1-3],但Que 、ET-1、TCC之间有无内在联系则缺乏相关研究,本文探讨了ET-1和Que是否通过TCC发挥对心血管损伤或保护的作用。
材 料 和 方 法
1材料
1.1研究对象 人脐动脉平滑肌细胞( human umbilical artery smooth muscle cells,HUASMCs)。
1.2主要试剂 ET-1和胰蛋白酶购于 Sigma;Que购于上海君创生物科技有限公司;DMEM/F12 培养液购于Hyclone;胎牛血清(超级型)购于杭州四季青生物工程材料研究所;青霉素和链霉素购于山东鲁抗医药股份有限公司;anti-α1G(α1G是TCC的主要亚基)和anti-actin 多克隆抗体(兔抗人)购于Santa Cruz;α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体(鼠抗人)、Triton X-100和过氧化物酶标记的α1GⅡ抗(羊抗兔) 购于武汉博士德公司;总RNA抽提Trizol reagment购于 Invitrogen;反转录试剂盒购于 Promega;Taq DNA聚合酶等PCR反应系统购于TaKaRa;ECL solution购于北京中山生物技术有限公司;BSA购于Roche;配胶试剂均购自Bio-Rad公司;细胞裂解液购于碧云天公司。
2方法
2.1HUASMCs原代、传代培养 原代培养(组织贴块法)根据Chamley-Campbell[4]的方法加以改进。取离体 3 h之内的新鲜脐带,分离脐动脉,纵行剪开血管,D-Hanks 缓冲液冲洗血管内壁数次,无菌刀片刮除内膜,撕下中膜平滑肌层,放入盛有DMEM/F12 培养液的培养皿中,剪成 0.5 mm×0.5 mm×0.5 mm-1 mm×1 mm×1 mm的小块,玻璃分针以3-5块/cm2的密度均匀种植于瓶底,慢慢翻转培养瓶,使贴有植块的瓶底朝上,少量培养液在下面,并追加培养液至每瓶1.0-1.5 mL,放入 37 ℃、5 %CO2培养箱内干涸4 h后,将培养瓶轻轻翻转,使植块刚好浸入培养液中。传代培养:用 0.25%胰酶消化液,根据细胞密度按 1∶2 或 1∶3 传代。原代培养用含20%胎牛血清的DMEM培养基,传代以后血清浓度逐渐降低到10%,2-3代的细胞用于实验。
2.2分组 培养的HUASMCs胰酶消化脱壁后,充分混合,随机分为3组。ET-1和Que的浓度分别参照綦惠等[5]和陈维等[6]的研究,药物与细胞作用24 h。(1)对照组:不加入任何药物;(2)Que组:加入Que 80 μmol/L;(3)模型组:加入100 nmol/L ET-1培养24 h;(4)实验组:加入Que 20、40和 80 μmol/L培养1 h,再加入100 nmol/L ET-1共同培养24 h。各组细胞培养基的血清浓度均为5%。
2.3免疫细胞化学鉴定 常规方法传代,调整细胞密度为1×108cells/L接种于 6 孔培养板,培养板中预先放入高压灭菌处理的盖玻片,待细胞长至 50%-70%融合后,将盖玻片从培养板中取出,室温下用PBS缓冲液冲洗 3 次,每次 5 min,冷丙酮溶液中固定 5 min,蒸馏水冲洗 3 次,每次 3 min,后续步骤按迈新公司 SP 试剂盒说明书进行,Ⅰ抗用α-SMA单克隆抗体。
2.4RT-PCR 用Trizol裂解细胞,按照Trizol reagment说明书提取总RNA,GeneQuant Pro紫外分光光度仪测A260/A280值,检测核酸纯度、计算核酸量。各样本均取2 μg总RNA,按照反转录试剂盒说明书合成cDNA。用于PCR的引物分别是:α1G上游引物5’-ACCTTACTACTCCGACTACTCC-3’, 下游引物5’-ACAGCCATCTTCAGCAGC-3’;GAPDH上游引物5’-TGCACCACCAACTGCTTAGC-3’, 下游引物5’-GGCATGGACTGTGGTCATGAG-3’。PCR的反应体系按照Taq DNA聚合酶(TaKaRa)说明书,反应条件:α1G:94 ℃ 5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,40个循环,72 ℃ 5 min。GAPDH:94 ℃ 4 min,94 ℃ 30 s,60 ℃ 30 s,30个循环,72 ℃ 4 min。GEL DOC 2000凝胶成像分析系统检测PCR产物的灰度值,各组数据以α1G/GAPDH作为mRNA表达的相对量。
2.5Western blotting样品的制备 蛋白裂解液裂解细胞,离心后取上清,测定蛋白浓度,加入buffer后煮沸变性,低温保存。 配制浓缩胶和10%的分离胶。SDS-PAGE 聚丙烯酰胺凝胶电泳:每孔上样量50 μg,浓缩胶 80 V、20 min,分离胶120 V,约75 min,电泳至溴酚蓝跑到凝胶底部。电泳后胶用转膜缓冲液平恒15 min。转膜和显影:以PVDF膜、滤纸和分离胶制备“夹心饼”,放入湿电转膜仪,100 mV 80 min。根据marker分子量找到目的条带(α1G:260 kD;β-actin: 46 kD),依次加入Ⅰ抗、Ⅱ抗,在曝光暗盒中加入ECL solution,X 光片曝光 5-10 min,显影液中显影1 min,定影液中定影1 min, 自来水冲洗,晾干。各组数据以α1G/β-actin作为蛋白表达的相对量。
2.6细胞电生理 在室温(20-25 ℃)下,用EPC-10(Heka)膜片钳放大器进行全细胞膜片钳记录。实验参数设置、数据采集和刺激方案施加均通过采样软件Pulse 8.8(Heka)来控制。玻璃微电极充灌电极内液后,电极阻抗为4-6 ΜΩ;形成全细胞模式后,封接电阻≥500 ΜΩ,串联电阻≤20 ΜΩ并补偿70%-80%进行电流记录。用Pulsefit (Heka)、Clampfit 10.0(Axon Instrument)及Origin 7.0(Microcal Software)分析绘图。在全细胞电压钳模式下,以硝苯地平(1 μmol/L)阻断L型钙通道,钳制电位-90 mV,给予一个-40 mV时程400 ms的单刺激,用LockIn程序计算出每个细胞的膜电容,该电容数值代表细胞表面积,测量出-40 mV下的全细胞电流峰值(pA),将该电流峰值除以细胞的膜电容(pF),得到细胞的电流密度(pA/pF),取各组的最大电流密度值作统计分析。
3统计学处理
结 果
1平滑肌细胞的鉴定
在倒置相差显微镜下观察,HUASMCs呈梭形或多边形,核呈椭圆形或杆状,胞浆均质,有时可见核仁,细胞可重叠生长达多层,高低起伏,呈典型的“峰-谷” 样生长。经平滑肌细胞特异性α- SMA免疫细胞化学染色,阳性细胞胞浆中有棕黄色颗粒,阳性率约为 95%,见图1、2。

Figure 1. Primary culture of HUASMCs(×100). Spindle-shaped or polygonal HUASMCs became confluent, showing typical “peak-valley”-like growth.
图1原代培养的HUASMCs呈“峰-谷”样生长

Figure 2. Immunocytochemical staining for α-SMC-actin in primary HUASMCs(×200). Expression of α-SMA(bfrown-yellow granules) was seen in the cytoplasm in about 95% cells.
图2HUASMCsα-SMA免疫细胞化学染色结果
2RT-PCR结果
各组RT-PCR的DNA电泳条带以溴化乙啶染色,在凝胶成像分析系统检测其灰度值,以α1G/ GAPDH作为各组α1GmRNA相对表达量,见图3。可以看出,模型组α1GmRNA表达最强;实验组(Que 20、40、80 μmol/L)次之,且呈剂量依赖性降低;对照组和Que组最小。除对照组和Que组无显著差异(P>0.05)外,其余各组差异显著(P<0.05)。模型组、实验组和对照组的α1GmRNA表达量不同,且依次递减,提示ET-1可使HUASMCs中α1GmRNA的表达增高,Que则对这种增高有剂量依赖性的抑制作用。
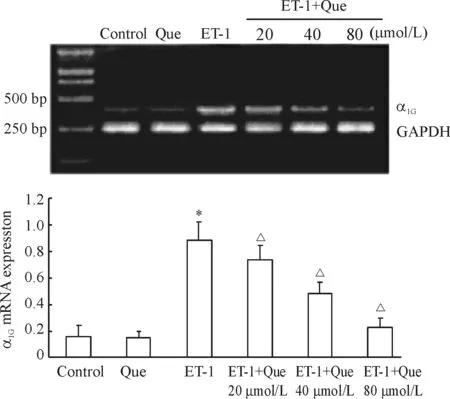

图3HUASMCsα1GmRNA表达
3Westernblotting结果
用Quantity One软件分析曝光后的各组底片条带,检测其灰度值,以α1G/ β-actin作为各组α1G蛋白的相对表达量。从图4可以看出,模型组的α1G蛋白表达最大,实验组次之,且呈剂量依赖性降低,对照组和Que组最小。除对照组和Que组无显著差异(P>0.05)外,其余各组差异显著(P<0.05),提示ET-1可使HUASMCs中α1G蛋白的表达增高,Que则对这种增高有剂量依赖性的抑制作用。


图4HUASMCsα1G蛋白表达
4电生理实验结果
记录钳制电位-90 mV下-40 mV、400 ms单刺激的电流,经计算得到各组的电流密度值,见图5。除对照组和Que组无显著差异(P>0.05)外,其余各组差异显著(P<0.05)。提示ET-1可增强HUASMCs中TCC的最大电流密度,Que则对这种增强有抑制作用。
讨 论
成人VSMCs增殖率非常低,但在病理状态下,VSMCs可以活化增殖,向内膜迁移并分泌细胞外基质,导致血管壁重构。在这一过程中,VSMCs的基因表型发生了明显变化,TCC表达增强就是其中之一。Kuga等[2]很早就发现在大鼠VSMCs中,TCC的表达与细胞周期有关,G0期能探测到TCC电流(ICaT)的VSMCs比例为0,而在G1期和S期这一比例上升到37%和90%。Rodman等[7]的研究则发现,在人肺动脉VSMCs中,构成TCC的是CaV3.1,应用针对CaV3.1的siRNA明显抑制TCC表达和细胞增殖,TCC阻滞剂也把VSMCs阻止在G0/G1期,同样抑制了细胞的增殖。


图5全细胞T型钙通道电流记录
根据以上的观察,TCC的表达可能是VSMCs活化的必要条件,促进VSMCs转化的一些内源性因素,如ET-1,必然要影响TCC的表达。Izumi等[8]对心肌的研究与这一假设类似,他们发现大鼠心肌由肥大到衰竭的过程中,内源性ET-1和心肌细胞α1GmRNA及蛋白的表达呈正相关,而且长期使用ET-1受体阻滞剂可以抑制ICaT和α1GmRNA的表达,从而减轻心肌衰竭的程度。ET-1是一种内源性激素,过高的ET-1被认为是心血管疾病最强的独立的预警信号[9]。
本实验以ET-1作用于原代培养的人脐动脉VSMCs,观察了ICaT的强弱和α1G的表达。结果显示,ET-1促进了α1G在mRNA和蛋白水平的表达,增强了ICaT,和上述的设想一致。ET-1很可能首先增强ICaT进而促进了VSMCs活化。ICaT的增强与构成TCC的各亚基都有关系,而且可以发生在各亚基的磷酸化、翻译、转录等各个水平,本实验结果仅提示ET-1可能通过在mRNA和蛋白水平增强了α1G的表达,进而使ICaT增强。至于ET-1是促进了α1G基因的转录还是增加了mRNA的稳定性,以及α1G蛋白的磷酸化是否增加,则有待进一步研究。目前关于ET-1影响TCC的研究结果也有矛盾之处,比如,Ferron等[10]对心肌细胞的研究显示ET-1增强ICaT的原因在于翻译后的调节,对mRNA没有影响。这提示ET-1调节ICaT的方式在不同细胞可能有所不同。
有报道Que拮抗LPS所致的肝细胞损伤[11],并通过多种机制拮抗ET-1诱导的VSMCs肥大、增殖、迁移和分泌,其中包括抑制ET-1诱导的细胞内过氧化物升高、PKC的激活等[12]。既然ICaT的增强是VSMCs活化的必要条件, ET-1导致了这种增强,那么抑制ICaT可能是Que拮抗ET-1的机制之一。以往研究中涉及Que对细胞钙电流和钙通道蛋白影响的不多,而且多局限于L型钙通道,Que对TCC及ICaT的影响则少有研究。本实验结果显示,对于ET-1诱导的HUASMCs中ICaT和α1G(mRNA和蛋白水平)表达的增强,Que均具有抑制作用。Que可能通过降低α1G基因的转录、减少下游蛋白质产物抑制了ET-1诱导的ICaT增强,这或许是Que拮抗ET-1促VSMCs活化的机制之一。
从以往的研究了解到,ET-1通过激活MAPK中的ERK1/2提高TCC和ICaT的表达[13],Que也可以通过抑制MAPK的磷酸化降低一些刺激因子导致的细胞增殖[14],因此,Que有可能通过MAPK途径抑制ET-1导致的TCC表达和ICaT增强。MAPK作为多种细胞信号通道的中心环节,可以被多种信号激活,所以Que也可能在其它环节上实现对ICaT的抑制。ET-1作用于7次跨膜的G蛋白偶联受体,Que则缺乏具体的受体途径,但 ET-1和Que对各种细胞内信号分子均有广泛影响,涉及到蛋白质、脂类、细胞内钙和活性氧等[15,16],因此要明确Que抑制ET-1诱导ICaT增强的机制还需要进一步的研究。
[1] Zhu Y, Zhang S, Xie W, et al. Iptakalim inhibited endothelin-1- induced proliferation of human pulmonary arterial smooth muscle cells through the activation of KATPchannel[J]. Vasc Pharmacol, 2008,48(2-3):92-99.
[2] Kuga T, Kobayashi S, Hirakawa Y, et al. Cell cycle-dependent expression of L- and T-type Ca2+currents in rat aortic smooth muscle cells in primary culture[J]. Circ Res, 1996,79(1):14-19.
[3] Ishizawa K, Izawa-Ishizawa Y, Ohnishi S, et al. Quercetin glucuronide inhibits cell migration and proliferation by platelet-derived growth factor in vascular smooth muscle cells[J]. J Pharmacol Sci, 2009,109(2):257-264.
[4] Chamley-Campbell J,Campbell GR,Ross R. The smooth muscle cell in culture[J]. Physiol Rev,1979,59(1):1-61.
[5] 綦 惠,商战平,王家富. 在内皮素-1 诱导增殖的血管平滑肌细胞中骨桥蛋白的表达[J]. 中西医结合心脑血管病杂志, 2005,3(10):871-874.
[6] 陈 维,章茂顺, 胡春玲,等.槲皮素及异鼠李素对人血管平滑肌细胞胶原合成的影响[J]. 中国动脉硬化杂志, 2005,13(3):320-324.
[7] Rodman DM, Reese K, Harral J, et al. Low-voltage-activated (T-type) calcium channels control proliferation of human pulmonary artery myocytes[J]. Circ Res, 2005, 96(8): 864-872.
[8] Izumi T, Kihara Y, Sarai N, et al. Reinduction of T-type calcium channels by endothelin-1 in failing heartsinvivoand in adult rat ventricular myocytesinvitro[J]. Circulation, 2003,108(20):2530-2535.
[9] Chao HH, Liu JC, Lin JW, et al. Uric acid stimulates endothelin-1 gene expression associated with NADPH oxidase in human aortic smooth muscle cells[J]. Acta Pharmacol Sin, 2008,29(11):1301-1312.
[10]Ferron L, Capuano V, Ruchon Y, et al. Angiotensin II signaling pathways mediate expression of cardiac T-type calcium channels[J]. Circ Res, 2003,93(12):1241-1248.
[11]矫 强,郭竹英,徐芒华,等.槲皮素对LPS诱导的体外培养肝细胞损伤的影响及机制[J].中国病理生理杂志,2009,25(6):1142-1146.
[12]Romero M,Jiménez R,Snchez M, et al. Quercetin inhibits vascular superoxide production induced by endothelin-1: Role of NADPH oxidase, uncoupled eNOS and PKC[J]. Atherosclerosis,2009,202(1): 58-67.
[13]Daou GB,Srivastava AK.Reactive oxygen species mediate endothelin-1-induced activation of ERK1/2, PKB, and Pyk2 signaling, as well as protein synthesis, in vascular smooth muscle cells[J]. Free Radic Biol Med,2004,37(2):208-215.
[14]Kyaw M, Yoshizumi M, Tsuchiya K, et al.Atheroprotective effects of antioxidants through inhibition of mitogen-activated protein kinases[J]. Acta Pharmacol Sin,2004,25(8):977-985.
[15]Touyz RM, Yao G, Viel E, et al. Angiotensin II and endothelin-1 regulate MAP kinases through different redox-dependent mechanisms in human vascular smooth muscle cells[J]. J Hypertens, 2004, 22(6):1141-1149.
[16]Bkaily G, Choufani S, Avedanian L, et al. Nonpeptidic antagonists of ETAand ETBreceptors reverse the ET-1-induced sustained increase of cytosolic and nuclear calcium in human aortic vascular smooth muscle cells[J]. Can J Physiol Pharmacol,2008,86(8):546-556.
Quercetininhibitsendothelin-1-inducedT-typeCa2+channelexpressioninhumanumbilicalarterialsmoothmusclecells
ZHOU Xiao2, SHANG Zhan-ping1, SI Yan-hong1, LI Wei-hong1, YU Feng-xiu1, WANG Jia-fu1
(1DepartmentofPathophysiology,TaishanMedicalCollege,Taian271000,China;2DepartmentofPathology,ShandongMedicalCollege,Linyi276002,China.E-mail:zhpshang@tsmc.edu.cn)
AIM: To investigate the effect of quercetin on endothelin-1-induced T-type calcium channel(TCC) expression in primary cultured human umbilical arterial smooth muscle cells for exploring the protective role of quercetin in cardiovascular system.METHODSHuman umbilical arterial smooth muscle cells were verified by immunocytochemistry. The cells in 2-3 passages were used and randomly divided into control group, quercetin alone group, model group and experimental group. The cells in control group were cultured without any drugs for 24 h. The cells in quercetin alone group were cultured with 80 μmol/L quercetin for 24 h. The cells in model group were cultured with ET-1 at the concentration of 100 nmol/L for 24 h. The cells in experimental groups were pretreated with quercetin for 1 h, then coincubated with 100 nmol/L ET-1 for 24 h. The concentrations of quercetin used in this study were 20, 40and 80 μmol/L, respectively. The expression of α1G, a TCC major subunit, was assayed at mRNA and protein levels by RT-PCR and Western blotting, respectively. The TCC currents(IcaT) were detected by the technique of whole-cell patch-clamp.RESULTSCompared with control and experimental group,ICaTdensity (P<0.01) and the expression of α1Gat mRNA (P<0.05) and protein (P<0.01) levels in model group were significantly increased. No significant difference in the results of quercetin alone group and control group was observed.CONCLUSIONThe protective roles of quercetin in cardiovascular functions are related to the depressive effects of quercetin on ET-1-induced increase in bothICaTdensity and the expression of α1Gat mRNA and protein levels in cultured human vascular smooth muscle cells.
Quercetin; Calcium channels, T-type; Vascular smooth muscle cells; Endothelin-1
R363
A
1000-4718(2011)03-0450-05
2010-06-23
2011-01-20
泰山医学院基金资助项目(No.2001086)
△通讯作者 Tel: 0538-6225010; E-mail:zhpshang@tsmc.edu.cn
10.3969/j.issn.1000-4718.2011.03.006
