甲壳素对铜的吸附性能研究
2011-10-21王惠君高伟彪
王惠君,高伟彪,毛 薇
(浙江海洋学院海洋科学学院,浙江舟山 316004)
铜是人体所必需的微量元素,缺少铜会发生贫血、冠心病等病症,严重时可导致免疫功能下降,但过量摄入铜亦会产生危害。铜作为原料的利用率很高,但若在加工过程中不进行处理,将会对环境造成污染。电镀、冶炼、金属加工、机器制造、矿山开采、石油化工等部门排放的废水都含有铜离子,其中以金属加工、电镀工厂所排废水含铜量最高,这种废水排入水体,将会严重影响水的质量。所以如何有效地去除Cu2+,一直是学者所关注的热点问题之一。目前世界上对Cu2+的处理方法主要有物理法、化学法、物理化学法、生物处理法。但这几种方法都有欠缺,如化学法中中和凝聚沉淀法虽然具有简单、安全、成本低、沉渣脱水性能好的优点,但反应速度较慢、沉渣量大、出水硬度高是它的缺点。近年来有关含N、O或P树脂吸附某些金属离子的研究比较活跃[1-7],螯合吸附法是处理Cu2+方法之一,它通过吸附剂表面的功能基螯合去除Cu2+,与普通的吸附剂相比,螯合吸附法具有与Cu2+的键合力更强,去除效果受溶液中干扰离子、有机剂的影响小的优点。甲壳素能通过分子中的氨基,羟基和其它基团与Cu2+形成具有类似网状的笼形分子,进行螯合,因此能有效地吸附和分离溶液中的Cu2+。甲壳素对铜元素的吸附以及解吸性质可为该甲壳素富集和提取铜元素以及该甲壳素在分析方法上的应用提供理论依据,无论是对环境保护、自然资源的综合利用,还是促进国民经济的发展都具有非常重要的意义。
1 材料
1.1 主要试剂和仪器
1.1.1 试剂
甲壳素(粗制的甲壳素:浙江大学提供,实验用的已经改良处理),pH 3.38~5.81缓冲溶液由NaAc~HAc配制;铜离子标准液由分析纯CuSO4·5H2O配制;其它试剂均为分析纯。
1.1.2 仪器
UV-1610PC紫外分光计(日本岛津);ZHWY—100C型恒温培养振荡器(上海智城有限公司);pHS—3C型pH计(上海雷速精密仪器厂);Burker-TENSOR27型红外光谱仪(德国普鲁克公司)。
1.2 吸附和分析方法
1.2.1 吸附平衡试验
称取一定量的甲壳素,加入一定体积的缓冲溶液,浸泡24 h后加入一定量的Cu2+标准液,在ZHWY—100C型恒温培养振荡器中恒温振摇至平衡,分析水相中Cu2+的平衡浓度,用下式计算分配比(D)。
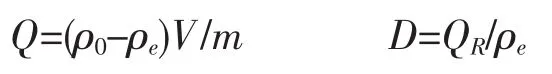
式中:Q为每克树脂的吸附量(mg/g);ρ0和ρe分别为水相中Cu2+的起始浓度(mg/mL)和平衡浓度(mg/mL);m为树脂质量(mg);V液相体积(mL)。
1.2.2 分析方法
取待测溶液0.25 mL置于25 mL的容量瓶中,加入1 mL 0.5%二甲酚橙和10 mL pH=5.73的HAc-NaAc缓冲液,用二次蒸馏水稀释至刻度。在波长576.3 nm处,用1 cm比色皿,试剂空白作参比,测定吸光度[7],从而求得吸附率和分配比。
1.2.3 解吸试验
称取一定量树脂,加入一定体积pH=4.56的HAc-NaAc缓冲液和一定量的Cu2+标准液,平衡后测定水相浓度,求得树脂对Cu2+的吸附量。分出剩余水相,然后用缓冲液洗涤树脂3次,再加入解吸剂,振荡平衡后测得水相Cu2+的含量,求得解吸率。
2 结果与讨论
2.1 介质pH对分配比的影响
准确称取 15.0 mg甲壳素 7 份,在 T=298 K,pH=3.38~5.81,ρ[Cu2+]0=167 μg/mL 的实验条件下,间歇振荡至平衡,测定在HAc-NaAc缓冲体系中树脂吸附Cu2+的性能,结果如图1所示。由图1可知,当pH=4.56时,Cu2+在HAc-NaAc体系中的吸附率达到最大,lgD=4.59。当pH大于4.56时分配比又有所下降,所以以下实验均选在pH=4.56的HAc-NaAc体系中进行。
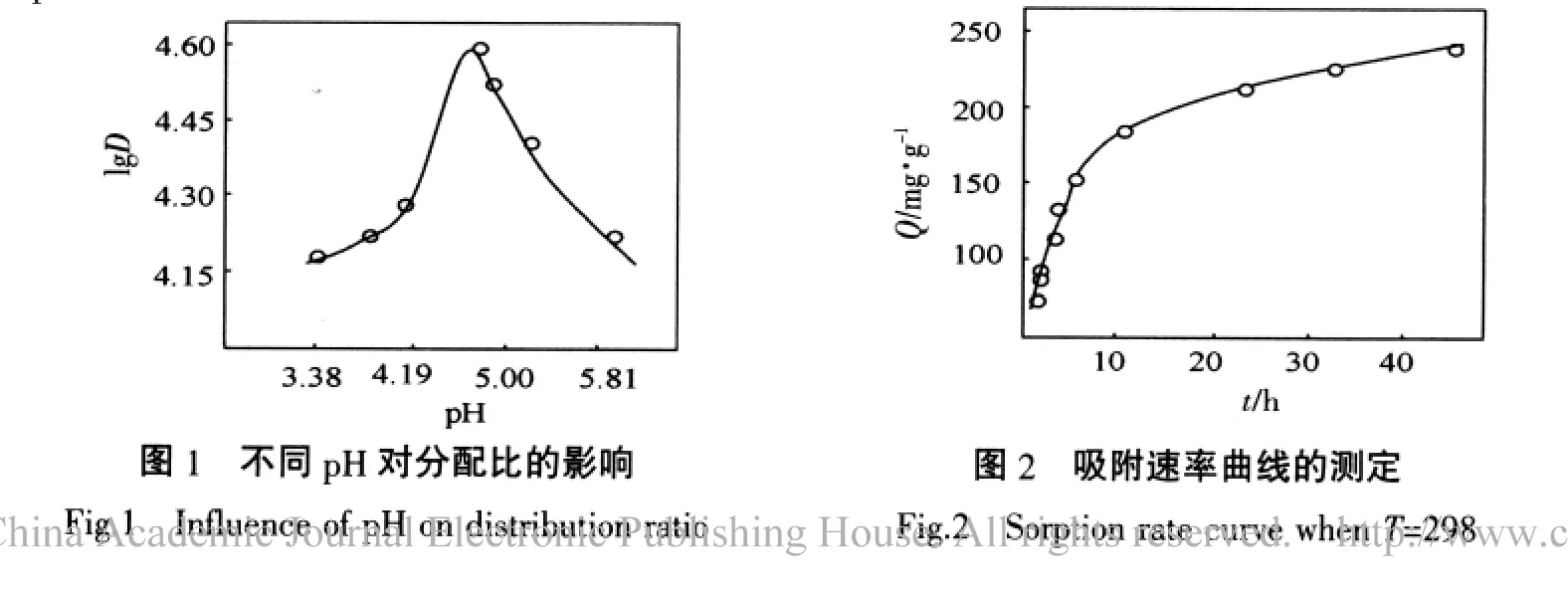
2.2 吸附速率及表观活化能的测定
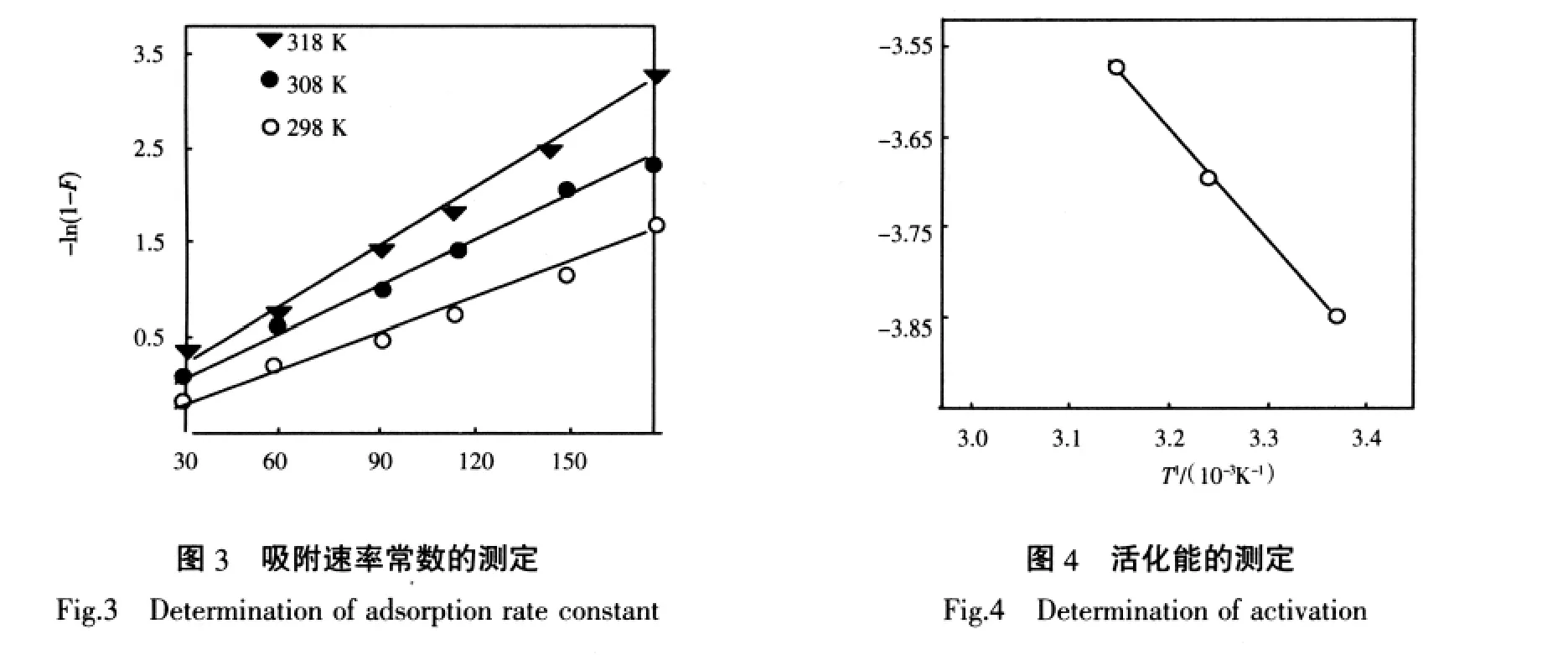
准确称取20.0 mg甲壳素,在T=298 K,pH=4.56,ρ[Cu2+]0=333 μg/mL的实验条件下,按吸附平衡试验每隔一定时间测定溶液中Cu2+的残余浓度,直至达到平衡,将测得的一系列数据,经体积校正后换算成相应的吸附量,以Q~t作图得到图2的曲线。Cu2+在甲壳素上的吸附,在开始阶段,符合速率方程-ln(1-F)=kt+c。上式中F=Qt/Q∞,Qt和Q∞分别为反应时间t和平衡时每克树脂的吸附量。以-ln(1-F)对t作图,得图3所示的直线,表明在该条件下,吸附动力学行为符合该方程。由直线斜率求得甲壳素吸附Cu2+的表观速率常数k298=1.34×10-4/s。由回归方程r=a+bx求得相关系数r=0.975 5。BOYD等认为若-ln(1-F)~t成线性关系,说明液膜扩散为吸附过程的主控步骤[8]。改变温度,其它条件和方法与上述相同,可分别得308 K和318 K时-ln(1-F)~t线性关系图(图 3),从而求得 k308=1.96×10-4/s,k318=2.68×10-4/s。根据Arrhenius公式 lgk=-Ea/(2.303RT)+lgA,以lgk~1/T 作图,得图4所示的直线,根据直线斜率k斜=-1.36×103,得表观活化能Ea=26.0 kJ/mol。
2.3 等温吸附曲线
准确称取 15.0、20.0、25.0、30.0、35.0 mg甲壳素 5 份,在 T=298 K,pH=4.56,ρ[Cu2+]0=467 μg/mL 的实验条件下,按吸附平衡试验进行,测得平衡浓度ρe(mg/mL),换算成相应吸附量Q(mg/g树脂),根据Freundlich等温式Q=aρe1/b,以lgQ对lgρe作图,得图5所示的直线,直线相关系数r=0.994 9,由此可求得常数b=3.03,b值在2~10之间,表明甲壳素对Cu2+的吸附容易进行[9]。
2.4 温度对吸附的影响及热力学参数的测定
准确称取20.0 mg甲壳素3份,在ρ[Cu2+]0=333 μg/mL,pH=4.56条件下,测得温度在 298 K、308 K、318 K时甲壳素吸附Cu2+分配比的变化。以lgD对1/(T×103)作图,结果如图6所示,直线相关系数r=0.999 0,由图6可知,升高温度对吸附有利,因而吸附过程是吸热过程,说明吸附反应是化学吸附。根据图6直线斜率k斜=-0.591×103,截距为 5.13。根据 lgD=-△H/(2.30RT)+△S/R,求得△H=11.3 kJ/mol,△S=42.6 J/(mol-·K)。当T=298 K时,△G=△H-T△S=-1.4 kJ/mol。表明甲壳素吸附Cu2+在该条件下自发进行。

2.5 铜的解吸与回收
解吸方法同1.2.3,用吸附等量Cu2+的甲壳素加入各30 mL 0.1~2.0 mol/L的HCl为解吸剂进行解吸,振荡平衡后测定水相含Cu2+量,结果见表1。为了考察HCl作为解吸剂的实用价值,用1.0 mol/L HCl洗脱进行了解吸速率测定,解吸时间4 min时,测得解吸率为50.6%,6 min解吸率达95.9%,10 min洗脱完毕。从动力学角度看容易进行,因此HCl可望作为实用解吸剂。
Cu2+被吸附后,用1.0 mol/L HCl洗脱,再用二次蒸馏水清洗树脂数次。进行3次再生测试,其结果显示:吸附容量几乎没有变化,证明甲壳素有非常优秀的再生能力。此树脂可再生并被重复利用。再生树脂的红外光谱图与原来树脂的谱图精确的达成一致。
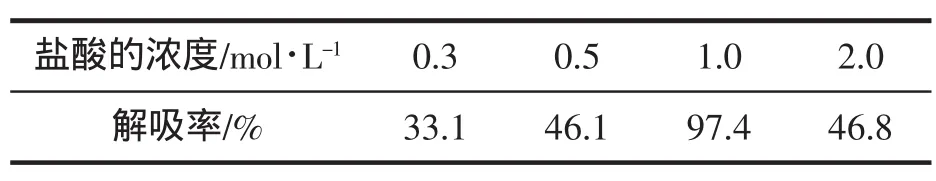
表1 不同浓度的盐酸的解吸率Tab.1 Rate of desorption in different concentration of hydroric acid
3 结论
(1)吸附条件试验表明,pH=4.56时该树脂对Cu2+静态饱和吸附容量为317.2 mg/g树脂;用浓度为1.0 mol/L HCl溶液作解吸剂,解吸率为97.4%。
(2)甲壳素吸附Cu2+的过程符合Freundlich经验式,且b=3.03值在2~10之间,说明吸附反应容易进行。
(3)甲壳素吸附 Cu2+热力学参数△H=11.3 kJ/mol;△S=42.6 J/(mol·K);△G=-1.4 kJ/mol。表观活化能 Ea=26.1 kJ/mol,表观速率常数 k298=1.34×10-4/s。
[1]相 波,刘亚菲.壳聚糖及其衍生物对重金属吸附性能的研究[J].工业水处理,2004(24):5.
[1]王惠君,施林妹,孙静亚.110*树脂对镝的吸附与机理研究[J].化学工程,2006,34(3):7-9
[2]XIONG Chunhua,SHU Zengnian,CHEN Yiyong.Studies on the sorption of macropourous phosphonic acid resin for lanthanum[J].Chinese Journal of Reactive Polymer,1998,7(2):7-15.
[3]WANG Huijun,XIONG Chunhua.Studies on the adsorption behavior and mechanism of macroporous phosphonic acid resin for Lutetium(Ⅲ)[J].Journal of china Ordnance,2006,2(2):112-116.
[4]王惠君,高伟彪,熊春华.氨基膦酸树脂对镥(Ⅲ)的吸附性能[J].矿物学报,2008,28(4):488-492.
[5]王惠君,孙静亚,刘美英.110*树脂对铒的吸附及机理研究[J].有色金属,2006,58(3):59-61.
[6]熊春华,吴香梅.大孔膦酸树脂对镉(Ⅱ)的吸附性能及其机理[J].环境科学学报,2000,20(5):627-630.
[7]马钦科Z着.元素的分光光度测定[M].郑用熙等,译,北京,地质出版社,1983:374.
[8]BOYD G E,ADAMSON A W,MYERS L S.The exchange adsorption of ions from aqueous solutions by organic zeolite.II Kinetics[J].J Amer Chem Soc,69:2 836-2 848.
[9]北川浩,铃木廉一郎.吸附的基础与设计[M].鹿政理,译.北京:化学工业出版社,1983:33.
[10]中本一雄.无机和配位化合物的红外和拉曼光谱[M].黄德如,汪仁庆,译.北京:化学工业出版社,1986:10.
