糖基化反应条件对乳清蛋白
——麦芽糖复合物抗原性的影响
2011-10-19李铮冯力更郑喆廖萍罗永康
李铮,冯力更,郑喆,廖萍,罗永康
(中国农业大学食品科学与营养工程学院,北京100083)
糖基化反应条件对乳清蛋白
——麦芽糖复合物抗原性的影响
李铮,冯力更,郑喆,廖萍,罗永康
(中国农业大学食品科学与营养工程学院,北京100083)
研究了将麦芽糖通过糖基化引入到乳清蛋白制备乳清蛋白-麦芽糖,用间接竞争ELISA法测定不同反应时间不同质量比的乳清蛋白-麦芽糖中α-乳白蛋白和β-乳球蛋白的抗原性的变化。结果表明,糖基化能有效降低α-乳白蛋白和β-乳球蛋白的抗原性,α-乳白蛋白的抗原性可以从26.2 mg/L降低到14.4 mg/L,β-乳球蛋白的抗原性可以从95.1 mg/L降低到22.4 mg/L。反应时间对不同质量比的乳清蛋白-麦芽糖中α-乳白蛋白和β-乳球蛋白的抗原性有较大影响。蛋白与糖的质量比为1~8时,反应相同时间的乳清蛋白-麦芽糖中α-乳白蛋白和β-乳球蛋白的抗原性随蛋白与糖的质量比的下降而下降。
乳清蛋白;麦芽糖;糖基化;抗原性
0 引言
乳清蛋白中的α-乳白蛋白和β-乳球蛋白是引起牛乳过敏的主要过敏原[1],通过改性降低乳清蛋白过敏原的主要方法有热处理、高压[2]、酶解[3]、糖基化、发酵[4]等。目前有一些关于糖基化反应降低乳清蛋白抗原性的报道,Enomoto等[6]将麦芽五糖结合到α-LA上,降低了α-LA的抗原性。Corzo-Martinez[7]将半乳糖和塔格糖引入到β-LG,有效的降低了β-LG的抗原性。另外有研究表明通过糖基化反应将低聚果糖和三甲基壳聚糖分别结合到大豆蛋白和卵清蛋白上,能有效的降低其抗原性[10,11]。
目前还没有关于将麦芽糖通过糖基化反应引入到乳清蛋白对α-LA和β-LG抗原性影响的研究,本研究旨在通过糖基化反应将麦芽糖引入到乳清蛋白制备乳清蛋白-麦芽糖,探索反应时间和蛋白与糖的质量比对乳清蛋白-麦芽糖中α-LA和β-LG抗原性的影响。
1 实验
1.1 材料
乳清分离蛋白(WPI);麦芽糖;α-乳白蛋白(α-LA),L5385;β-乳球蛋白(β-LG),L3908;兔抗α-LA血清(自制);兔抗β-LG血清(自制);HRP标记的羊抗兔IgG,A6154。
1.2 方法
1.2.1 WPI-麦芽糖的制备
将WPI和麦芽糖按照质量比8∶1,4∶1,2∶1和1∶1溶解于去离子水中,溶液最终质量浓度为100 g/L。将溶液于-60℃中预冻6 h后,在-60℃冷冻干燥24 h左右。将冷冻干燥制得的冻干粉放入底部盛有饱和KBr(相对湿度79%)的干燥器中,60℃反应0~120 h,所得WPI-麦芽糖共价复合物溶解于去离子水中,溶液最终质量浓度为100 g/L,再次冷冻干燥,得到的冻干粉于-20℃冰箱中贮存。同时,将WPI在相同的干热条件下处理作为对照样品。
1.2.2 色泽测定
420 nm波长是美拉德反应产生的棕色产物的特征波长。将糖基化复合物溶解于去离子水中,使溶液中蛋白质量浓度为1 g/L,测定其在420 nm处的吸光度值。
1.2.3 游离氨基酸残留量测定
采用三硝基苯磺酸法(TNBS法)。取0.25 mL的样品(1 L中含有的氨基量在0.25×10-3~2.5×10-3之间)与2 mL磷酸缓冲溶液(pH=8.2)和2 mL质量分数为0.1%的TNBS溶液混合,在50℃的暗室中放置60 min。反应完毕后,用4 mL浓度为0.1 moL/L的HCl终止反应,在室温下放置30 min,于420 nm下测其吸光值。用浓度为0~5.0×10-3moL/L亮氨酸作标准曲线,通过标准曲线转换成亮氨酸的浓度。游离氨基酸残留量即为糖基化反应后的WPI-麦芽糖中游离氨基酸的浓度与未反应的WPI中游离氨基酸的浓度的比值。
1.2.4 乳清蛋白-麦芽糖抗原性的测定
采用间接竞争ELISA法。
(1)抗原包被。用包被液(浓度为50 mmol/L,pH值为9.6的碳酸盐溶液)将一定质量浓度的抗原(α-LA质量浓度0.5 mg/L;β-LG质量浓度1 mg/L)包被于96孔酶标板,每孔100 μL,4℃过夜。
(2)样品和抗血清预混合。在反应管中加入蛋白质量浓度为0.1 g/L的样品(或标准品)和相同体积一定稀释度(α-LA,1︰256 000;β-LG,1︰128 000)的抗血清。不加样品(或标准品)只加抗血清的反应管作为无竞争体系,4℃冰箱过夜。
(3)洗涤。次日倾去孔内液体,PBST(PBS+0.05%Tween-20)洗涤4次,每次3 min,于吸水纸上拍干。
(4)封闭。加封闭液(PBS+1%BSA+0.1%Tween-20)进行封闭,每孔100 μL,37℃1 h,PBST洗涤4次,拍干。
(5)抗原抗体反应。加入(2)中样品和抗血清的预混液,每孔100 μL,37℃1 h,PBST洗涤4次,拍干。
(6)加酶标二抗。加入稀释10 000倍的羊抗兔IgGHRP标记物,每孔100 μL,37℃反应1 h,PBST洗涤4次,拍干。
(7)显色。加入新鲜配制的TMB底物溶液,每孔100 μL,37℃反应10 min,显示蓝色。
(8)终止反应。每孔加入浓度为2 mol/L的H2SO450 μL终止反应,颜色变为黄色。
(9)吸光值测定。利用酶标仪双波长测定各孔的OD450和OD630值,实际OD=OD450-OD630。
1.2.5 标准曲线的建立
将标准品稀释成系列浓度,进行间接竞争ELISA测定。将各浓度对应的OD值转换成B/B0%值,无抗原抑制时的OD值为B0,各相应浓度抗原抑制时的OD值为B,以B/B0%为纵坐标,以相对应浓度的对数lg[α-LA](或lg[β-LG])为横坐标,制作标准曲线。选择标准曲线上B/B0%与lg[α-LA](或lg[β-LG])呈明显相关的区段根据公式Logit(B/B0%)=ln[B/(B0-B)]计算各标准点的Logit(B/B0%),再做对应于lg[α-LA](或lg[β-LG])的Logit(B/B0%)回归分析,得出线性回归方程及相关系数。根据标准曲线计算各样品的抗原性。
2 结果与讨论
2.1 反应时间对WPI-麦芽糖的色泽的影响
图1为反应时间对不同质量比的WPI-麦芽糖色泽的影响。由图1可以看出,干热处理的WPI在420 nm处的吸光值仅有很少的增加,这可能是由于WPI所含的微量的乳糖与WPI发生了轻微的糖基化反应[12]。WPI与麦芽糖的糖基化产物在420 nm处的吸光值显著增加,这表明发生了糖基化反应,随着反应时间的延长及蛋白与糖质量比的降低,吸光值增加,即棕色物质逐渐增多,说明糖基化程度加深。

图1 反应时间对WPI-麦芽糖色泽的影响
2.2 反应时间对WPI-麦芽糖中游离氨基酸残留量的影响
图2为反应时间对不同质量比的WPI-麦芽糖游离氨基酸残留量的影响。糖基化反应会引起蛋白中游离氨基酸的变化。由图2可知,在60℃干热处理120 h的WPI的游离氨基酸残留量为90%,这可能是因为WPI与乳糖发生了轻微的糖基化反应。糖基化的WPI-麦芽糖中的游离氨基酸残留量显著降低,表明WPI与麦芽糖之间发生了交联。随着反应时间的延长及蛋白与糖质量比的降低,WPI-麦芽糖中游离氨基酸残留量逐渐降低,这表明糖基化程度加深。
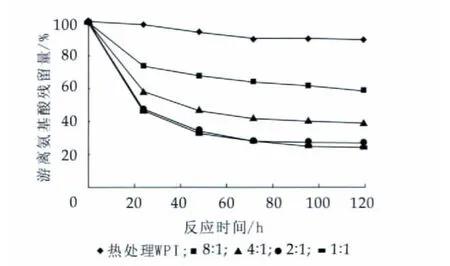
图2 反应时间对WPI-麦芽糖游离氨基酸残留量的影响
2.3 反应时间对WPI-麦芽糖抗原性影响
图3和图4为反应时间对不同质量比的WPI-麦芽糖中α-LA和β-LG抗原性的影响。由图3可知,热处理WPI中α-LA的抗原性随时间延长而增加,60℃热处理120 h时α-LA抗原性增加到196 μg/mL,与无处理的WPI相比,增加了6倍多。蛋白与糖质量比为1~8,糖基化产物中α-LA的抗原性随蛋白与糖的质量比的下降而下降,但是当蛋白与糖的质量比小于2时,增加糖的用量对α-LA的抗原性影响不大。本研究还测定了将蛋白与糖的质量比为4︰1时α-LA的抗原性,结果与质量比为2︰1的没有明显差距,因此在图3没有显示。不同比例的WPI-麦芽糖中α-LA的抗原性随反应时间的延长变化规律不同,蛋白与糖质量比为8︰1反应120 h内的糖基化产物中α-LA的抗原性随时间延长而显著增加;质量比为4︰1反应120 h内的糖基化产物中α-LA的抗原性随时间延长先略微降低然后升高,反应48 h后高于初始值;质量比为2︰1和1︰1反应120 h内的糖基化产物中α-LA的抗原性基本接近并且都低于初始值。Enomoto[6]研究表明,α-LA与麦芽五糖质量比2︰1,50℃反应72 h α-LA的抗原性略有降低,与本研究相似。

图3 反应时间对WPI-麦芽糖中α-LA抗原性的影响

图4 反应时间对WPI-麦芽糖中β-LG抗原性影响
由图4可以看出,热处理WPI中β-LG抗原性随时间延长而增加,60℃热处理120 h时β-LG抗原性从94 mg/L增加到194 mg/L。蛋白与糖质量比为1~8,糖基化产物中β-LG的抗原性随蛋白与糖的质量比的下降而下降,这与质量比对α-LA的抗原性的影响相似。蛋白与糖质量比为8︰1和4︰1反应120 h内的糖基化产物中β-LG的抗原性先降低后升高,质量比为4︰1的糖基化产物中β-LG的抗原性始终低于初始值;蛋白与糖质量比为2︰1反应24 h内β-LG抗原性显著降低,24-120 h随时间延长逐渐升高;蛋白与糖质量比为1︰1反应24 h内β-LG的抗原性显著降低,24~120 h内无显著变化。Hattori[8,9]等将壳聚糖、磷酰基低聚糖、海藻酸低聚糖通过糖基化反应结合到β-LG上,β-LG的抗原性降低的效果不同,与本研究中麦芽糖对β-LG的抗原性的影响也不同,这说明不同的糖对β-LG的抗原性的影响不同。
热处理WPI中α-LA和β-LG的抗原性随反应时间延长而增加,布冠好热处理WPI溶液也得到了相似的结果[14],这可能是由于蛋白空间结构的展开导致分子内部抗原表位的暴露[13]。WPI-麦芽糖中α-LA和β-LG的抗原性比热处理WPI中的低,说明糖基化能有效降低热处理WPI的抗原性,这可能是因为引入的麦芽糖屏蔽了WPI中的抗原表位。由图1和图2可知,120 h内糖基化程度随时间的延长而加深,但是α-LA和β-LG的抗原性并不是逐渐降低,这可能是因为糖基化屏蔽的表位和热处理暴露的表位同时影响糖基化产物的抗原性,当麦芽糖屏蔽的表位多于热处理暴露的表位时,抗原性低于初始值,当麦芽糖屏蔽的表位少于热处理暴露的表位时,抗原性高于初始值。
3 结论
(1)随着反应时间的延长,WPI-麦芽糖的颜色加深,游离氨基酸残留量降低,即糖基化程度增加。
(2)在一定条件下,WPI与麦芽糖糖基化能有效降低WPI中α-LA和β-LG的抗原性,WPI-麦芽糖中α-LA和β-LG的抗原性随蛋白与糖的质量比(1~8范围内)的下降而下降,反应时间对不同质量比的WPI-麦芽糖中α-LA和β-LG的抗原性的有较大影响。
(2)综合考虑抗原性低、糖的添加量小和反应时间短3个因素,最适反应条件为蛋白与糖的质量比为2︰1,反应24 h。
[1] SHARMA S,PRAVINDRA K,BETZEL C,et al.Structure and Function of Proteins Involved in Milk Allergies[J].Journal of Chromatograph B,2001,756:183-187.
[2] KLEBER N,MAIER S,HINRICHS J.Antigenic Response of Bovine β-Lactoglobulin by Ultra-High Pressure Treatment and Temperature[J].Innovative Food Science&Emerging Technologies,2007,8:39-45.
[3] GUADIX A,CAMACHO F,GUADIX E M,et al.Production of Whey Protein Hydrolysates with Reduced Allergenicity in a Stable Membrane Reactor[J].Journal of Food Engineeting,2006,72:398-405.
[4] KLEBER N,WEYRICH U,HINRICHS J,et al.Screening for Lactic Acid Bacteria with Potential to Reduce Antigenic Response of β-Lactoglobulin in Bovine Skin Milk and Sweet Whey[J].Innovative Food Science&Emerging Technologies,2006:233-238
[5]SUN Y,HAYAKAWA S,PUANGMANEE S,et al.Chemical Properties and Antioxidative Activity of Glycated α-Lactalbumin with a Rare Sugar,D-allose,by Maillard Reaction[J].Food Chemistry,2006,95(3):509-517.
[6] ENOMOTO H,HAYASHI Y,LI C P,et al.Glycation and Phosphorylation of α-Lactalbumin by Dry Heating:Effect on Protein Structure and Physiological Functions[J].Journal of Dairy Science,2009,92(7):3057-3068.
[7] CORZO-MARTINEZ M,SORIA A C,BELLOQUE J,et al.Effect of Glycation on the Gastrointestinal Digestibility and Immunoreactivity of Bovine β-Lactoglobulin[J].International Dairy Journal,2010,20(11):742-752
[8] HATTORI M,NUMAMOTO K,KOBAYASHI K,et al.Functional Changes in β-Lactoglobulin by Conjugation with Cationic Saccharides[J].Journal of Agricultural and Food Chemistry,2000,48(6):2050-2056.
[9] HATTORI M,MIYAKAWA S,OHAMA Y,et al.Reduced Immunogenicityofβ-LactoglobulinbyConjugationwithAcidic Oligosaccharides[J].Agricultural and Food Chemistry,2004,52:4546-4553.
[10] SLUTTER B,SOEMA P C,DING Z,et al.Conjugation of Ovalbumin to Trimethyl Chitosan Improves Immunogenicity of the Antigen[J].Journal of Controlled Release,2010,143(2):207-214.
[11] LAGEMAT J,MANUEL SILVAN J,JAVIER MORENO F,et al.In Vitro Glycation and Antigenicity of Soy Proteins[J].Food Research Internationa,2007,40(1):153-160.
[12] BOEKEL M A J S.Effect of Heating on Maillard Reactions in Milk[J].Food Chemistry,1998,62(4):403-414.
[13] KLEBER N,MARIER S,HINRICHS J.Antigenic Response of βlactoglobulin in Thermally Treated Bovine Skim Milk and Sweet Whey[J].Milchwissenschaft,2007,62(2):121-124.
[14] BU G,LUO Y,ZHENG Z,et al.Effect of Heat Ttreatment on the Antigenicity of Bovine α-Lactalbumin and β-Lactoglobulin in Whey Protein Isolate[J].Food and Agricultural Immunology,2009,20(3):195-206.
Effect of Glycosylation reaction conditions on the Antigenicity of WPI-Maltose Conjugate
LI Zheng,FENG Li-geng,ZHENG Zhe,LIAO Ping,LUO Yong-kang
(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)
Maltose was conjugated to WPI by means of glycosylation to form WPI-maltose.After the protein and sugar of different mass ratio reacting for different time,the antigenicity of α-LA and β-LG were estimated by indirect competition ELISA.The results indicated that the glycosylation of WPI can reduce the antigenicty of α-LA and β-LG.The antigenicity of α-LA can be reduced from 26.2 mg/L to 14.4 mg/L,and the antigenicity of β-LG can be reduced from 95.1 mg/L to 22.4 mg/L.Reaction time have much effect on the antigenicity of α-LA and β-LG in the WPI-maltose of different mass ratio.On condition of the same reaction time,the antigenicity of α-LA and β-LG were declined as the mass ratio of protein and sugar decreased from 8 to 1.
whey protein;maltose;glycosylation;antigenicity
Q936
A
1001-2230(2011)01-0008-04
2010-08-30
国家自然基金资助项目(30471224;30871817);“十一五”国家科技支撑项目(2006BAD04A06)。
李铮(1986-),女,硕士研究生,研究方向为乳品科学。
罗永康
