GC-MS法测定奶与奶制品中雌二酮残留量的研究
2011-10-19刘勇军刘创基姜艳彬吴银良雷春娟
刘勇军,刘创基,姜艳彬,吴银良,雷春娟
(1.中国动物疫病预防控制中心,北京100125;2.宁波市农业科学院,浙江宁波315000)
GC-MS法测定奶与奶制品中雌二酮残留量的研究
刘勇军1,刘创基1,姜艳彬1,吴银良2,雷春娟1
(1.中国动物疫病预防控制中心,北京100125;2.宁波市农业科学院,浙江宁波315000)
通过液液萃取和固相萃取提取、净化奶与奶制品中添加的雌酮,以TMS衍生化试剂BSTFA衍生化,气相色谱-质谱联用(选择离子模式,选择离子为m/z218、m/z244、m/z257、m/z342)对衍生物检测分析,确定了样品中雌酮的定性、定量分析方法,该法检出限为0.2 μg/kg,定量限为0.8μg/kg。衍生物的峰面积与样品质量浓度在0.5~1000 μg/L范围内呈良好的线性关系,线性回归系数为0.999。雌酮不同加入量的添加回收率为70.1%~93.6%,变异系数为2.0%~3.7%。该方法可实现对样品进行灵敏、准确的定性定量分析。
固相萃取;气质联用;雌酮;选择离子监测
0 引言
雌酮(Estrone,ESN),又名α-卵泡激素、雌甾酮、雌酚酮和雌激素酮,雌酮是甾类同化激素(anabolic steroids,Ass)中一种重要的雌激素[1],兽医临床用于同期发情和家畜促生长及提高饲料转化率。但长期摄入雌激素会导致女性化、性早熟,特别是雌激素类物质具有明显的致癌效应[1,2]。
雌酮的分析方法在有GC法[3]、酶联免疫法[4]、HPLC法[5,6]、放射免疫法[7]及HPLC-MS/MS法[8-12]、气相色谱-质谱联用法(GC-MS)[13-16]等检测方法,但通过检索文献发现,对于奶与奶制品中雌激素检测的研究报道还很少,因此作者在前期制定了国家标准“奶及奶制品中17β-雌二醇、雌三醇、炔雌醇残留检测-GC/MS法”的基础上,采用固相萃取技术,对奶与奶制品中的雌酮进行提取、净化处理,利用SIM(选择离子监测模式)-GC-MS定性、定量分析。
1 实验
1.1 主要仪器和试剂
主要仪器:AgilentGC6890/5973NMS,配有EI源和自动进样器;MiniShaker涡旋振荡器;Supersicol固相萃取仪;旋转蒸发器;高速离心机;E-EVAP氮吹仪;奥立龙868pH计,MILLI-Q超纯水器,SartoriusBL310电子天平,固相萃取小柱:C18(500mg,3mL)。
以下所用试剂,除特别注明者外,均为分析纯试剂,水为符合GB/T6682规定的二级水。
主要试剂:雌酮标准品(纯度99.0%Sigma公司);甲醇;乙酸铵;冰乙酸;乙腈(色谱纯);乙酸乙酯;正己烷;甲苯;N,O-双(三甲基硅烷基)三氟乙酰胺BSTFA(美国Supelco Park公司)。
1.2 色谱条件
色谱柱:DB-1MS毛细管柱(30m×0.25mm×0.25 μm),载气流量:He,1.0 mL/min,温度梯度:色谱柱起始温度100℃(保持1 min),以20℃/min的升温速率升至200℃(保持3 min),再以20℃/min的升温速率升至260℃(保持5 min),再以20℃/min的升温速率升至280℃(保持5 min);无分流进样,进样量1.0 μL,溶剂延迟8 min;EI源,电离电压70 eV,进样口温度220℃,离子源温度200℃,四极杆温度160℃,选择离子监测模式(SIM)。
1.3 样品处理
1.3.1 样品中雌酮的提取
1.3.1.1 液态样品
量取试料10.0 mL于50 mL离心管中,加入乙腈5 mL和乙酸乙酯15 mL,旋涡振荡3 min,以7 800 r/min离心5 min,收集上清液于另一50 mL离心管中,然后在残渣中重复提取1次,合并上清液,40℃水浴中旋转浓缩至近干,用1 mol/L氢氧化钠溶液6 mL分3次溶解,转移至另一50 mL离心管中,加正己烷20 mL旋涡振荡1 min,以7 800 r/min离心3 min,收集下层提取液,提取液中加1 mL浓度为2.0 mol/L乙酸铵溶液,用冰乙酸调pH值5.0~5.2,备用。
1.3.1.2 固态样品
称取(5±0.05)g样品于50 mL离心管中,加入乙腈5 mL和乙酸乙酯20 mL,加1 mL去离子水,旋涡振荡3 min,以7 800 r/min离心5 min,收集上清液于另一50 mL离心管中,然后在残渣中加乙腈5 mL和乙酸乙酯20 mL重复提取1次,合并上清液,其他同液态样品处理。
1.3.2 固相萃取净化样品
将上述溶液转移到已依次用甲醇5 mL、水5 mL活化的C18小柱上,然后分别用水5 mL和5 mL 40%甲醇水(甲醇∶水=4∶6,体积比)淋洗,抽干,再用甲醇5 mL洗脱,收集洗脱液,在40℃水浴中用氮气吹干。
在样液过柱和洗脱过程中流速控制在1 mL/min左右。
1.3.3 衍生化
将上述净化、吹干的试样至于60℃烘箱中干燥15 min,使试管内壁不存任何可视水分。取出冷却,加入100 μL甲苯和100 μL BSTFA试剂,盖紧塞子,在涡旋振荡器高速振荡1 min,置于80℃恒温加热器中衍生60 min。衍生后冷却至室温,用甲苯定容至0.5 mL,转移至2 mL进样瓶中,供气质联用色谱仪进样。同时用雌酮标准使用液作系列同步衍生。
1.4 标准溶液的配制及标准曲线的绘制
精密称取100 mg雌酮对照品置于100 mL棕色容量瓶中,用甲醇溶解后定容至刻度,摇匀,作为雌酮储备液。精密量取雌酮储备液1 mL,置于100 mL容量瓶中,用甲醇稀释至刻度,作为雌酮工作液。分别准确吸取一定量的标准工作液,用甲醇稀释、定容,配制成浓度为0.5~1000 μg/L标准溶液系列,各浓度标准溶液分别用100 μL的BSTFA衍生化试剂,按上述衍生化步骤衍生和气质分析。
2 结果与讨论
2.1 气相色谱-质谱分析
取浓度为10 mg/L雌酮用BSTFA衍生生成三甲基硅烷衍生物,进行GC-MS全扫描(MS为scan模式,碎片离子扫描范围为50~600)其scan分析模式质谱图如图1所示。从全扫描质谱可知,雌酮在BSTFA衍生化下进行GC-MS全扫描分析,能产生m/z192、m/z218、m/z232、m/z244、m/z 257、m/z285、m/z327、m/z342等系列特征碎片离子,根据质谱SIM模式的要求,分析物质产生的碎片离子应选择专属性强、丰度较高、基线本底低、受外源组分干扰少、空白样品不产生所选择的特征碎片或产生信号特别低。通过试验发现,m/z 327虽然特征性强,丰度也较高,但在空白样品中也检测到存在有较强的m/z 327离子峰,且在添加样品检测中发现m/z 327的本底较高,故特征碎片离子m/z327不予选择,而特征碎片离子m/z192和m/z232由于丰度太低,也不适合作为SIM模式的选择性特征离子,所以本方法选择m/z218、m/z244、m/z257和m/z342作为雌酮的选择监测特征离子。

图1 标准样品中雌酮的质谱图
2.2 衍生化条件的选择
雌酮结构(见图2)中含有羟基、酮基和芳环,侧链C3、C17为极性基团,低挥发性,因此不适合直接进行GC/MS分析。常用的解决办法就是将其C3羟基和C17酮基衍生化(硅烷化、酰化和烷基化)为醚类。
实验中选用了七氟丁酸酐(HFBA)、N-甲基-N-三甲基硅基三氟乙酰胺(MSTFA)、N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA)和MSTFA-TMIS-DTE四种衍生化试剂进行比较。结果表明,MSTFA-TMISDTE较其它衍生三种衍生效果差一些,效率最高的为BSTFA衍生试剂,能得到较强的分子离子峰。所以本方法采用BSTFA作为衍生化试剂。由于衍生化试剂遇水立即分解且衍生物遇水也容易分解,因此在衍生化操作中应特别注意避免接触水。

图2 雌酮分子结构
2.3 回归方程、线性范围及检出限
配制雌二醇质量浓度分别为0.5,5,10,50,100,500,1 000 μg/L系列标准溶液,按照本方法进行衍生测定。测定得出雌二醇浓度与峰面积在0.5~1 000 μg/L范围839.内呈现良好线性关系;以y表示峰面积A,x表示组分质量浓度C(μg/L),求得回归方程为y=3.25×102x+3.27×103,相关系数R2=0.999;通过回收率,当样品中添加质量分数为0.2 μg/kg雌酮时,信/噪比(S/N)大于3,当样品中添加质量分数为0.8 μg/kg雌酮时,信/噪比(S/N)大于10,所以本方法确定雌酮的检出限为0.2 μg/kg,定量限为0.8 μg/kg,好于国内相关文献对雌酮检测(GC/MS法)的灵敏度要求。
2.4 不同标准品加入量的回收率及重复性
在不同样品中分别添加1,5和10 μg/L雌酮,按本研究方法进行提取、净化和衍生化,GC-MS分析结果如表1所示。标准样品和添加样品总离子(TIC)色谱图和选择监测离子质谱图如图3~图5所示。
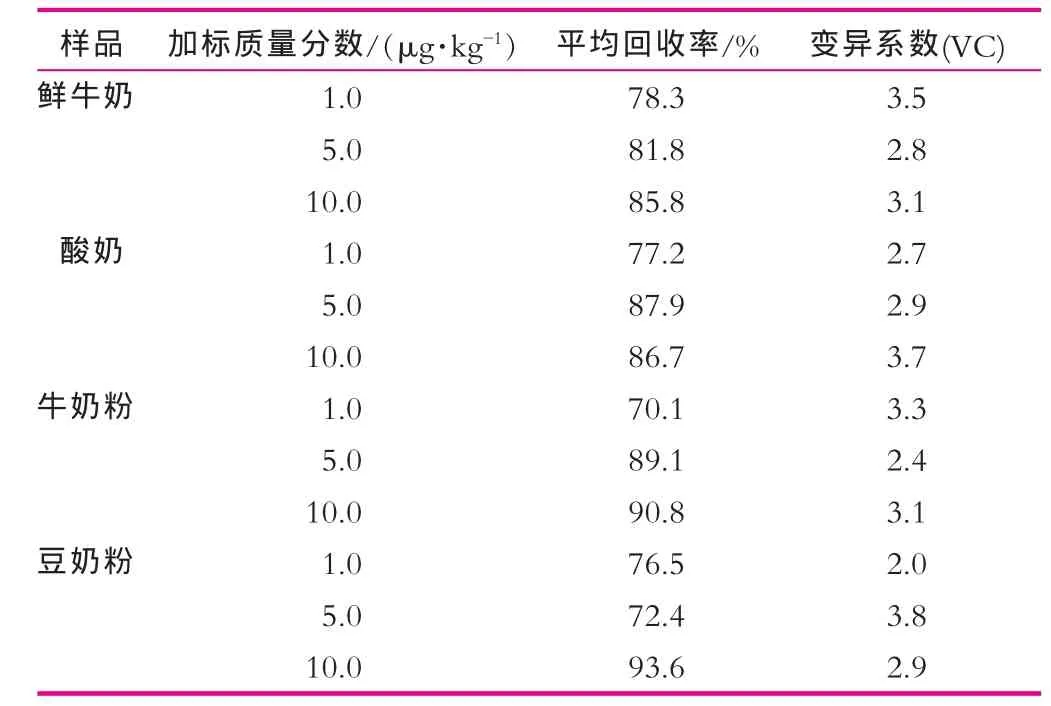
表1 雌酮在样品中不同添加浓度的回收率和精密度

图3 标准品中雌酮的色谱图
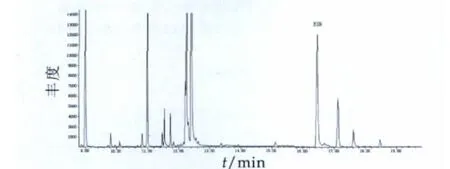
图4 样品加标色谱图
由表1可以看出,分析方法重复性良好,相对标准偏差为2.0%~3.7%,雌酮不同加入量的加标回收率分别为70.1%~93.6%。
2.5 阴性对照品的检测
称取样品俩份,按添加样品相同的步骤提取、净化、衍生,GC-MS分析,均未检测出雌酮,且添加样品雌酮色谱出峰处未见明显杂峰,干扰较少。空白色谱图如图6所示。
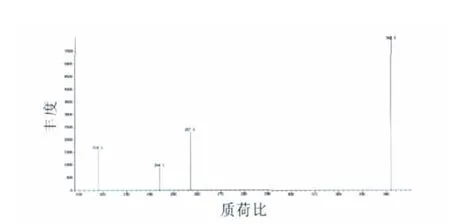
图5 选择监测离子质谱图
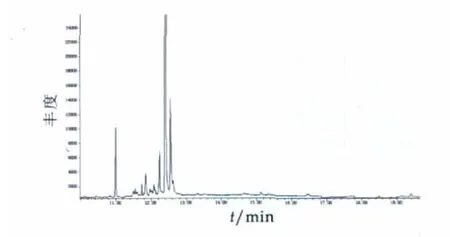
图6 空白样品色谱图
3 结论
本文所建立的奶与奶制品中雌酮测定方法准确可靠,重现性好,回收率满意,操作较简便,为国家建立相应的检测方法和标准提供了科研思路和科学技术参考,同时为打击不法分子使用雌酮提供了技术保证。
[1] 李俊锁,邱月明,王超,等.兽药残留分析[M].上海:上海科学技术出版社,2002:584-585.
[2] BRUEGGEMEIER R W.Male Sex Hormones,Analogs,and Antagonists.In:Wolff M E Ed.Burger’s Medical Chemistry and Drug Discovery[M].John Wiley&Sons,Inc,1996:445.
[3] 李亢宗,李兆琳,李俊.气相色谱法测定孕妇尿中痕且雌三醇和雌酮[J].色谱,1988,6(5):305-307.
[4] 阳春,胡碧波.污水处理中雌酮的定量分析[J].重庆大学学报,2009,32(6):718-720.
[5] 涂晓明,罗仁才,孙醇,等.高效液相色谱法同时测定食品5种激素[J].中国食品卫生杂志,1995,7(4):5-8.
[6] 王凌云,李洁珍,黎敏,等.高效液相色谱法测定水产品中4种雌激素的残留量[J].化学分析计量,2005,14(4):38-40.
[7] FRANK Z.Use of 125I-Histamine-Labeled Steroid Derivatives as Radioligands for Radioimmunoassay of Natu-Ral and Synthetic Steroids[J].J Steroid Biochem,1981,14:53-62.
[8] 邵兵,杨奕,张晶,等.动物源食品中激素多残留检测方法液相色谱-质谱/质谱法,GB/T 21981-2008[S].
[9] ELEANOR D,LAURIANE R,BRUNO L B,et al.Determination of Hormonal Growth Promoters in Bovine Hair:Comparison of Liquid Chromatography-Mass Spectrometry and Gas Chromatography-Mass Spectrometry Methods for Estradiol Benzoate and Nortestosterone Decanoate[J].Analytica Chimica Acta,2009,637:165-172.
[10] GEORGE K,GEORGIOS T,THEMISTOKLIS D.Determina-Tion of Anabolic Steroids in Bovine Urine by Liquid Chrom-Atography-Tandem Mass Spectrometry[J].Jounal of Chroma-Tography B,2009,877:2330-2336.
[11] 陈慧华,应永飞,吴平谷,等.液相色谱-串联质谱同时测定动物组织中22种同化激素[J].分析化学,2009(2):181-186.
[12] XIONG Z L,SUN X H,HUO T G,et al.Development and Validation of UPLC-MS/MS Method for Simultaneous Determination of Gestodene and Ethinyl Estradiol in Rat Plasma[J].BiomedChromatogr,2010,24:160–168.
[13] HU R K,ZHANG L F,YANG Z G.Picogram Determination of Estrogens in Water Using Large Volume Injection Gas Chromatography–Mass Spectrometry[J].Anal Bioanal Chem,2008,390:349-359.
[14] ASIER V,ARESATZ U,IRANTZU M A,et al.Ultrasonic-Assisted Derivatization of Estrogenic Compounds in a Cup Horn Booster and Determination by GC-MS[J].J.Sep.Sci.,2010,33:104-111.
[15] MARIE D,PIERRE L,ANNE T,et al.Simple Methodology Coupling Microwave-Assisted Extraction to SPE/GC/MS for the Analysis of Natural Steroids in Biological tissues:Application to the Monitoring of Endogenous Steroids in Marine Mussels Mytilus sp[J].Analytica Chimica Acta,2010,657:28-35.
[16] 吴平谷,王强,应永飞,等.核素内标结合固相萃取测定动物肌肉组织中16种同化激素残留[J].中华预防医学杂志,2008,42(11):836-839.
Determination of estrone in milk and milk product with Gas Chromatography-Mass Spectrometry
LIU Yong-jun1,LIU Chuang-ji1,JIANG Yan-bin1,WU Yin-liang2,LEI Chun-juan1
(1.China Animal Disease Center,Beijing 100125,China;2.Ningbo Academy of Agricultural Sciences,Ningbo 315000,China)
The residual veterinary drug of estrone in milk and milk product was extracted and purified by the method of liquid-liquid partition and solid phase extraction.The estrone was separated and validated by gas chromatography spectrometry(selected ion mode,the selected ions m/z 218,m/z 244,m/z 257 and m/z 342)after derivatization of the purified sample with the TMS derivative reagent of BSTFA,and the qualitative and quantitative analysis method was developed.Its LOD and LOQ is 0.2 μg/L and 0.8 μg/kg,respectively.and there was a good linear correlation between the ratio of peak areas and the concentration of estrone in the add range of 0.5~1000 μg/L,the correlative coefficient is 0.999,the recoveries of different concentration of estrone was 70.1%~93.6%.The RSD of the method was between 2.0%and 3.7%.The method is suitable for the qualitative and quantitative analysis of estrone in the milk and milk product.
solid phase extraction;Gas chromatography-Mass Spectrometry;estrone;selected ion monitoring
TS252.7
A
1001-2230(2011)01-0045-03
2010-09-09
刘勇军(1976-),男,工程师,主要从事药理毒理与兽药残留研究工作。
