激素对转基因雪莲毛状根植株再生及类黄酮产生的影响
2011-09-29乔献丽蒋曙光吕晓芬李凤霞赵德修
乔献丽,蒋曙光,吕晓芬,李凤霞,赵德修
1 中国科学院植物研究所 光合作用与环境分子生理学重点实验室,北京 100093
2 中国科学院研究生院,北京 100049
3 河南中医学院第一附属医院,郑州 450000
激素对转基因雪莲毛状根植株再生及类黄酮产生的影响
乔献丽1,2,蒋曙光3,吕晓芬1,2,李凤霞1,2,赵德修1
1 中国科学院植物研究所 光合作用与环境分子生理学重点实验室,北京 100093
2 中国科学院研究生院,北京 100049
3 河南中医学院第一附属医院,郑州 450000
为了研究外源激素 GA3和IAA对 3个转基因新疆雪莲类黄酮高产毛状根系C17、C27、C46的植株再生及其总黄酮含量的影响,在培养基中添加不同浓度的GA3和IAA,结果发现,GA3浓度高于1.0 mg/L时,可诱导毛状根系产生不定芽,其中以GA3浓度为2.0 mg/L时,转基因毛状根系C17的不定芽再生率最高,可达82%。高压液相色谱以及紫外分光光度法测定结果表明,与未用激素处理的毛状根和它的再生植株相比,外源激素GA3和IAA能显著提高毛状根培养物中芹菜素和总黄酮的含量。毛状根系的组织干重与类黄酮的含量没有相关性,但毛状根系的再生率与类黄酮的含量几乎呈反相关性。
新疆雪莲,植物激素,植株再生,毛状根,类黄酮
Abstract:We investigated the plant regeneration and production of flavonoids in three high-yield flavonods transgenic Saussurea involucrata hairy roots C17, C27 and C46 by quantification of two phytohormones GA3and IAA. The results showed that GA3concentration at more than 1.0 mg/L could induce adventitious shoots in the hairy root lines. The highest shoot regeneration rate,about 82%, was obtained when the hairy roots C17 were cultured with 2.0 mg/L GA3. The results on HPLC and UV spectrophotometry showed that exogenous application of both GA3and IAA increased the content of flavonoids in the hairy roots.The contents of flavonoids and apigenin in the hormone-treated hariy roots and regenerates were higher comparing with those in the untreated hairy roots and the regenerates. However, the content of flavonoids was not related to tissue weight, and was negativelyrelated to the regeneration efficiency.
Keywords:Saussurea involucrata, phytohormones, plant regeneration, hairy root, flavonoids
新疆雪莲Saussurea involucrate Kar. et Kir.为菊科 (Compositae) 凤毛菊属多年生草本植物,是我国著名的传统中药材,具有散寒除湿、活血通经、抗炎、镇痛等功能,其主要活性成分为类黄酮物质[1],如芹菜素 (5,7,4'-trihydroxyflavone) 具有抑制肿瘤形成和抗炎的功能[2-3]。雪莲生长在海拔2 400米至4 000米的石缝、砾石坡和湿润沙地上,属于生长期较长的耐寒植物,通常需用5年时间才能生长成熟。由于雪莲药用价值高、资源贫乏,已被列为国家三级保护渐危植物[4]。但掠夺式盗挖依然触目惊心,已经威胁到了雪莲物种的生存。现在最紧迫的任务是一方面应该更加有力地保护雪莲的自然资源,另一方面应该积极探索扩大雪莲药源供应的新渠道。
为保护我国频危物种资源、满足雪莲临床需求,本实验室率先建立了雪莲毛状根培养体系[5]。在适宜条件下,毛状根可以再生成完整植株,这一特点与DNA重组技术相结合,对植物基因工程的发展具有重要价值,因此Ri质粒是理想的基因工程载体。目前由Ri质粒介导转化的转基因植物再生在很多种属中获得了成功。由毛状根再生的植株通常表现出一些特定的可遗传的表型变异,在植物育种和品种改良等方面有巨大的参考应用价值[6-7]。
外源植物激素对毛状根的形态、生长情况、次生代谢物的产量以及再生成苗均具有很大影响[8-11]。为提高雪莲毛状根再生能力、以及再生苗的生长速率和有效成分的含量,本研究在前期工作[5]的基础上选择了3个SmChi (水母雪莲查尔酮异构酶基因)转基因毛状根系。这些毛状根系的总黄酮含量明显高于未转基因的毛状根系,转基因毛状根再生苗携带提高类黄酮的关键基因,可提高再生苗中类黄酮含量。本文以SmChi 转基因毛状根系为材料,研究了外源植物激素对转基因毛状根系诱导、植株再生和类黄酮物质合成的影响。为建立转基因雪莲毛状根再生植株体系,我们利用植物次生代谢工程技术以及利用转基因技术进行分子育种,为解决雪莲资源贫乏提供参考。
1 材料与方法
1.1 实验材料
新疆雪莲 Smchi转基因类黄类酮高产毛状根体系 (C17、C27、C46) 由本实验室保存[5],Smchi基因是本实验室从水母雪莲Saussurea medusa Maxim cDNA文库里克隆的查尔酮异构酶 (Chalcone isomerase,CHI),并命名为 Smchi基因。在装有1/2 MS无激素液体培养基的三角瓶中,弱光培养,18 d继代1次。摇床转速为110 r/min,培养温度为25 ℃。
1.2 不同浓度的 GA3对 C17、C27、C46不定芽诱导率的影响
选取生长旺盛 (约18 d) 的3个转基因根系,分别切取5 cm根尖接种于含0、1.0、1.5、2.0 mg/L GA3的1/2 MS液体培养基上,每瓶接种15条根尖,每一种处理为5瓶,试验重复3次。
1.3 不同浓度的IAA、GA3对C46毛状根系类黄酮合成的影响
将 IAA、GA3分别以相同的浓度梯度 0、0.1、0.2、0.5、1 mg/L同时添加到含有新转接的C46毛状根根尖的1/2 MS液体培养基里,每瓶接种13条,每条长约5 cm。新接种的毛状根取自于同一批生长18 d的C46。同时做3个重复。
1.4 Smchi转基因雪莲毛状根系与再生苗生长及类黄酮含量测定
将3个转基因株系 (C17、C27、C46) 和再生苗以及对照物分别在MS中添加0.5 mg/L GA3激素的培养基上培养。记录接种时材料的重量,20 d后,将试管苗收获,并记录重量,然后将材料置于50 ℃烘箱中烘至恒重。
1.5 毛状根干重的测定
收集生长18 d的新疆雪莲毛状根,蒸馏水冲洗干净,滤纸吸干后,称取鲜重 (FW)。置于50 ℃烘箱中烘干至衡重,称量其干重。
1.6 总黄酮含量的测定
采用Beckman Coulter的DU640可见-紫外分光光度计进行比色法测定[12]。测定波长510 nm,其芦丁标准品与其吸光度的直线方程:c=0.08089A−0.0005324 (其中,c表示总黄酮的浓度,单位是mg/mL,A为光的吸收变量),相关系数r=0.9991。以标准品芦丁 (Rutinum,C27H30O18·3H2O) 的含量进行换算。
1.7 新疆雪莲再生苗及毛状根的芹菜素 (HPLC)和总黄酮含量的测定
芹菜素的含量通过高效液相色谱 (HPLC) 法测定,样品处理及检测方法参照文献[5]。芹菜素标准品浓度与峰面积的直线方程:c=28.242A−24.079(其中c表示芹菜素的浓度,单位是μg/mL;A表示峰面积),r=0.9981,测定波长337 nm。仪器型号:Agilent 1100系统 (Agilent,USA),反相色谱柱Zorbax 300SB-C18 (250 mm×4.5 mm,4 μm)。总黄酮含量测定同上述1.3。
1.8 C17、C27、C46根系再生苗的PCR检测
毛状根再生植株 DNA的提取:按照参照文献[13]的方法进行。所使用的CHI基因PCR扩增的上游引物为:5′-CCCACTATCCTTCG-3′;下游引物为5′-GCATGAGAGCTCTGGGCACACAGATGATTT-3′,预期大小403 bp,而PCR反应条件为:94 ℃预变性 4 min;94 ℃变性 1 min,56 ℃退火 1min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。
2 结果
2.1 GA3对转Smchi基因新疆雪莲毛状根植株再生的影响
在检测过的10多个毛状根系中,C46毛状根系的总类黄酮含量以及该根系中CHI基因的表达量和酶活性最高[5]。表 1为 GA3不同浓度对新疆雪莲毛状根系C46不定芽诱导和不定芽生长的影响。从表1可见,GA3对新疆雪莲毛状根不定芽的诱导具有显著作用,当3个毛状根系在不加激素的1/2 MS基本培养基上培养至培养周期结束时 (35 d),都没有不定芽的产生;而当 3个毛状根系在附加 1.5 mg/L GA3的1/2 MS培养基上培养时,以毛状根系C17的不定芽诱导率较高,可达75%;继续增加GA3浓度至2.0 mg/L时,不定芽再生率最高,其中C17可以达到 82%。不同的毛状根根系对 GA3的诱导反应也不同,添加相同浓度的GA3,根系C17和C27不定芽的诱导率较高,根系 C46诱导效率相对较低(表 1)。
GA3对转基因新疆雪莲毛状根系C46不定芽的诱导在形态上具有显著变化,在1/2 MS培养基上培养至培养周期结束时 (35 d),附加1.0 mg/L GA3的1/2 MS培养基的毛状根有少量的不定芽形成 (图1A),其毛状根系不定芽的诱导率最低 (表1)。而在附加1.5 mg/L GA3的1/2 MS培养上培养的毛状根不定芽生长健壮 (图1B),此时毛状根系不定芽的诱导最高 (表1)。但当GA3浓度增至2.0 mg/L时,毛状根的不定芽较细弱,玻璃化严重,继续培养褐化严重,不易成活 (图1C),毛状根的不定芽的诱导率开始下降 (表1)。

图1 GA3浓度对新疆雪莲毛状根C46根系不定芽诱导和不定芽生长的影响Fig. 1 The effects of concentration of GA3on the induction of adventitious shoot and shoot growth of hairy root line C46. (A)1.0 mg/L GA3. (B) 1.5 mg/L GA3. (C) 2.0 mg/L GA3.

表1 GA3浓度对新疆雪莲毛状根不定芽诱导率的影响Table 1 Effects of concentration of GA3on induction efficiency of adventitious shoot
2.2 IAA、GA3不同浓度对毛状根系 C46类黄酮化合物合成的影响
图2为IAA对C46根系类黄酮化合物合成的影响。从图2可见,IAA (0.1~1 mg/L) 能够提高毛状根中黄酮含量。当IAA浓度为0.2 mg/L时,每克毛状根干重的类黄酮含量达到最大,为 29.7 mg/g干重。IAA浓度继续增加,类黄酮含量逐渐减少,最后当IAA浓度为1 mg/L时,类黄酮含量与不加任何激素处理的毛状根处于同一水平。图 3为 GA3对C46根系类黄酮化合物合成的影响。由图3可以看出,GA3 (0.1~1 mg/L) 能够显著促进C46毛状根中类黄酮含量的增加。当GA3浓度为0.5 mg/L时,每克毛状根干重的类黄酮含量达到最大,为 43 mg/g干重,是无激素培养条件下的1.6倍。当GA3浓度增加为1 mg/L时,类黄酮含量开始下降。

图2 不同IAA浓度对雪莲毛状根系C46干重和总黄酮含量的影响Fig. 2 Effect of concentration of IAA on dry weight and flavonoid content. Each value is the x± s from three independent experiments.
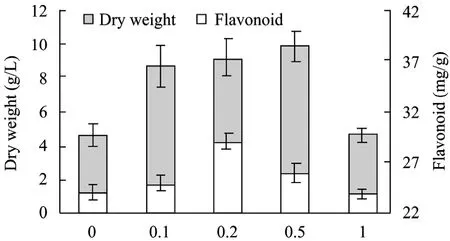
图3 不同 GA3浓度对雪莲毛状根系 C46干重和总黄酮含量的影响Fig. 3 Effect of concentration of GA3on dry weight and flavonoid content. Each value is the x± s from three independent experiments.
2.3 新疆雪莲毛状根与再生植株芹菜素和总黄酮含量的测定
在植物生长发育过程中,植物体内的次生代谢活动会受到影响,次生物质的含量和组成会发生很大的变化[10-11]。由毛状根诱导出的新疆雪莲再生苗经过 3周的继代培养 (所用培养基中 GA3浓度为0.5 mg/L),结果发现与各自来源的毛状根相比,毛状根再生苗的芹菜素和总黄酮含量都下降了 20%~30%,其中株系C46芹菜素含量下降了26%,总黄酮含量下降了21% (图4)。但与对照组培苗 (Control-1)和农杆菌感染的毛状根再生植株 (Control-2) 相比,35S-Smchi转基因再生植株的芹菜素和总黄酮含量都有显著提高,其中株系C46芹菜素和总黄酮含量分别为 1.86 mg/g干重和 37.3 mg/g干重,分别为Control-1的12倍和2.4倍,Control-2的4倍和1.6倍 (图5)。HPLC测定结果显示:芹菜素标准样品与毛状根系 C46再生苗芹菜素的保留时间是一致(图 6)。
2.4 再生苗的PCR检测
对再生株系 (C17、C27、C46) 的Smchi基因的PCR检测结果显示 (图7),所选的几个根系都检测出了同阳性对照一样大小的条带,而在来源于野生型毛状根转化的对照再生苗,则没有检测到相应的条带。表明在新疆雪莲毛状根植株再生的过程中,其携带的外源基因并没有丢失。
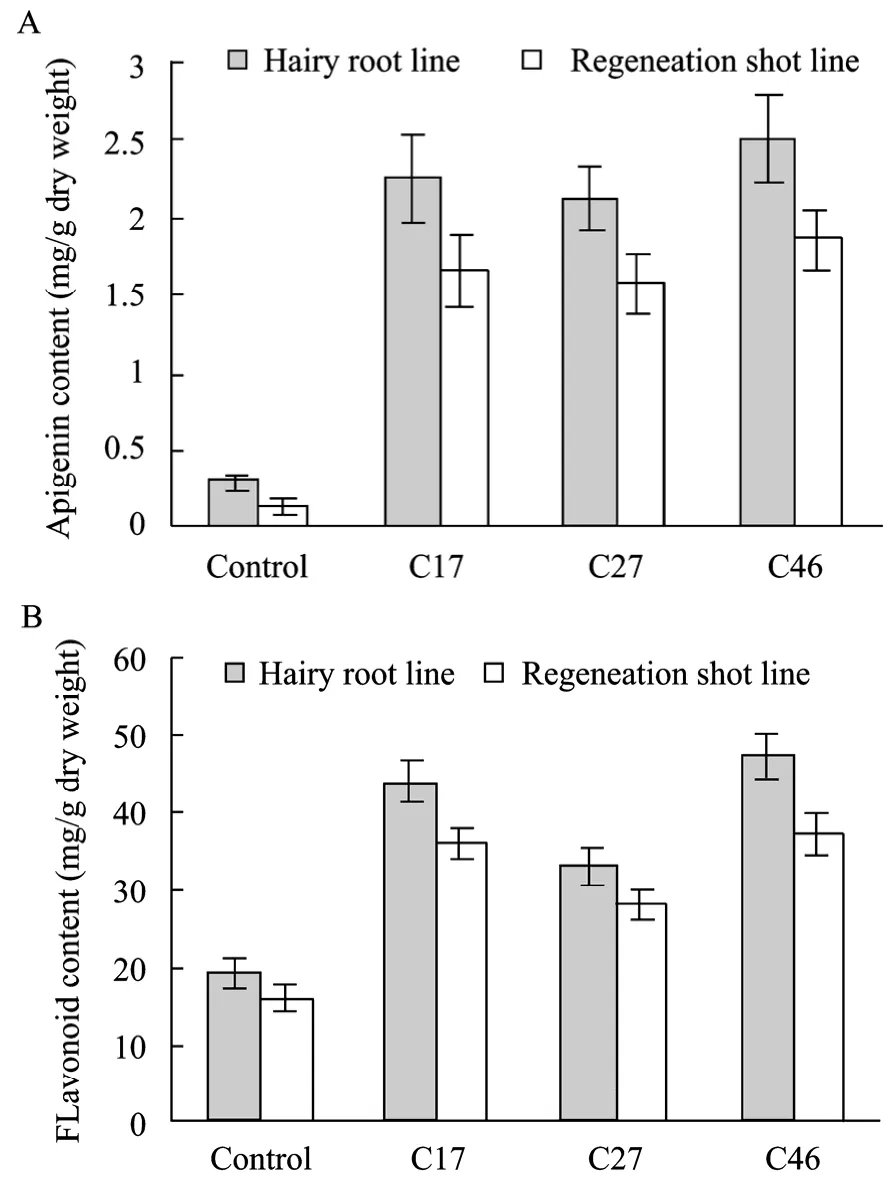
图4 转Smchi基因新疆雪莲毛状根和再生苗的芹菜素和总黄酮含量Fig. 4 Content of apigenin and flavonoid in different S.involucrata plantlet and hairy root lines (20 d). (A) Apigenin content. (B) Flavonoid content. Control: induced by A.rhizogenes strain R1601; Cn: induced by A. rhizogenes strain R1601 with the binary vector pCHI (“n” indicates the line number).
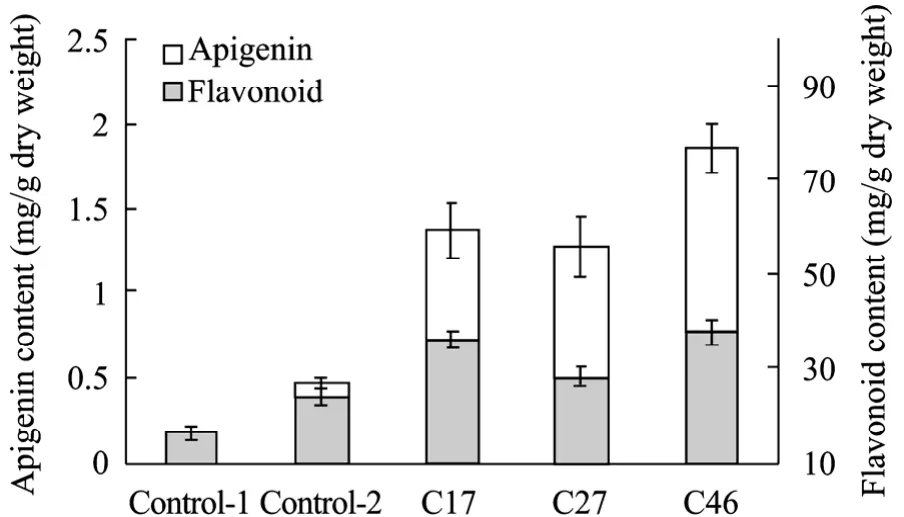
图 5 不同类型新疆雪莲毛状根系再生苗的芹菜素和总黄酮含量Fig. 5 Content of apigenin and flavonoid in different types of S. involucrata plantlet (20 d). Control-1: normal plantlet;Control-2: plantlet induced by wild-type hairy root which was induced by A. rhizogenes strain R1601; Cn: plantlet induced by 35S-chi transgenic hairy root lines which is induced by A. rhizogenes strain R1601 with the binary vector pCAMBIA1301-chi (“n” indicates the line number).
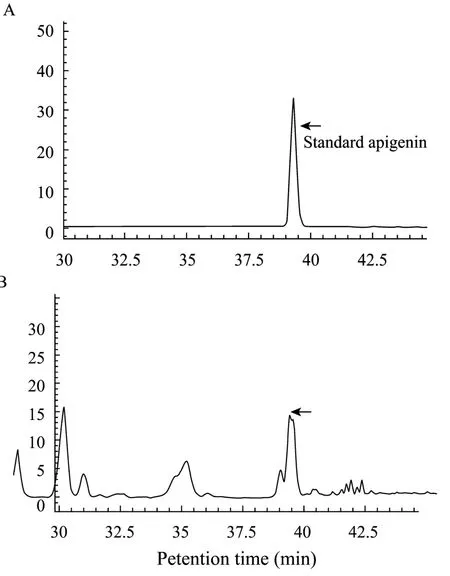
图6 新疆雪莲毛状根系C46再生苗的HPLC图谱Fig. 6 Chromatograms recorded at 337 nm. (A) Standard sample of apigenin. (B) A regenerant from chi-transformed root line.
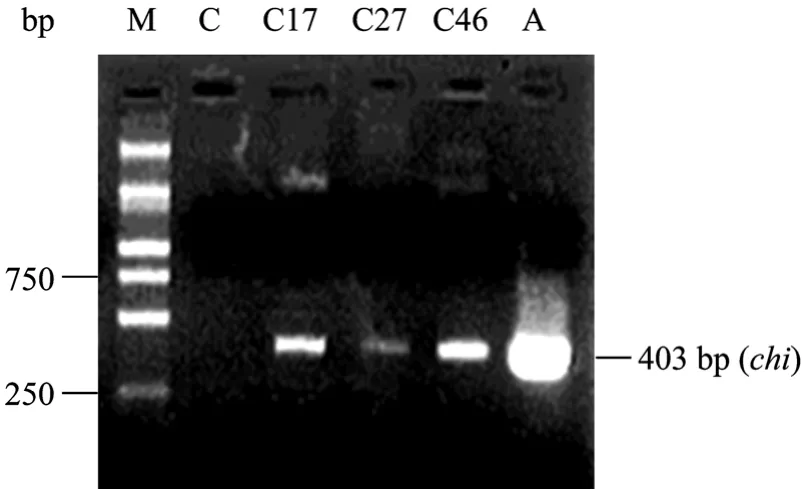
图7 转基因新疆雪莲再生苗的PCR检测Fig. 7 Analysis of PCR for chi of transformed S. involucrata regenerated plantlet. C: plantlet induced by wild-type hairy root which was induced by A. rhizogenes strain R1601; Cn: plantlet induced by 35S-chi transgenic hairy root lines which is induced by A. rhizogenes strain R1601 with the binary vector pCHI (“n”indicates the line number); A: A. rhizogenes strain R1601 containg pRiA4 and pCAMBIA1301-chi; M: DNA marker (DGL-2000).
3 讨论
本实验对新疆雪莲转 Smchi基因的毛状根植株再生进行了研究。结果显示 Smchi转基因雪莲植株和未经发根农杆菌转化的雪莲试管苗相比,转基因株系的芹菜素和总黄酮含量比对照植株有显著提高,这一结果与木本曼陀罗毛状根再生植株中莨菪烷类生物碱 (Tropane alkaloids,TA) 的含量较野生植株有明显的提高的报道一致。新疆雪莲毛状根不定芽的产生类型与山葵Amoracia rusticana、百脉根Lotus corniculatus、红豆草Onobrychis viciifolia、紫云英 Astragalus sinicus等植物不定芽产生类型相似[14-17],不定芽都是在毛状根表面、没有可见愈伤的地方形成。而有些植物如苜蓿Medicago sativa毛状根不定芽则是在毛状根来源的愈伤形成胚状体,然后再产生不定芽[18]。
雪莲毛状根分化出的再生苗与未经发根农杆菌侵染的再生苗在形态上有明显差别,包括叶片边缘皱缩、节间缩短、植株矮化、不定根多,这是由于受来自发根农杆菌T-DNA中rol基因的影响,与有关报道一致,是一种典型的毛状根转化植株形态[14-16]。
植物激素是植物组织培养中的关键因子,不仅影响细胞生长,还影响植物中次生代谢产物的合成[19]。在研究外源激素GA3和IAA对转基因新疆雪莲毛状根系生长及类黄酮含量的结果发现,相同浓度不同种类的激素对毛状根系C46的生长及类黄酮含量有所不同,在外源激素GA3诱导下的C46毛状根系类黄酮的含量明显高于在外源激素IAA诱导下的类黄酮的含量,但对毛状根的生长没有明显的差别。这一研究结果与外源激素对黄芩毛状根生长及黄芩苷合成影响的研究结果[19]一致。实验结果还发现,在1/2 MS附加 GA31.5 mg/L的培养基上,不同的雪莲毛状根根系对GA3的诱导反应也不同,添加相同浓度的GA3,根系C17和C27不定芽的诱导频率较高,根系C46诱导效率相对较低。这可能是毛状根是由单细胞起源,但单克隆与单克隆之间,T-DNA插入的片段呈现多样性[9],导致受激素影响的差异。外源激素GA3对植物次生代谢产物形成影响的报道有所不同,在我们的研究中发现激素 GA3对雪莲毛状根及再生苗中类黄酮的含量有明显提高。这一结果与Younghee K报道激素GA3提高了龙胆花冠中的类黄酮含量[20]一致。但Ilan等[22]在研究激素GA3对胡萝卜细胞培养物中花青素形成的研究中发现,外源激素GA3抑制花青素的合成。以上研究结果的差异可能与花青素的合成途径与积累在不同植物种群以及不同植物组织器官中表达不同的模型[22]有关。从图2和3中可以观察到,当分别在毛状根系 C46中添加浓度为 0.1~0.5 mg/L培养基IAA和 GA3两种激素与未添加激素的毛状根 (空白对照) 相比均不同程度地提高类黄酮的含量,当浓度提高到1 mg/L时类黄酮含量及干重有所下降,此结果证明了以上两种激素可提高雪莲毛状根系中类黄酮含量。已有类似的报道,植物激素可提高毛状根代谢产物的含量,较高浓度的激素可抑制毛状根代谢产物的形成及毛状根组织的生长[6,19]。
从图5中可以看到3种转基因雪莲毛状根再生苗 (C17,C27,C46) 的总黄酮含量明显高于未转入Smchi转基因雪莲毛状根再生苗 (Control-2) 的含量。CHI基因是黄酮代谢途径中的一个关键酶,上调CHI基因会导致总黄酮生物合成能力提高。在雪莲毛状根中CHI基因的表达量和CHI酶的活性与黄酮的含量相关[5]。携带 CHI基因雪莲毛状根再生植株 (C17,C27,C46) 的 PCR结果显示 (图 7):转基因雪莲毛状根系再生植株CHI基因没有丢失。表明CHI基因在转基因雪莲毛状根系再生植株的芹菜素和总黄酮合成中起着重要的作用。从图5中还可以看到,与转基因雪莲毛状根系再生苗和未转入Smchi转基因雪莲毛状根再生苗相比,野生雪莲试管苗(Control-1,normal plantlet) 的总黄酮含量最低,从这一结果中可以推测,雪莲毛状根系中的rol基因对提高雪莲毛状根的黄酮含量起到一定的作用,这与前面的讨论也是一致的。因此,以毛状根为受体,将类黄酮代谢途径中的有效基因导入到新疆雪莲毛状根中,然后再生成高产类黄酮转基因苗,进行人工栽培,将是解决雪莲野生资源短缺的有效途径。
REFERENCES
[1] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People`s republic of China. 2005 ed. Beijing:Chemical Industry Press, 2005: 36.
国家药典委员会编《中华人民共和国药典》2005年版.北京: 化学工业出版社, 2005: 36.
[2] McVean M, Xiao HY, Isobe KI, et al. Increase in wild-type p53 stability and transactivational activity by the chemopreventive agent apigenin in keratinocytes.Carcinogenesis, 2000, 21(4): 633−639.
[3] Gupta S, Afaq F, Mukhtar H. Selective growth-inhibitory,cell-cycle deregulatory and apoptotic response of apigenin in normal versus human prostate carcinoma cells.Biochem Biophys Res Commun, 2001, 287(4): 914−920.
[4] China Environmental Protection Agency. The Study of Protection of Rare and Endangered Plants in China.Beijing: China Environmental Scinence Press, 1991:158.
国家环保局. 珍稀濒危植物保护研究. 北京: 中国环境科学出版社, 1991: 158.
[5] Li FX, Jin ZP, Zhao DX, et al. Overexpression of the Saussurea medusa chalcone isomerase gene in S.inveolucrata hairy root cultures enhances their biosynthesis of apigenin. Phytochemistry, 2006, 67(6): 553−560.
[6] Zhang JD, Yang XQ, Qiao AM, et al. Plant regeneration from hairy roots of Datura arborea L. J Tropical Subtropical Botany, 2008, 16(5): 480−485.
张继栋, 杨雪清, 乔爱民, 等. 木本曼陀罗毛状根植株再生体系的建立. 热带亚热带植物学报, 2008, 16(5):480−485.
[7] Tiwari RK, Trivedi M, Guang ZC, et al. Agrobacterium rhizogenes mediated transformation of Scutellaria baicalensis and production of flavonoids in hairy roots.Biol Plant, 2008, 52(1): 26−35.
[8] Weathers PJ, Bunk G, McCoy MC. The effect of phytohormones on growth and arthmisinin production in Artemisia annua hairy roots. In Vitro Cell Dev Biol Plant,2005, 41(1): 47−53.
[9] Farkya S, Bisaria VS. Exogenous hormones affecting morphology and biosynthetic potential of hairy root line(LYR2i) of Linum album. J Biosci Bioeng, 2008, 105(2):140−146.
[10] Grunewald W, van Noorden G, Van Isterdael G, et al.Manipulation of auxin transport in plant roots during Rhizobium symbiosis and nematode parasitism. Plant Cell,2009, 21(9): 2553−2562.
[11] Yang SH, Liu XF, Guo DA, et al. Effect of phytohormones and elicitors on growth and anthraquinone production of Cassia obtuifolia hairy roots. Chin Tradit Herb Drugs,2005, 36(5): 752−756.
杨世海, 刘晓峰, 果德安, 等.决明毛状根诱导及激素与诱导子对毛状根生长和蒽醌类化合物合成的影响. 中草药, 2005, 36(5): 752−756.
[12] Guan JY, Wang WW, Ma MT, et al. Investigation of technological preparation on soak of Saussurea involucrate.J Shenyang Pharmaceutical Univ, 1995, 12(3): 209−211.
关家彦, 王玮文, 马慕提, 等. 天山雪莲浸提液制备工艺的考察. 沈阳药科大学学报, 1995, 12(3): 209−211.
[13] Doyle JJ, Doyle JL. Isolation of plant DNA from fresh tissue. Focus, 1990, 12(1): 13−15.
[14] Cho HJ, Widholm JM, Tanaka N, et al. Agrobacterium rhizogenes mediated transformation and regeneration of the legume Astragalus sinicus (Chinese milk vetch). Plant Sci, 1998, 138(1): 53−65.
[15] Golds TJ, Lee JY, Husnain T, et al. Agrobacterium rhizogenes mediated transformation of the forage legumes Medicago sativa and Onobrychis viciifolia. J Exp Bot,1991, 42(9): 1147−1157.
[16] Noda T, Tanaka N, Mano Y, et al. Regeneration of horseradish hairy roots incited by Agrobacterium rhizogenes infection. Plant Cell Rep, 1987, 6(4): 283−286.
[17] Petit A, Stougaard J, Kühle A, et al. Transformation and regeneration of the legume Lotus corniculatus: A system for molecular studies of symbiotic nitrogen fixation. Mol Gen Genet, 1987, 207(2/3): 245−250.
[18] Spanò L, Mariotti D, Pezzotti M, et al. Hairy root transformation in alfalfa (Medicago sativa L.). Theor Appl Genet, 1987, 73(4): 523−530.
[19] Qi XJ, Guo LK. Effects of exogenous phytohormones on hairy root of Scutellaria baicalensis biomass and biosynthesis baicalin. J Shaanxi Univ Sci Technol, 2009,27(2): 48−50.
齐香君, 郭乐康. 外源激素对黄芩毛状根生长及黄芩苷合成的影响. 陕西科技大学学报, 2009, 27(2): 48−50.
[20] Kim Y. Gibberellic acid regulates flavonoid 3',5'-hydroxylase gene transcription in the corolla of Gentiana scabra. J Plant Biol, 1999, 42(4): 253−258.
[21] Ilan A, Dougall DK. Effects of gibberellic acid and uniconazole on the activities of some enzymes of anthocyanin biosynthesis in carrot cell cultures. J Plant Growth Regul, 1994, 13(4): 213−219.
[22] Nagira Y, Ikegami K, Koshiba T, et al. Effect of ABA upon anthocyanin synthesis in regenerated torenia shoots.J Plant Res, 2006, 119(2): 137−144.
Effects of phytohormones on plant regeneration and production of flavonoids in transgenic
Saussurea involucrata hairy roots
Xianli Qiao1,2, Shuguang Jiang3, Xiaofeng Lü1,2, Fengxia Li1,2, and Dexiu Zhao1
1 Key Laboratory for Photosynthesis and Environmental Molecular Physiology, Institute of Botany, Chinese Academy of Sciences, Beijing 100093, China
2 Graduate School of Chinese Academy of Sciences, Beijing 100049, China
3 The First Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 450000, China
Received: March 7, 2010; Accepted: August 11, 2010
Supported by: National Natural Science Foundation of China (No. 30871627), National Basic Research Program of China (973 Program) (No.2009CB119200).
Corresponding author: Deliang Peng. Tel: +86-10-62815611; E-mail: dlpeng@ippcaas.cn
国家自然科学基金 (No. 30871627),国家重点基础研究发展计划 (973计划) (No. 2009CB119200) 资助。
