流加菌种对厌氧氨氧化工艺的影响
2011-09-29唐崇俭郑平陈建伟
唐崇俭,郑平,陈建伟
浙江大学环境工程系,杭州 310029
流加菌种对厌氧氨氧化工艺的影响
唐崇俭,郑平,陈建伟
浙江大学环境工程系,杭州 310029
厌氧氨氧化工艺具有很高的容积氮去除速率,现已成功应用于污泥压滤液等含氨废水的脱氮处理,容积氮去除速率高达9.5 kg/(m3·d)。但由于厌氧氨氧化菌为自养型细菌,生长缓慢,对环境条件敏感,致使厌氧氨氧化工艺启动时间过长,运行容易失稳,并且不适合处理有机含氨废水和毒性含氨废水,极大地限制了该工艺的进一步推广应用。为了克服厌氧氨氧化工艺实际应用中存在的问题,结合发酵工业中常用的菌种流加技术,提出了一种新型的菌种流加式厌氧氨氧化工艺,研究了该新型工艺在厌氧氨氧化工艺的启动过程、稳定运行以及处理有机含氨废水和毒性含氨废水等方面的应用情况。结果表明,通过向反应器内补加优质厌氧氨氧化菌种,可提高厌氧氨氧化菌数量及其在菌群中的比例,强化厌氧氨氧化功能。据此研发的菌种流加式厌氧氨氧化工艺不仅可以实现快速启动,而且可以稳定运行,并突破了有机物和毒物所致的运行障碍,拓展了厌氧氨氧化工艺的应用范围。
厌氧氨氧化,菌种流加技术,生物脱氮,有机物,毒物
Abstract:Anaerobic ammonium oxidation (Anammox) process is a high-rate nitrogen removal technology that has been applied in sludge dewatering effluents treatment with nitrogen removal rate as high as 9.5 kg/(m3·d). However, due to the slow growth rate of the autotrophic Anammox bacteria and the susceptivity to environmental conditions, the start-up of Anammox process is very long;the operation is unstable; and the nitrogen removal from organic-containing and/or toxicant-containing ammonium-rich wastewaters using Anammox process becomes difficult. Thus, the application of this high-rate process is significantly limited. In this paper, a newly-developed Anammox process with sequential biocatalyst (Anammox biomass) addition was established based on the procedure in fermentation engineering. We introduced the Anammox process with sequential biocatalyst addition on start-up, stable operation and the treatment of organic-containing and toxicant-containing ammonium-rich wastewaters. Results show that supplementing high-activity Anammox biomass into reactors will increase the amount of as well as the ratio of Anammox bacteria. Thus, the innovative Anammox process with sequential biocatalyst addition not only accelerates the start-up course, but also enhances the stability of Anammox process. Furthermore, it overcomes the drawbacks of wastewaterscontaining high organic content and toxic substances. Therefore, the application of Anammox process may be further enlarged.
Keywords:Anammox, sequential biocatalyst addition, biological nitrogen removal, organic matter, toxic substance
厌氧氨氧化 (Anaerobic ammonium oxidation,Anammox) 是近 20年中开发成功的一种高效生物脱氮技术[1-3],其最高容积去除速率可达50.75 kg/(m3·d)[4]。2002年世界上第一个生产性 Anammox反应器在荷兰鹿特丹投入运行,用于处理厌氧消化污泥压滤液,容积去除速率高达 9.5 kg/(m3·d)[3],对于一个 62万人口的城市,其污泥消化液处理仅用了70 m3装置。Anammox工艺的效能大大突破了传统硝化-反硝化生物脱氮工艺,受到了环境工程界的高度关注;其处理费用仅为0.75 欧元/kg N,远远低于传统生物脱氮工艺 (2~5欧元/kg N)[5],显示了诱人的应用前景。
但是,厌氧氨氧化菌为严格化能自养菌,其倍增时间长达11~19 d[3,6],细胞产率仅为0.11 g VSS/g NH4+-N[7],Anammox菌扩增困难,导致反应器启动过程十分缓慢,前述第一个生产性Anammox反应器的启动过程长达3.5年[3]。由于厌氧氨氧化菌为自养菌,当环境中存在有机物时,其基质亚硝酸盐易受反硝化菌的竞争[8-9]。厌氧氨氧化菌对环境条件 (如水质、温度) 敏感[10-12],对毒性物质适应能力较差[12-13]。迄今为止,厌氧氨氧化工艺的应用仅局限于少数几种低C/N和易生物处理的废水。含氨废水同时含有机物 (如味精废水[14]) 或毒性物质 (如制药废水[12])是普遍现象,因此突破上述过程瓶颈对厌氧氨氧化工艺的推广应用具有重大的现实意义。
菌种扩大培养是发酵工业中广泛采用的一种菌种应用技术[15]。在批次发酵中,一般通过“试管→三角瓶→种子罐→发酵罐”的多级扩增,使菌量满足生产需要。而在连续发酵中,菌种扩增与发酵生产往往同时进行。在厌氧氨氧化工艺的启动过程中,除装置内菌种自身增殖外,外加菌种无疑有利于加快菌体积累。在厌氧氨氧化工艺用于处理高浓度有机含氨废水或者毒性含氨废水时,外加菌种则无疑有助于保持功能菌数量及其在混合菌群 (污泥) 中的比例,从而增强对有机物和毒物的抗性。基于这一理念,本课题组开发了新型菌种流加式厌氧氨氧化工艺[16],并进行了相关试验,以下对此方面的研究进展进行了综述。
1 有机物对厌氧氨氧化工艺的影响
在猪场废水、味精废水和水产养殖废水等众多实际废水中,有机物与氨共存。不同有机物对厌氧氨氧化工艺的影响不尽相同,如甲醇、酚类等毒性有机物对厌氧氨氧化菌的抑制作用十分强烈[17-18],笔者将其归入毒性物质。常见的无毒可溶性有机物如葡萄糖、乙酸、丙酸、丁酸等对厌氧氨氧化工艺的影响主要可归结为反硝化作用[8-9]。本文拟从分子水平、细胞水平以及生态水平等层面来探讨无毒有机物对厌氧氨氧化工艺的影响。
从分子水平看,亚硝酸是厌氧氨氧化和反硝化的共同反应物,两者的化学反应式分别为 (1) 和(2) (其中有机物以葡萄糖表示)[19]。在缺氧以及同时存在氨、亚硝酸盐和有机物的条件下,因反硝化的吉布斯自由能 (−472 kJ/mol) 低于厌氧氨氧化(−335 kJ/mol) 的吉布斯自由能,反硝化更易发生,因此反应物亚硝酸被优先用于反硝化,导致厌氧氨氧化因缺乏反应物亚硝酸而难以进行。
从细胞水平看,反硝化菌的倍增时间一般以小时计,而厌氧氨氧化菌的倍增时间则一般以天计[20],前者远远短于后者。由于反硝化先于厌氧氨氧化发生,因此体系内的营养物质 (包括亚硝酸) 也优先满足反硝化菌的细胞合成之需。在实际废水中,一些营养成分 (如微量元素和生长因子) 的含量较低,易成为限制性因子,有异养菌生长时,这些限制性因子供求关系更加紧张,对厌氧氨氧化菌的生存和发展是一个严峻挑战。
从生态水平看,反硝化菌为异养型细菌,可利用有机物作为碳源,其细胞产率 (细胞产率系数Y=0.3) 远远高于厌氧氨氧化菌 (Y=0.066)[9,19-20],因而在生存空间 (颗粒污泥空间、反应器有效空间) 的竞争中也处于优势[9]。若长期在高有机物浓度下运行,反硝化菌可逐渐占据颗粒污泥和反应器的有效空间,并将厌氧氨氧化菌排挤出反应器系统[9]。
Chamchoi等[8]的研究结果表明,在UASB反应器容积氮负荷低于0.1 kg/(m3·d)的工况下,进水COD浓度提高至300 mg/L[有机负荷为0.1~0.2 kg COD/(m3·d)]即可抑制厌氧氨氧化菌混培物的活性。Molinuevo等[20]也证实,COD浓度为292 mg/L可导致厌氧氨氧化反应器性能严重恶化。杨洋等[21]研究表明葡萄糖 (200 mg COD/L) 可明显抑制污泥的厌氧氨氧化活性,污泥表现出较高的反硝化活性。本课题组研究表明,长期在高浓度有机物 (COD/NO2−-N为2.29)下运行,厌氧氨氧化反应器的容积脱氮效能可由11.70 kg/(m3·d)直线下降至 0.1~0.3 kg/(m3·d),最后几近消失 (通过厌氧氨氧化消耗的 NO2−-N 仅为2.1%)[9]。长期 (130 d) 在高浓度有机物下运行后,即使从废水中去除有机物,恢复在无机状态下运行(持续运行18 d),厌氧氨氧化反应器的容积效能也不能恢复至原有水平[9]。这一现象表明,有机物已对厌氧氨氧化工艺的脱氮功能产生了深刻的影响。采用透射电镜对比观察反应器内的污泥样品发现,添加有机物后,污泥中的厌氧氨氧化菌细胞显著下降(图1中A、B为未添加有机物前的污泥样品;C、D、E、F为添加有机物长期运行后的污泥样品),大量厌氧氨氧化细胞处于分解状态 (图 1E、F)[9]。有机物对厌氧氨氧化菌的影响可归因为:反硝化菌优先利用亚硝酸盐,致使厌氧氨氧化菌缺乏基质而处于饥饿状态,反硝化菌逐渐在反应器内占据主导地位,导致厌氧氨氧化功能最终消失[9]。
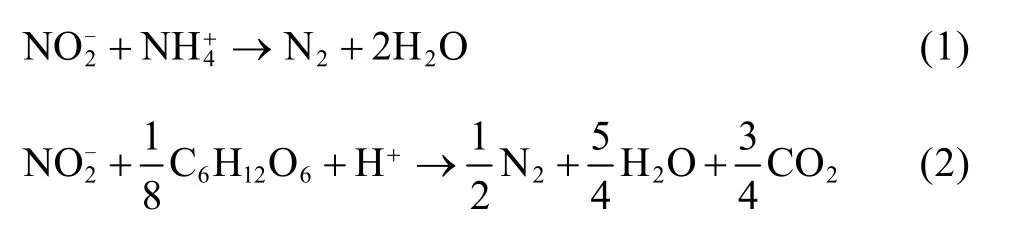
图1 添加有机物前后污泥样品的透射电镜照片[9]Fig. 1 TEM photographs of sludges before (A, B) and after (C,D, E, F) dosing organic matter[9].
2 毒性物质对厌氧氨氧化工艺的影响
从分子水平看,毒性物质对厌氧氨氧化的影响主要有 2个方面:一是与厌氧氨氧化竞争反应物氨或亚硝酸,如在脱氮硫杆菌的作用下废水中的硫化物可将亚硝酸还原为氮气[22];又如在硝化细菌的作用下氧可将氨氧化成亚硝酸而造成氨缺乏,也可将亚硝酸氧化成硝酸而造成亚硝酸缺乏[23]。二是导致催化厌氧氨氧化反应的酶失活,如羟胺氧还酶中含有大量细胞色素[23],CN−可与细胞色素中的铁结合而使之失活。
从细胞水平看,毒物会破坏厌氧氨氧化菌的细胞结构或抑制厌氧氨氧化菌的代谢活动[13]。抗生素是含氨制药废水中常见的抑制物质[12-13],其中青霉素、头孢菌素类、万古霉素等可干扰细胞壁的合成;链霉素、庆大霉素、氯霉素、四环素等可干扰核糖体的蛋白质合成[24]。
从生态水平看,厌氧氨氧化菌生长速度慢、细胞产率低、对毒性物质抗性弱;而异养菌生长速度快、细胞产率高、对毒性物质抗性强。当废水中存在毒性物质时,厌氧氨氧化菌所受的抑制更严重,更易被淘汰。
我国抗生素生产业发展迅猛,现有 300多家抗生素生产企业,生产70多个抗生素品种,产量占世界原料药产量的 20%~30%。抗生素可抑制厌氧氨氧化菌的活性。van de Graaf等[7]通过批次实验研究了氯霉素对厌氧氨氧化污泥活性的影响,结果表明氯霉素添加量为200 mg/L时,厌氧氨氧化活性降低了 68%。Fernández等[13]的研究结果表明,四环素浓度为10 mg/L可导致反应器内厌氧氨氧化菌的活性降低60%。含氨制药废水因含有残余的抗生素,采用厌氧氨氧化工艺处理时,效果往往较差。本课题组的研究表明,采用厌氧氨氧化工艺直接处理制药废水 (进水氨氮、亚硝氮浓度为 120~250 mg/L)时,反应器的厌氧氨氧化脱氮功能逐渐下降,至41 d后完全消失。生物毒性试验表明,制药废水的生物毒性是导致反应器厌氧氨氧化功能消失的主要原因[12]。随着运行时间的延长,毒性物质可在厌氧氨氧化污泥中积累而呈现蓄积毒性[12],更加重了毒性物质对厌氧氨氧化菌的抑制,反应器的脱氮性能最终完全崩溃。
3 菌种流加式厌氧氨氧化技术
菌种流加式厌氧氨氧化技术是针对常规厌氧氨氧化工艺的固有缺陷而开发的一种新型废水生物脱氮技术[16],本课题组对该技术进行了初步探究。
3.1 加速启动过程
厌氧氨氧化反应器的启动缓慢,这一缺陷严重制约了该工艺的工程化应用。采用菌种流加技术可大大缩短厌氧氨氧化工艺的启动时间[10]。
在本课题组所做的厌氧氨氧化反应器启动研究中,中试厌氧氨氧化反应器采用上流式滤器(2.5 m3),接种污泥为普通活性污泥 (短程硝化污泥、厌氧颗粒污泥、反硝化污泥以及厌氧絮体污泥),由于在常温下启动,反应器运行200 d后仍未见氨氮去除现象[10]。为了缩短启动时间,于第214天向反应器内投加了 20 L高效厌氧氨氧化污泥[VSS为14.2 g/L,比污泥活性为1.68 g/(gVSS·d)],中试反应器立即呈现厌氧氨氧化功能,之后氨氮去除率逐渐上升,厌氧氨氧化功能逐渐增强。至第 255天,反应器容积总氮去除速率升高为1.11 kg/(m3·d),达到设计指标值,反应器启动成功[10]。后续运行结果表明,该中试厌氧氨氧化反应器的容积脱氮效能可达3.5 kg/(m3·d)[25]。
就污泥投加量而论,相对于中试装置内的污泥量,所投加的厌氧氨氧化污泥并不多 (污泥投加比约为2%)[10],理论上不足以产生如此显著的功效。这个现象表明,经过 200多天的运行,中试反应器内已积累一定数量的厌氧氨氧化菌,只是由于某些因素的限制而不能显现厌氧氨氧化功能。
实验证明,厌氧氨氧化菌富集培养物只有在细胞密度高达 1010个/mL以上时,才能显现出厌氧氨氧化活性[23]。在该中试反应器的启动过程中 (2007年10月至2008年5月),水温维持在较低水平 (5 ℃~20 ℃),在此温度下,厌氧氨氧化的活化能高达93~94 kJ/mol[11],反应较难进行(在废水生物处理中,活化能的取值范围通常为8.37~83.68 kJ/mol[23]),故厌氧氨氧化菌的细胞密度难以提高,这可能是导致该中试厌氧氨氧化反应器启动过程持续时间很长的主要原因。通过向该中试反应器补充高活性厌氧氨氧化菌种,可在中试反应器的局部空间内提高厌氧氨氧化菌的细胞密度,从而显现出厌氧氨氧化活性,进而带动了中试反应器内其他厌氧氨氧化菌的代谢作用,最终得以在较短时间内完成启动,菌种流加效应显著[10]。
3.2 加速失稳恢复
厌氧氨氧化菌的基质为氨和亚硝酸盐,均具毒性,其中尤以亚硝酸盐毒性更大。在反应器运行过程中,当基质浓度较高时,容易出现基质的自抑制而导致反应器运行失稳。厌氧氨氧化反应器基质抑制后的性能恢复是工艺稳定运行的重要内容。
Strous等[6]研究表明,亚硝酸盐浓度达98 mg/L时即可完全抑制厌氧氨氧化菌的活性。Kimura等[26]研究了亚硝酸盐冲击对厌氧氨氧化反应器性能的影响,发现当进水亚硝酸盐浓度突然提高至750 mg/L,并在此浓度下维持7 d,反应器内厌氧氨氧化菌活性降低为原来的10%。此外,研究还表明游离氨浓度达80~104 mg/L时,也能导致厌氧氨氧化反应器运行性能的恶化[27]。本课题组研究表明,当厌氧氨氧化反应器的进水浓度提升为1 100 mg/L (进水氨氮为1 000 mg/L) 时,反应器出水浓度逐渐升高为 703 mg/L,出水浓度升高为716 mg/L;和去除率分别仅为28%和36%,反应器性能严重恶化。将基质浓度降低后进行恢复试验,运行39 d后反应器的进水亚硝酸盐浓度仅能恢复至800 mg/L,恢复程度只有89%。笔者在后续研究中,当反应器发生基质自抑制时,通过向反应器内流加少量高效厌氧氨氧化菌种,即可有效缓解基质的自抑制作用,快速恢复厌氧氨氧化反应器的脱氮性能。
3.3 克服有机物影响
本课题组研究了菌种流加式厌氧氨氧化工艺处理有机含氨废水的运行性能,实验结果如图2所示。两个平行运行的序批式反应器 (分别记为 R1和R2),其中R1不流加菌种,作为对照;R2每日定时流加菌种[比厌氧氨氧化活性为1.9 g/(g VSS·d)],流加速率为0.097 g VSS/(L废水·L反应器·d),进水氨氮、亚硝酸盐浓度为350 mg/L和400 mg/L,有机物浓度为 500 mg COD/L,COD/为 1.25,HRT为24 h。在前15天,由于未对反应器内的pH值进行控制,体系内pH值高达9.0~9.3 (主要由反硝化所致)。与此对应,2个反应器的氨氮去除率较低,但R2反应器的氨氮、亚硝酸盐氮的去除率均高于R1。适时调控 pH值后,2个反应器内的 pH值稳定在7.5~8.0,R2反应器的氨氮去除率上升至70%~80%,厌氧氨氧化功能显著增强;而R1的氨氮去除率仍维持在20%以下,厌氧氨氧化功能较弱。以上结果表明,采用菌种流加技术可有效克服有机物对厌氧氨氧化的负面影响。
3.4 缓解毒物影响
本课题组试验了菌种流加式厌氧氨氧化工艺处理制药废水 (含多种抗生素) 的性能。图 3为对照UASB反应器 (未采用菌种流加技术) 的运行性能,由图 3可见,在制药废水氨氮和亚硝酸盐浓度分别为120~200 mg/L和160~240 mg/L,HRT设置为16 h时,反应器的出水氨氮和亚硝酸盐浓度均高达150~200 mg/L,氨氮去除率甚至低于20%,容积氮去除速率仅为 0.1 kg/(m3·d)。而采用菌种流加技术[菌种流加速率为0.028 gVSS/(L废水·L反应器·d)],厌氧氨氧化反应器的HRT可逐渐缩短为1.11 h,反应器出水氨氮浓度低于50 mg/L (图4A),氨氮去除率稳定在80%左右;出水亚硝酸盐浓度基本稳定在20 mg/L以下(图4A),亚硝酸盐去除率为90%;反应器的容积负荷高达8.0~9.4 kg/(m3·d),容积去除速率达7.9 kg/(m3·d) (图4B)。上述结果表明,采用菌种流加式厌氧氨氧化工艺,可实现制药废水等有毒含氨废水的高效生物脱氮。
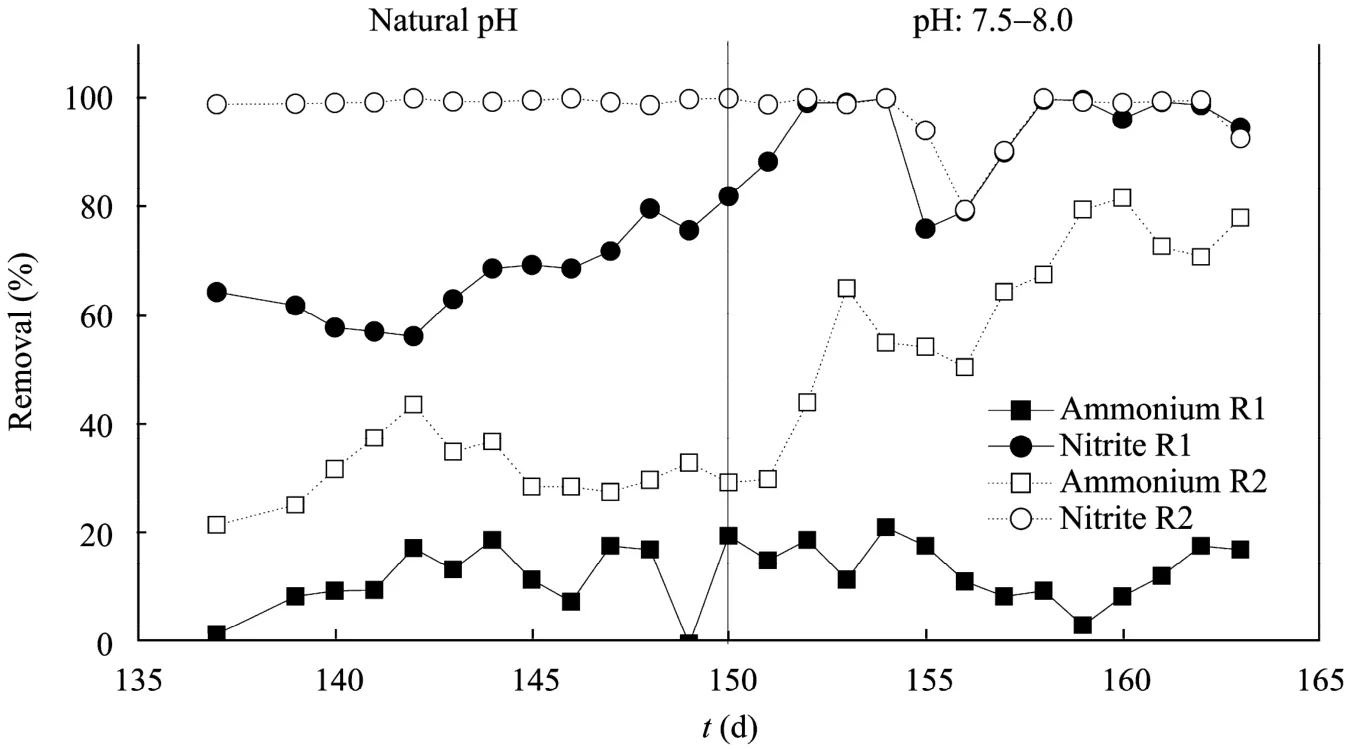
图2 存在有机物时厌氧氨氧化SBR的运行性能Fig. 2 Performance of Anammox SBR in the presence of organic content. R1: without biocatalyst addition; R2: with biocatalyst addition.
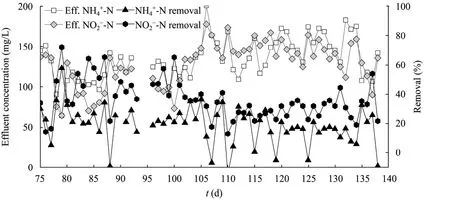
图3 厌氧氨氧化工艺直接处理制药废水的运行性能Fig. 3 Performance of conventional Anammox process treating pharmaceutical wastewater. Eff.: effluent.
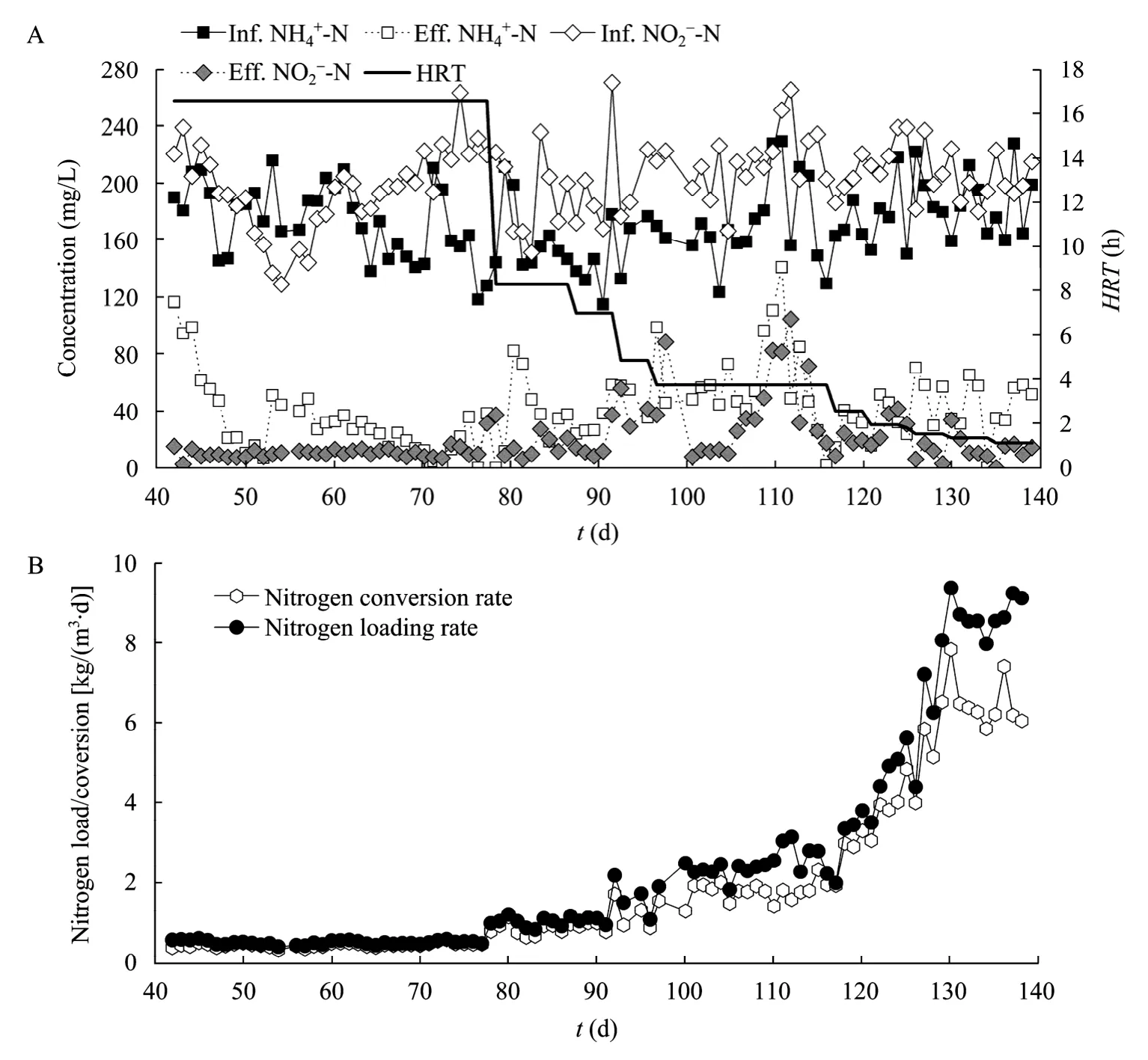
图4 菌种流加式厌氧氨氧化工艺处理制药废水的运行性能Fig. 4 Performance of Anammox process with sequential biocatalyst addition. (A) Profile of influent and effluent nitrogen concentration and hydraulic retention time (HRT). (B) Profile of nitrogen loading rate and nitrogen removal rate. Eff.: effluent; Inf.: influent.
综合来看,基质、有机物和毒性物质都会对厌氧氨氧化菌产生抑制,导致厌氧氨氧化反应器的脱氮性能失稳。如前所述,作为毒物,这些物质均可从分子水平、细胞水平和生态水平影响厌氧氨氧化,其中尤以直接破坏厌氧氨氧化菌的细胞更为强烈。在处理含氨制药废水的过程中,经41 d的连续运行,UASB反应器内的厌氧氨氧化颗粒污泥逐渐解体,颗粒粒径由2.51 mm降低为1.49 mm,污泥颜色由鲜红色转变为浅黄色;通过透射电镜观察,发现污泥中厌氧氨氧化菌的细胞数量锐减。同样,高浓度的亚硝酸盐也会对厌氧氨氧化菌产生强烈的毒害作用,由于厌氧氨氧化性能的恢复往往是通过厌氧氨氧化菌数量增多来实现,而在基质抑制条件下,厌氧氨氧化菌难以增长,导致反应器性能失稳后的恢复过程十分缓慢。存在无毒有机物的工况下,由于反硝化作用以及反硝化菌的特性,厌氧氨氧化菌在基质 (分子水平)、营养 (细胞水平) 以及生存空间(生态水平) 的竞争中都处于绝对劣势[9],长期在高有机物浓度下运行,厌氧氨氧化菌容易被淘汰出反应器系统[9]。可见,无论是发生基质自抑制,还是因毒物和有机物存在而导致的性能恶化,都使得厌氧氨氧化菌的数量不能满足需求。通过流加高活性厌氧氨氧化菌种,可人为增加反应器内厌氧氨氧化菌的数量,从而强化脱氮功能。另外,厌氧氨氧化菌可分泌大量胞外多聚物[4],可使厌氧氨氧化菌大量聚集,容易形成沉淀性能优良的厌氧氨氧化颗粒污泥[4],并具有较高活性[1.9 g/(g VSS·d)][4],同时也具有较强抵抗外界不利因素影响的能力[9,28]。因此,通过流加高活性、沉淀性能优良的厌氧氨氧化颗粒污泥,可增加体系中厌氧氨氧化菌的数量,实现厌氧氨氧化菌的有效持留,并能增强其抵抗外界不利因素影响的能力,最终发挥出菌种流加的效应。
4 结论与展望
厌氧氨氧化可在厌氧条件下实现对废水中氨和亚硝酸盐的同时去除,具有较高的容积去除效能和较低的运行费用,是目前废水生物脱氮技术的研究热点。但由于厌氧氨氧化菌倍增时间长、细胞产率低、且对环境条件敏感、反应器启动时间长、运行易失稳、难以应用于高浓度有机含氨废水和毒性含氨废水的生物脱氮,严重限制了该工艺的应用范围。基于菌种流加技术的菌种流加式厌氧氨氧化工艺不仅可加快厌氧氨氧化工艺的启动和失稳后的恢复,而且可克服有机物和毒物所致的负面影响,实现制药废水等有机毒性含氨废水的高效脱氮,具有诱人的开发潜力。在后续研究中,宜深入研究厌氧氨氧化菌的生长和代谢动力学特性,获得菌种流加的定量参数;以现代分子生物学技术为手段,建立菌群动态变化指示系统;引进自动化控制技术,实现对该技术过程的自动化控制。
REFERENCES
[1] Mulder A, van de Graaf AA, Robertson LA, et al.Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor. FEMS Microbiol Ecol,1995, 16(3): 177−184.
[2] Tsushima I, Ogasawara Y, Kindaichi T, et al. Development of high-rate anaerobic ammonium-oxidizing (anammox)biofilm reactors. Water Res, 2007, 41(8): 1623−1634.
[3] van der Star WRL, Abma WR, Blommers D, et al. Startup of reactors for anoxic ammonium oxidation: experience from the first full-scale anammox reactor in Rotterdam.Water Res, 2007, 41(18): 4149−4163.
[4] Tang CJ, Zheng P, Wang CH, et al. Granulation and characteristics of extracellular polymers of Anammox sludge in high-load EGSB reactor. CIESC J, 2010, 61(3):732−739.
唐崇俭, 郑平, 汪彩华, 等. 高负荷厌氧氨氧化 EGSB反应器的运行及其颗粒污泥的 ECP特性. 化工学报,2010, 61(3): 732−739.
[5] Jetten MSM, Cirpus I, Kartal B, et al. 1994-2004: 10 years of research on the anaerobic oxidation of ammonium.Biochem Soc Tran, 2005, 33(Pt1): 119−123.
[6] Strous M, Heijnen JJ, Kuenen JG, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms.Appl Microbiol Biotechnol, 1998, 50(5): 589−596.
[7] van de Graaf AA, De Bruijn P, Robertson LA, et al.Autotrophic growth of anaerobic ammonium-oxidizing microorganisms in a fluidized bed reactor. Microbiology(UK), 1996, 142(8): 2187–2196.
[8] Chamchoi N, Nitisoravut S, Schmidt JE. Inactivation of ANAMMOX communities under concurrent operation of anaerobic ammonium oxidation (ANAMMOX) and denitrification. Bioresour Technol, 2008, 99(9): 3331−3336.
[9] Tang CJ, Zheng P, Wang CH, et al. Suppression of anaerobic ammonium oxidizers under high organic content in high-rate Anammox UASB reactor. Bioresour Technol,2010, 101(6): 1762−1768.
[10] Tang CJ, Zheng P, Chen JW, et al. Start-up and process control of a pilot-scale Anammox bioreactor at ambient temperature. Chin J Biotech, 2009, 25(3): 406−412.
唐崇俭, 郑平, 陈建伟, 等. 中试厌氧氨氧化反应器的启动与调控. 生物工程学报, 2009, 25(3): 406−412.
[11] Isaka K, Date Y, Kimura Y, et al. Nitrogen removal performance using anaerobic ammonium oxidation at low temperatures. FEMS Microbiol Lett, 2008, 282(1): 32−38.
[12] Chen TT, Tang CJ, Zheng P. Nitrogen removal performance of Anammox process and toxic mechanism of pharmaceutical wastewater. China Environ Sci, 2010,30(4): 504−509.
陈婷婷, 唐崇俭, 郑平. 制药废水厌氧氨氧化脱氮性能与毒性机理的研究. 中国环境科学, 2010, 30(4):504−509.
[13] Fernández I, Mosquera-Corral A, Campos JL, et al.Operation of an Anammox SBR in the presence of two broad-spectrum antibiotics. Process Biochem, 2009, 44(4):494−498.
[14] Chen XL, Zheng P, Jin RC, et al. Biological nitrogen removal from monosodium glutamate containing industrial wastewater with the Anaerobic Ammonium Oxidation(ANAMMOX) process. Acta Sci Circumst, 2007, 27(5):747−752.
陈旭良, 郑平, 金仁村, 等. 味精废水厌氧氨氧化生物脱氮的研究. 环境科学学报, 2007, 27(5): 747−752.
[15] Ye Q. Theories of Fermentation Process. Beijing:Chemical Industry Press, 2004.
叶勤. 发酵过程原理. 北京: 化学工业出版社, 2004.
[16] Zheng P, Tang CJ, Chen JW, et al. An inovative Anammox process integrated with sequantail biocatalyst addition and the equipments: China Patent, ZL200820165691.0,2009-09-09.
郑平, 唐崇俭, 陈建伟, 等. 菌种流加式厌氧氨氧化装置: 中国专利, ZL200820165691.0, 2009-09-09.
[17] Jensen MM, Thamdrup B, Dalsgaard T. Effects of specific inhibitors on anammox and denitrification in marine sediments. Appl Environ Microbiol, 2007, 73(10):3151−3158.
[18] Toh SK, Ashbolt NJ. Adaptation of anaerobic ammonium-oxidising consortium to synthetic coke-ovens wastewater. Appl Microbiol Biotechnol, 2002, 59: 344−352.
[19] Rittmann BE, McCarty PL. Environmental Biotechnology:Principles and Applications. Boston: McGraw-Hill companies, 2001.
[20] Molinuevo B, Garcia MC, Karakashev D, et al. Anammox for ammonia removal from pig manure effluents: effect of organic matter content on process performance. Bioresour Technol, 2009, 100(7): 2171–2175.
[21] Yang Y, Zuo JE, Shen P, et al. Influence of temperature,pH value and organic substance on activity of ANAMMOX sludge. Envion Sci, 2006, 27(4): 691−695.
杨洋, 左剑恶, 沈平, 等. 温度、pH值和有机物对厌氧氨氧化污泥活性的影响. 环境科学, 2006, 27(4): 691−695.
[22] Cai J, Zheng P, Mahmood Q. Influence of various nitrogenous electron acceptors on the anaerobic sulfide oxidation. Bioresour Technol, 2010, 101(9): 2931−2937.
[23] Zheng P, Xu XY, Hu BL. Novel Biological Nitrogen Removal: Theory and Technology. Beijing: Science Press,2004.
郑平, 徐向阳, 胡宝兰. 新型生物脱氮理论与技术. 北京: 科学出版社, 2004.
[24] Davies J. Inactivation of antibiotics and the dissemination of resistance genes. Science, 1994, 264(5157): 375−382.
[25] Tang CJ, Zheng P, Zhang JQ, et al. Performance and process kinetics of pilot-scale Anammox bioreactor under different water temperatures. Environ Sci, 2010, 31(8):1834−1838.
唐崇俭, 郑平, 张吉强, 等. 中试厌氧氨氧化反应器的运行性能及其过程动力学特性. 环境科学, 2010, 31(8):1834−1838.
[26] Kimura Y, Isaka K, Kazama F, et al. Effects of nitrite inhibition on anaerobic ammonium oxidation. Appl Microbiol Biotechnol, 2010, 86(1): 359−365.
[27] Tang CJ, Zheng P, Hu BL, et al. Influence of substrates on nitrogen removal performance and microbiology of anaerobic ammonium oxidation by operating two UASB reactors fed with different substrate levels. J Hazard Mater, 2010, 181(1/3): 19−26.
[28] Batchelor SE, Cooper M, Chhabra SR, et al. Cell density-regulated recovery of starved biofilm populations of ammonia-oxidizing bacteria. Appl Environ Microbiol,1997, 63(6): 2281−2286.
Effect of sequential biocatalyst addition on Anammox process
Chongjian Tang, Ping Zheng, and Jianwei Chen
Department of Environmental Engineering, Zhejiang University, Hangzhou 310029, China
Received: April 26, 2010; Accepted: August 27, 2010
Supported by: National Natural Science Foundation of China (No. 10772150), New Century Excellent Talents in University (No. NCET-06-0885),Ph.D Programs Foundation of the Ministry of Education of China (No. 200806990011), Fundamental Research Foundation of Northwestern Polytechnical University in China (No. 3).
Corresponding author: Dachuan Yin. Tel/Fax: +86-29-88460254; E-mail: yindc@nwpu.edu.cn
国家自然科学基金 (No. 10772150),新世纪优秀人才支持计划 (No. NCET-06-0885),国家博士点基金 (No. 200806990011),西北工业大学基础科研重点项目 (No. 3) 资助。
