超声辐照超声微泡介导siRNA转染膀胱癌T24细胞的实验研究
2011-09-07宋希双杨德勇汪淑晶车翔宇王建伯叶林王丽娜
宋希双,杨德勇,汪淑晶,车翔宇,王建伯,叶林,王丽娜
(1.大连医科大学附属第一医院泌尿外科,辽宁 大连 116011;2.大连医科大学生物化学教研室,辽宁 大连 116011;3.复旦大学附属肿瘤医院泌尿外科,上海 200032)
膀胱癌是泌尿系统最为常见的恶性肿瘤,手术治疗后肿瘤容易复发。RNA干扰能够特异性下调膀胱癌细胞内高表达的癌基因,为膀胱癌的基因治疗提供有力的手段,具有十分重要的临床应用价值[1]。然而如何将治疗性基因片段在患者体内安全高效、特异的导入肿瘤细胞是亟待解决的问题[2]。病毒载体虽然可以较好的完成这一任务,但其与人基因组整合后出现的致瘤性大大增加了基因治疗的危险性,限制了其临床应用[3]。寻找更加有效的基因转染方法成为许多基因治疗的关键。
超声辐照超声微泡(microbubble destruction with ultrasound)是一种相对安全、高效的基因转染方法,超声波辐照超声微泡破裂后对细胞产生的空化效应可以使细胞膜的通透性可逆性增加,促进基因向细胞内转染,具有安全、高效、靶向性强的特点,是一种十分有前途的体内基因转染方法[4]。在本实验中,我们使用超声微泡的方法向T24细胞中转染荧光标记的siRNA小片段,并通过MTT实验和流式细胞仪评估其安全性和转染效率,为寻找安全、特异、高效的体内转染方法提供体外实验基础。
1 材料与方法
1.1 细胞株及培养
人膀胱癌细胞系T24购自中国科学院上海生命科学院细胞资源中心。培养于含10%小牛血清,100 U/mL青霉素及100 U/mL链霉素组成的RPMI 1640培养基中,37℃、5%CO2、、95%湿度的孵箱内。
1.2 主要试剂
FITC标记的阴性对照siRNA由上海吉玛公司合成。超声微泡造影剂由重庆医科大学超声影像学研究所提供(冻干粉剂型,经第三军医大学钴源辐照中心消毒处理),是内含六氟化碳惰性气体的脂质类微泡。将约1 g超声微泡干粉(白色粉末状)溶解于2 mL PBS中形成白色乳状溶液,显微镜下对微泡进行计数,微泡浓度约为1×107/mL,微泡直径大小约为2~10 μm。将该溶液置于4℃放置24 h,微泡浓度没有明显变化。超声基因转染治疗仪:UGT 1025型,由重庆医科大学超声影像学研究所研制,频率1 MHz,声强在 0.4~4 W/cm2范围内可调。
1.3 细胞转染
取生长状态良好的T24细胞在24孔板中培养,细胞长至60%~80%时进行转染。将超声微泡造影剂用无菌双蒸水配制后,记数微泡浓度,按所需终浓度取出所需体积,同样根据反义寡核苷酸所需终浓度从上述配好的原液中取出所需体积,将2者混合后,轻柔混匀,冰上静置20 min,即可用于转染。实验分为4组:siRNA组(Blank),siRNA+超声辐照组(U),siRNA+超声微泡组(MB),siRNA+超声微泡+超声辐照组(U+MB)。超声辐照参数设定在1.2 W,辐照时间30 s。超声微泡浓度为(1×106/mL),siRNA浓度为30 nmol/L。继续培养6 h后弃旧培养液同时加入正常培养液,置37℃培养箱中继续培养48 h后使用荧光显微镜或流式细胞仪观察细胞的转染效率。
超声辐照超声微泡转染组采用上述参数(1.2 W,辐照30 s),脂质体使用Invitrogen公司的Lipofectamine 2000,siRNA浓度均为 30 nmol/L,转染T24细胞48 h后使用流式细胞仪检测siRNA的转染效率,使用MTT实验检测2种转染方法对细胞活力的影响。
1.4 MTT实验检测细胞活力
设对照组,调零组和处理组,每组设5个复孔。用0.25%的胰酶消化细胞,离心吹打成单细胞悬液,以0.5×104/孔接种于96孔培养板中,每孔200 μL细胞悬液,而调零组只加等量培养液。细胞贴壁正常生长融合度为70%~90%时,对处理组予转染处理。再将培养板置37℃,5%CO2培养箱中培养48 h后,在每孔加入MTT 20 μL,继续培养4 h,弃上清液,加入DMSO 200 μL溶解紫色结晶体,适当振摇20 min使其充分溶解,用自动酶标仪测定490 nm波长的吸光度值。
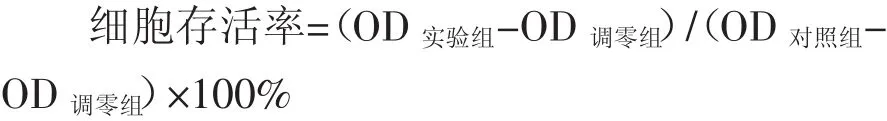
1.5 统计学分析
所有数据均用SPSS 12.0软件进行统计分析。每一项分析至少有3次结果。数值用±s表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
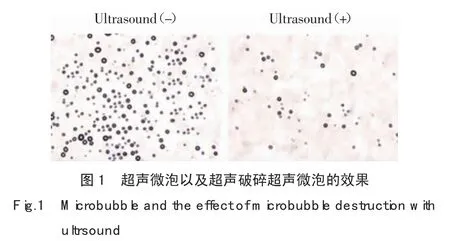
2.1 超声微泡的稳定性以及超声辐照破碎微泡的效果
1 MHz,功率为1.2 W的超声照射微泡10 s,20 s,30 s,40 s,50 s,60 s后,在显微镜下对微泡直接进行计数。如图1所示,在上述超声参数条件下,当照射时间大于30 s时,超声微泡可以有效的使微泡发生破裂,与照射前比较照射后微泡浓度降低大于80%。
2.2 超声辐照超声微泡可以明显提高siRNA转染效率
使用荧光显微镜观察siRNA的转染效率,使用MTT实验评估T24细胞的活力。如图2A所示,与对照组[Blank:(2.12±1.02)%;U:(2.31±3.23)%;MB:(1.89±1.82)%]相比,超声辐照超声微泡显著增加siRNA 的转染效率[U+MB:(29.57±8.25)%]。MTT实验结果表明,1.2 W强度超声辐照超声微泡30 s对T24细胞活性没有显著影响[U+MB:(96.44±8.75)%;Blank:(99.25±10.09)%;U:(98.34±9.11)%;MB:(99.71±9.63)%](图 2B)。
2.3 超声辐照强度和辐照时间对转染效率和细胞活力的影响


使用荧光显微镜观察不同条件下siRNA转染T24细胞的效率,并使用MTT实验检测不同条件超声辐照对T24细胞活性的影响。如图3A所示,在超声功率1.2 W时,转染效率随着辐照时间的增加而增加,但辐照时间超过30 s后转染效率并没有明显增加。T24细胞的在辐照30 s以内没有明显变化,但辐照时间超过30 s后细胞活力呈明显下降趋势(图3B)。进而我们选择超声辐照30 s,观察不同超声功率对siRNA转染效率的影响。如图3C所示,随着超声功率的增加siRNA转染效率呈现增加的趋势,当辐照功率超过1.2 W后siRNA的转染效率没有明显的增加。在超声辐照强度在1.2 W以内时T24细胞的活力没有明显的改变,当辐照强度超过1.2 W时T24细胞的活力呈明显下降趋势(图3D)。
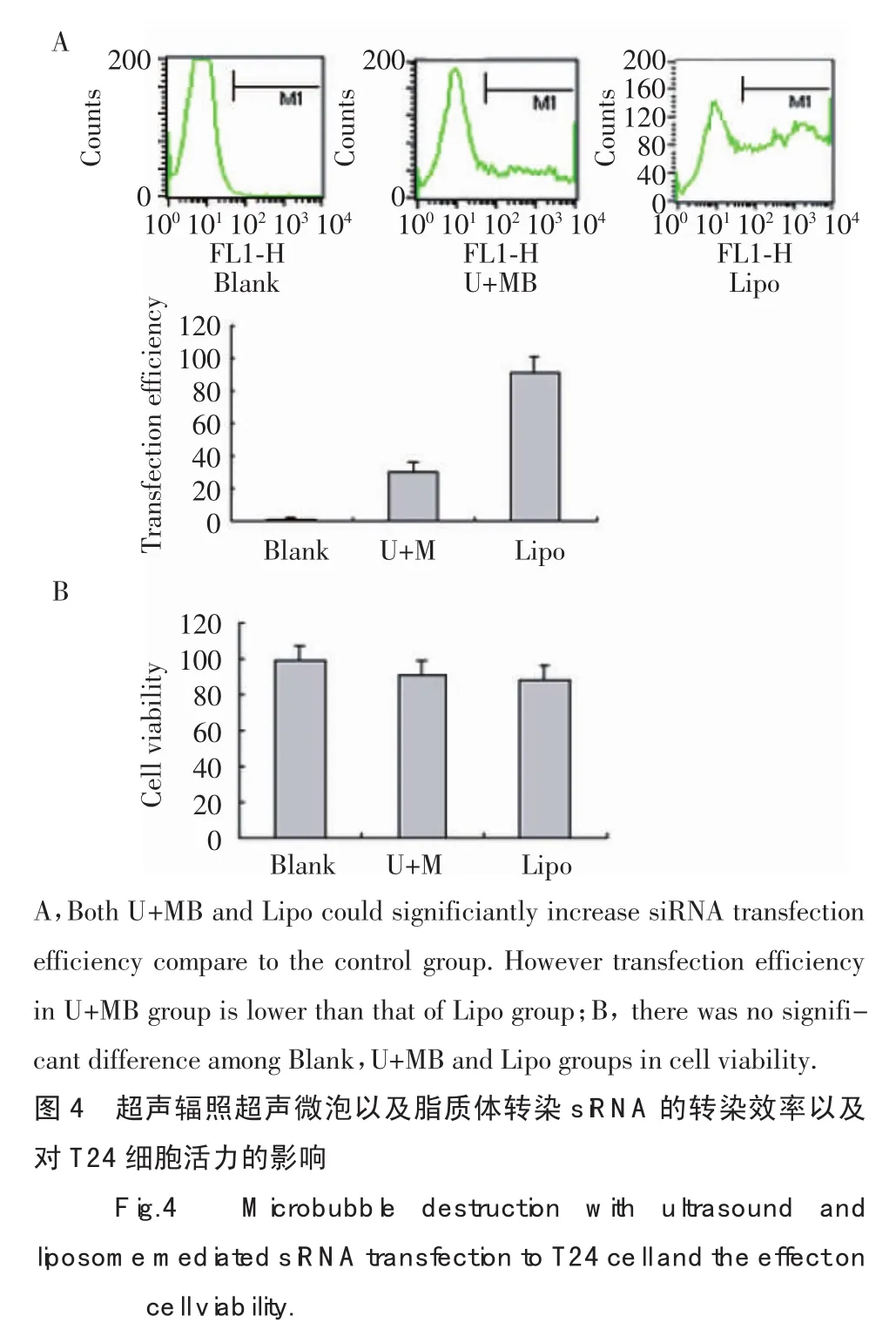
2.4 超声辐照超声微泡与脂质体体外转染siRNA的比较
进一步比较超声微泡介导的基因转染与脂质体转染效率与安全性。如图4A所示,超声辐照超声微泡转染组的转染效率[U+MB:(26.86±6.03)%]明显低于脂质体转染组[Lipo:(92.34±10.77)%],2 种方法的转染效率均显著高于空白对照。2种转染方法对细胞活力的影响没有显著性差异[U+MB:(90.46±9.04)%;Lipo:(87.66±8.07)%],(图 4B)。
3 讨论
使用分子生物学的方法对肿瘤进行基因治疗很可能成为临床肿瘤治疗的重要手段。安全、高效、特异的将治疗性外源基因输送到肿瘤靶细胞是各种肿瘤基因治疗策略成功的关键[5]。病毒载体具有较高的体内转染效率,然而机体对病毒载体潜在的免疫性以及病毒载体整合人基因组后的致畸性和致瘤性等难以克服的障碍限制了其在临床的应用[6]。阳离子脂质、脂质体、高分子载体材料等非病毒体内转染方法虽然具有制备简易,无免疫原性,相对安全等优点,但在体内转染的效率较低,靶向性差等问题仍有待进一步解决[7]。超声转染是一种新型的转染基因的方法,超声辐照超声微泡破裂后产生的机械效应和空化效应能够可逆性的增加细胞膜通透性,促进外源性基因片段进入到细胞内提高基因的转染效率[8]。此外,超声还可以实时监控超声微泡的分布,选择性的照射肿瘤部位,提高基因转染的靶向性。因此,超声辐照超声微泡的转染方法很可能是一种安全、高效、特异的体内基因转染手段。
超声微泡主要由外壳和内部包含的气体两部分组成,较早使用的超声微泡内含空气,目前常规使用的微泡内含惰性气体。以利声显为代表的第一代微泡声学造影剂,其包裹空气的壳厚,易破,谐振能力差,而且不够稳定。以声诺维为代表的第二代微气泡造影剂,其内含高密度的惰性气体六氟化锍,稳定性好。微泡的外壳主要分为3类:白蛋白类,脂质类,和高分子复合物类。相对于白蛋白外壳微泡,脂质类微泡具有更好的稳定性。在本实验中我们使用的是由重庆医科大学自制的内含惰性气体六氟化碳脂质类微泡,具有稳定性好,使用方便等特点。最近出现了高质量的新型声学造影剂,高安全性、低副作用,微泡大小均匀,直径小于10 μm并能控制,可自由通过毛细血管,有类似红细胞的血流动力学特征,稳定性好。然而这些商品化的超声微泡目前主要用于临床超声影响学诊断,用于介导基因转染还有待于进一步实验评估。
在本研究中,我们比较了单独使用超声照射、单独使用超声微泡造影剂以及超声微泡照射超声造影剂对siRNA转染效率的影响。单独使用超声照射或单独使用超声微泡几乎没有任何促进siRNA转染的效果,说明超声转染有赖于超声照射超声微泡的紧密结合,然而其具体的促进基因转染的机制仍然不清楚。较为可靠的机理可能是当超声照射超声微泡,微泡发生破裂后产生的机械效应和空化效应可以使细胞膜的通透性短时间内可逆性的增加,因此促进了外源性基因向细胞内的转移[9]。Taniyama使用电镜扫描超声转染后的细胞形态,证明细胞膜中出现较小的孔状结构,提示超声转染的重要机制之一是增加了细胞膜的通透性。Ran等体外培养大鼠肺动脉血管平滑肌细胞,加入造影剂后用超声辐照20 s,电镜观察证实平滑肌细胞及细胞膜的形态结构可见明显异常改变,细胞膜表面可见大小不等,数量不一的小孔,呈“弹坑”样或“火山口”样,实验结束后,继续培养24 h,这些特殊变化消失,证明出现的小孔是可逆的[10]。超声微泡破裂后对细胞引起的其他生物学效应仍知之甚少,进一步了解探明其发生作用的机制对改善超声微泡促进基因转染的效率具有重要意义。
在本实验中,我们进一步比较了超声微泡与脂质体基因转染效率以及对T24细胞活力的影响。超声微泡介导的基因体外转染效率仍明显低于脂质体介导的基因转染。脂质体目前体是体外基因转染最为常用的方法,具有转染效率高、细胞毒性低、使用方便、操作流程成熟等特点[11]。对于多数细胞而言,超声辐照超声微泡的体外转染效率大多不超过40%[12~14],超声微泡促进基因转染作为一种新的转染手段仍有许多问题需要进一步解决。首先,目前尚没有专门用于基因转染的商品化微泡转染试剂,商品化的微泡造影剂多为临床超声影像学诊断使用,而这些试剂用于基因转染是否需要进一步加工处理,改变、改良某些与基因转染相关的特性仍未有相关研究。其次超声微泡促进细胞转染的转染过程,具体参数缺乏标准化的流程,目前对于超声微泡促进基因转染尚处于研究阶段,这种转染方法还没有成为基因转染的常规手段,各种研究所报告的转染方法以及参数有较大差别,这可能与所使用超声微泡的特性,转染细胞的种类,超声辐照的方法等多种因素有关。然而超声微泡促进基因转染已经初步显示出其良好的临床应用价值,已有体内实验证明它是一种有效的体内基因转染方法,随着超声微泡促进基因转染具体机制研究的不断深入以及转染方法的不断改进,超声微泡基因转染技术很可能成为有力的基因转染方法。
[1]Oh YK,Park TG.siRNA delivery systems for cancer treatment[J].Adv Drug Deliv Rev,2009,61(10):850-862.
[2]Li L.,Shen Y.Overcoming obstacles to develop effective and safe siRNA therapeutics[J].Expert Opin Biol Ther,2009,9 (5):609-619.
[3]Sharma A,Tandon M,Bangari DS,et al.Adenoviral vector-based strategies for cancer therapy[J].Curr Drug ther,2009,4(2):117-138.
[4]Feril LB Jr.Ultrasound-mediated gene transfection[J].MethodsMol Biol,2009,542:179-194.
[5]Wang SL,Yao HH,Qin ZH.Strategies for short hairpin RNA delivery in cancer gene therapy [J].Expert Opin Biol Ther,2009,9(11):1357-1368.
[6]Sharma A,Tandon M,Bangari DS,et al.Adenoviral vector-based strategies for cancer therapy[J].Curr Drug ther,2009,4(2):117-138.
[7]Al-Dosari M S,Gao X.Nonviral gene delivery:principle,limitations,and recent progress[J].AAPS J,2009,11(4):671-681.
[8]Yoon C S,Park JH.Ultrasound-mediated gene delivery [J].Expert Opin Drug Deliv,2010,7(3):321-330.
[9]Reslan L,Mestas JL,Herveau S,et al.Transfection of cells in suspension by ultrasound cavitation [J].J Con Relea,2010,142(2):251-258.
[10]Wang ZG,Ling ZY,Ran HT.Experimental study on ultrasoundmediated microbubble destruction deliver VEGF gene to myocardium of rats and its bioloyical effects [J].Chi J Med Imag Tech,2004,19(6):656-658.
[11]Schwendener RA.Liposomes in biology and medicine[J].Adv Exp Med Biol,2007,620 :117-128.
[12]Mehier-Humbert S,Bettinger T,Yan F,et al.Influence of polymer adjuvants on the ultrasound-mediated transfection of cells in culture[J].Eur J Pharm Biopharm,2009,72(3):567-573.
[13]Li Y S,Davidson E,Reid CN,et al.Optimising ultrasound-mediated gene transfer(sonoporation)in vitro and prolonged expression of a transgene in vivo:potential applications for gene therapy of cancer[J].Cancer Lett,2009,273(1):62-69.
[14]Duvshani-Eshet M,Baruch L,Kesselman E,et al.Therapeutic ultrasound-mediated DNA to cell and nucleus:bioeffects revealed by confocal and atomic force microscopy [J].Gene Ther,2006,13(2):163-172.
