猪繁殖与呼吸综合征病毒柳州地方株NSP2和ORF5基因变异分析
2011-08-16韦正吉严斯刚
韦正吉,陈 强,严斯刚
(广西柳州市动物疫病预防控制中心,广西柳州 545005)
高致病性猪蓝耳病(HP-PRRS)经过2006—2007年的全国大流行后[1-5],在2008—2009年较为平稳,仅出现零星散发。2009年年底在河南、湖北和山东等省出现了较大范围的高致病性猪蓝耳病流行。2010年4月份开始在福建、广东和广西等南方省份部分养猪密集的区域出现了高致病性猪蓝耳病的疫情,其中有些猪场发病非常严重,造成了较大的损失。主要表现为母猪发烧、停食、怀孕母猪大范围流产、母猪或生长肥育猪有较高的死亡率,产房小猪和保育猪死亡率较高,可达到80%甚至100%。
蓝耳病病毒经过几年的演化变异后,在临床上出现了新毒株的流行趋势,病毒基因是否又出现了新的特点。为弄清这次流行病的病原特点,我们从本地检测的PRRSV阳性病料进行了NSP2和ORF5基因的序列测定及分析,以为柳州本地预防和控制猪繁殖与呼吸综合症提供理论数据。
1 材料与方法
1.1 毒株
对2010年6—9月临床送检的疑似猪蓝耳病病料经RT-PCR方法检测[6],选择2份阳性病料作为猪繁殖与呼吸综合征病毒测序的模板,病料编号为LZ5和LZ6;PRRSV疫苗毒株(CH-1R株)购自上海海利生物药品有限公司。
1.2 主要试剂
UNIQ-10柱式Trizol总RNA抽提试剂盒,购自生工生物工程(上海)有限公司;rTaq DNA聚合酶、反转录酶(AMV)、RNA 酶抑制剂、dNTP(10 mmol/μL)、随机引物(9mer)和 DNA Marker,购自宝生物工程(大连)有限公司;DNA凝胶回收试剂盒购自东盛生物公司;限制性内切酶和pMD18-T载体购自宝生物工程(大连)有限公司;大肠杆菌(E.coli)DH5α为广西大学动物科学技术学院惠赠。
1.3 引物的选择与合成
根据GenBank中猪繁殖与呼吸综合征病毒(PRRSV)的基因序列及有关文献[1,7]设计针对NSP2和ORF5基因的引物。引物序列如下:NSP2-F1:5'-CAA CAC CCA GGC GAC TTC AGA AAT G-3';NSP2-R1:5'-CCA AGT CAG CAT GTC AAC CCT ATC-3',所扩增的片段理论大小约为796bp。ORF5-F1:5'-CTG AGA CCA TGA GGT GGG CAA CT-3';ORF5-R1:5'-CAT CACTGGCGT GTA GGT AAT AGA AAA C-3',所扩增的片段理论大小约为748 bp。引物委托宝生物工程(大连)有限公司合成。引物合成后,稀释至25 pmol/μL,-20℃保存备用。
1.4 病毒核酸抽提
PRRSV的总RNA根据UNIQ-10柱式Trizol总RNA抽提试剂盒说明方法进行提取,抽提所得的总RNA立即进行反转录合成cDNA或-70℃保存备用。
1.5 cDNA第一链的合成
将抽提所得的总RNA进行cDNA的合成,RT反应条件:采用25μL的cDNA合成体系,即于0.2 mL反应管中,PRRSV的RNA样品各15.5μL,分别加入5×RT Buffer 5μL,Random 9mers(50pmol/μL)1μL,dNTP Mixture(10mmol/μL each)2 μL,Rnase Inhibitor(40 U/μL)0.5 μL,AMV Reverse Transcriptase XL(5U/μL)1μL,置于PCR仪中进行cDNA合成,以25 ℃10 min,42℃ 60 min,96℃ 2 min的程序进行一个循环,结束cDNA合成后,进行PCR扩增或-20℃保存备用。
1.6 NSP2和ORF5基因的PCR扩增
PCR反应均采用25.0μL的反应体系,即10×PCR Buffer 2.5 μL、MgCl21.5 μL、dNTPs 1.0 μL、Taq DNA聚合酶 0.3μL、引物各 1.0μL、模板 2.0μL,最后用灭菌双蒸水补至25.0μL。经反复筛选,NSP2基因扩增的PCR反应最优条件为:95℃预变性5 min;然后 94 ℃ 1 min、59 ℃ 40 s、72 ℃ 50 s,进行35个循环;最后72℃延伸10 min。ORF5基因扩增的PCR反应最优条件为:95℃预变性5 min;然后94℃1 min、56℃ 50 s、72℃ 1 min,进行 35个循环;最后72℃延伸10 min。
1.7 DNA回收与纯化
PCR产物的纯化,采用凝胶电泳切胶回收。用DNA凝胶回收试剂盒(东盛生物)回收电泳PCR产物50μL,经回收后溶解于30μL无菌双蒸水中,-20℃保存备用。
1.8 连接、转化、克隆及基因测序
将RT-PCR扩增片段纯化回收后,按pMD18-T载体说明书,分别将目的基因连接入pMD18-T载体中,按常规方法转化大肠杆菌DH5α感受态细胞,挑选白斑,接种于含有氨苄青霉素(100μg/mL)的LB液体培养基中,37℃振荡培养过夜。每个毒株挑选五个克隆摇菌,用碱裂解法提取质粒,以PCR法及酶切法鉴定筛选阳性重组子,并由宝生物工程(大连)有限公司测序。应用DNA Star软件对测序结果进行分析。
2 结果与分析
2.1 目的基因的RT-PCR
用所设计的引物分别进行RT-PCR扩增NSP2和ORF5基因,分别获得与预期片段大小相符的特异性片段。所选的阳性样品LZ5、LZ6能扩出NSP2基因大小约为796 bp的片段,扩出ORF5基因大小约为748 bp的片段,均与预期相吻合(图1、2)。
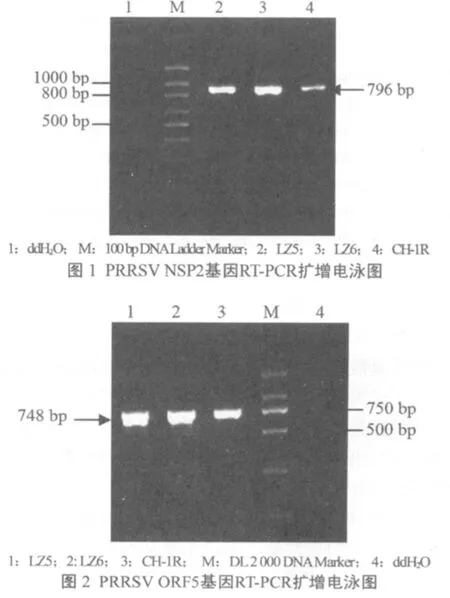
2.2 NSP2和ORF5基因cDNA的克隆及鉴定
NSP2和ORF5基因的RT-PCR产物经纯化后,分别插入pMD18-T载体的外源基因插入位点。挑取转化DH5α后的单菌落(白斑)进行培养,直接以培养的菌液为模板进行PCR鉴定,分别扩增出NSP2基因(约796 bp)和ORF5基因(约748 bp)目的片段。所选的PCR阳性质粒经酶切鉴定,都出现预期的目的片段。
2.3 NSP2和ORF5基因序列的测定
选2个鉴定为阳性的重组质粒进行测序,获得LZ5、LZ6株目的基因片段核苷酸序列,部分NSP2基因序列长均为796bp,含ORF5基因序列长均为749 bp。通过Blast分析表明两者均为PRRSV基因序列。
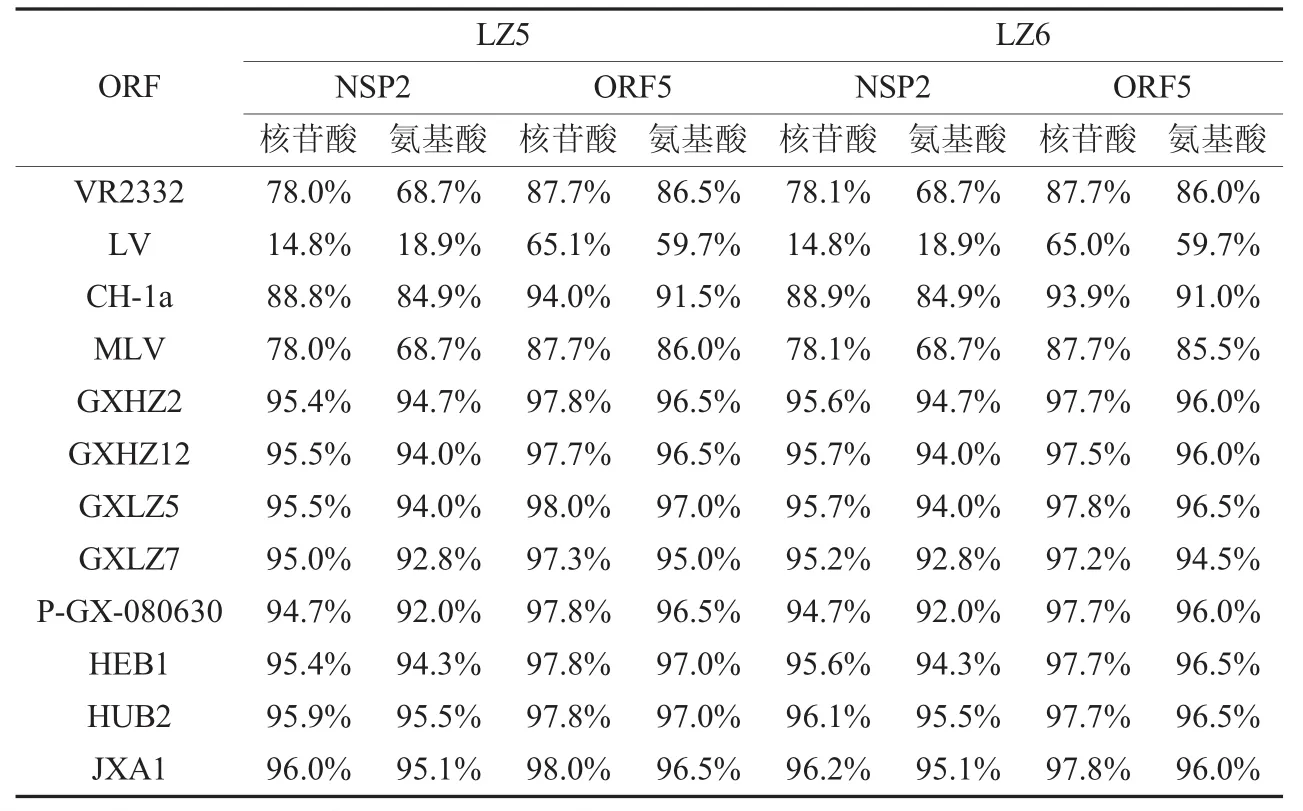
表1 LZ5、LZ6与其它毒株之间的NSP2、ORF5核苷酸序列及氨基酸序列同源性

2.4 序列分析
运用DNAStar分析软件将所测得的柳州流行毒株LZ5、LZ6的部分NSP2基因、ORF5基因与已发表的VR2332株、LV株、CH-1a株、MLV株和国内高致病性蓝耳病代表性毒株HEB1、HUB2、JXA1及近年广西分离的部分代表性毒株进行核苷酸及其推导的氨基酸序列同源性比较,结果见表1。LZ5与LZ6之间的NSP2和ORF5基因的核苷酸序列同源性分别为99.5%和99.7%,其推导的氨基酸序列同源性分别为100%和99.5% ;LZ5、LZ6的NSP2基因与近年国内分离的高致病性蓝耳病代表性毒株基因序列高度同源,具有完全一致的缺失特征,在NSP2基因的第483位和535~563位氨基酸发生缺失(图3)。
2.5 系统进化分析
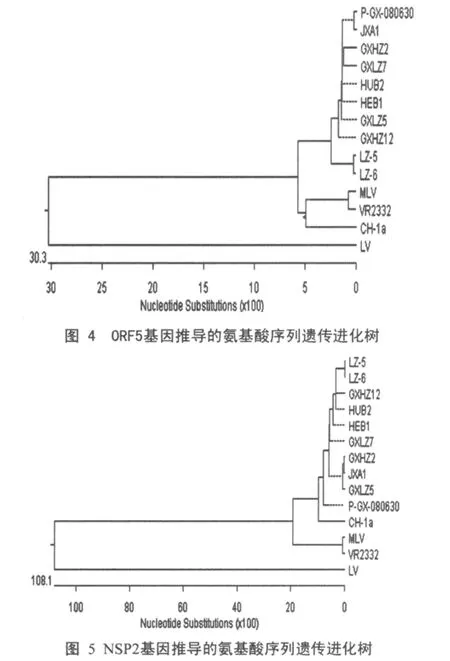
应用DNAstar软件中的MegAlign功能,分别绘制柳州PRRSV流行株 LZ5、LZ6与国内外标准参考毒株及部分广西代表性毒株NSP2和ORF5基因推导的氨基酸序列遗传进化树。根据ORF5基因氨基酸序列绘制的遗传进化树,所比较的14个PRRSV毒株明显分为两个基因群(图4)。欧洲型代表毒株LV与其它毒株距离都很远,为单独一群。LZ5、LZ6和国内分离株与国际美洲型代表株VR2332关系较近,共同构成另一群,属美洲型,该群分为两个亚群:LZ5、LZ6 与 2006 年夏高热病PRRSV的代表性毒株HEB1、HUB2、JXA1 及 近 年 广西分离的高致病性蓝耳病毒株构成第一亚群;弱毒疫苗株MLV (RespPRRS/Repro)和 国内第一分离株CH-1a与VR2332株构成另一亚群。根据NSP2基因氨基酸序列绘制的遗传进化树与ORF5的结果大体一致(图 5),所变化的是 LZ5、LZ6和国内近年分离的高致病性PRRSV与CH-1a株遗传距离相对较近,共同构成美洲型(群) 的第一亚群,MLV和VR2332株则构成另一亚群。遗传进化树结合核苷酸及氨基酸序列同源性可以看出:LZ5、LZ6与近几年分离流行的高致病性蓝耳病毒株基因序列高度同源,与2006年夏高热病引起的PRRSV相比基因序列并未显示出新的特性,很有可能均是由国内第一分离株CH-1a变异进化而来。
3 讨论
3.1 根据DNAStar软件分析,本试验研究扩增的LZ5、LZ6株NSP2基因发生30个氨基酸的不连续缺失,具有与近几年国内分离的高致病性蓝耳病代表性毒株(HEB1、HUB2和JXA1)完全一致的基因序列缺失特征。结合临床病理特征表明,LZ5、LZ6株为流行于我市的高致病性PRRSV。
3.2 本研究柳州分离株LZ5与LZ6之间的NSP2和ORF5基因的核苷酸序列同源性分别为99.5%和99.7% ,其推导的氨基酸序列同源性分别为100%和99.5%;LZ5、LZ6与近年广西分离的高致病性PRRSV的NSP2和ORF5基因核苷酸序列同源性分别为94.7%~95.7%和97.2%~98.0%,其推导的氨基酸序列同源性分别为92.0%~94.7%和94.5%~97.0%;与2006年夏高热病PRRSV的代表性毒株(HEB1、HUB2和JXA1)基因核苷酸序列同源性分别为95.4%~96.2%和97.7%~98.0%,其推导的氨基酸序列同源性分别为94.3%~95.5%和96.0%~97.0%。基因序列分析表明,LZ5、LZ6与2006年夏高热病引起的PRRSV基因序列高度同源,在基因序列上并未显示出新的特性,也未出现明显的地域差异性。
3.3 LZ5、LZ6株与欧洲型代表 LV株 NSP2和ORF5等位基因的氨基酸同源性分别为18.9%和59.7%,与美洲型代表VR2332株等位氨基酸同源性分别为68.7%和86.5%(或 86.0%),故 LZ5、LZ6属美洲型毒株,这与氨基酸序列遗传进化树划分的基因归属结果一致。
3.4 遗传进化树分析结果,LZ5、LZ6和近年分离的高致病性PRRSV与疫苗株MLV(RespPRRS/Repro)虽然同归属于美洲型(群),但确归属于不同的亚型。LZ5、LZ6与MLV的NSP2和ORF5等位氨基酸同源性分别为68.7%和86.0%(或85.5%),基因变异较大。结果表明柳州本地PRRSV野毒正向远离疫苗毒MLV的方向变异,提示在实际防疫中应该选择与当地流行毒株在抗原性上相关的种毒制备疫苗免疫是有效防控该病的关键。
[1]童光志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析 [J].中国预防兽医学报,2007,29(9):323-327.
[2]郝晓芳,周艳君,田志军,等.高致病性猪繁殖与呼吸综合征病毒RT-PCR鉴别诊断方法的建立 [J].中国预防兽医学报,2007,29(9):704-709.
[3]Tian K G,Yu X L,Zhao T Z,et al.Emergence of Fatal PRRSV Variants:Unparalleled Outbreaks of Atypical PRRS in China and Molecular Dissection of the Unique Hallmark[J/OL].PLoS ONE,2007,2(6):e526.http://www.plosone.org/article/info:doi/10.1371/journal.pone.0000526.
[4]谢丽基,谢芝勋,刘加波,等.广西高致病性PRRSV Nsp2基因的克隆、序列分析和抗原表位预测 [J].动物医学进展,2008,29(1):1-4.
[5]刘涛,陈赛娟,孙继国,等.河北猪繁殖与呼吸综合征病毒地方株HB-4(hs)株ORF5-7基因变异分析 [J].华北农学报,2008,23(4):32-36.
[6]韦正吉,严斯刚,黄小武,等.多重RT-PCR同时检测CSFV、PRRSV、HP-PRRSV方法的建立及其临床应用[J].广西农业科学,2009,40(11):1476-1480.
[7]李和平,吴发兴,郑忠屹,等.我国部分地区猪繁殖与呼吸综合征病毒分离株ORF5基因的遗传变异分析 [J].中国动物检疫,2005,22(10):23-26.
