新疆北疆部分规模猪场支原体肺炎流行病学调查
2011-08-16杨俊杰吕新刚
杨俊杰 ,李 石 ,李 劼 ,吕新刚
(1.兵团农九师畜牧科学研究所,新疆额敏 834601;2.石河子大学动物科技学院,新疆石河子 832003)
猪支原体肺炎(Mps)亦称猪气喘病、猪地方性流行性肺炎,是由猪肺炎支原体(Mhp)感染引起的一种慢性呼吸道传染病,通常引起猪群生产性能显著下降,受感染猪群日增重下降、饲料报酬降低等,给猪场造成严重的经济损失[1]。
为了解新疆北疆部分规模猪场中Mhp的感染情况,降低该病对养猪业的危害,对13个规模猪场进行了流行病学调查,现将调查结果报告如下。
1 材料与方法
1.1 材料
1.1.1 样品来源 采于北疆地区13个规模猪场,血清364份,病变肺脏72份。
1.1.2 检测试剂与仪器 猪肺炎支原体(Mhp)抗体检测ELISA试剂盒购于北京IDEXX;10×Buffer,dNTPs,Taq 酶,DNAMarker,PCR 仪 (Techentc512),酶标仪(Biotek)等。
1.2 方法
1.2.1 流行病学调查 2010年11月—2011年5月,对北疆13个规模猪场进行现场调查和问卷调查,调查猪支原体肺炎在猪场的流行情况,包括发病的数量、年龄、病死率、发病季节、传染源、传播途径、诱发因素以及主要临床症状等内容,掌握猪支原体肺炎流行的基本情况。
1.2.2 样品采集 无菌采集13个规模猪场不同年龄段的猪血(均未接种过猪肺炎支原体疫苗),待凝固后,4000r/min离心10min,-20℃保存。
剖检可疑病猪,观察心、肺、脾等组织病理变化。按参考文献[2]方法无菌采集肺脏、脾脏等病料,-20℃保存;另取病变肺脏浸泡于10%甲醛溶液中。
1.2.3 Mhp血清学检测 按试剂盒说明书操作。
1.2.4 病变组织PCR检测 DNA的提取参照文献提取[3]。阳性对照为南京天邦生物科技有限公司生产的猪支原体肺炎活疫苗(168株)。
PCR引物参考文献[4]合成1对Mhpldh引物,上游引物 p1 为:5'-CCGTTGAAGCCTTGCTGTAT-3',下游引物 p2 为:5'-CGGTTAGTGTCTCCCGTTATG-3',扩增片段大小为287bp。引物由上海申工公司合成。
PCR 体系 (25 μL):10×Buffer3 μL,10mM dNTPs0.6μL,上下引物各 1μL,模板 2μL,Taq酶0.3μL,补ddH2O至25μL。设定以下参数进行PCR反应:94℃预变性3min,94℃变性30S,54℃退火30S,72℃延伸40S,进行30个循环,72℃再延伸10min,4℃保存。取PCR产物进行琼脂糖凝胶电泳。
1.2.5 病理组织学观察 将通过PCR鉴定为阳性的肺脏组织,做病理切片。
2 结果与分析
2.1 流行病学调查结果 规模猪场中Mps主要发生于秋冬季,各年龄段猪匀易感,发病率高(30%~90%),死亡率低(8%~20%),仔猪发病后死亡率高。
病猪和带菌猪是主要传染源,感染母猪垂直传染给小猪,猪群间主要通过接触传染。
临床症状表现为咳嗽、气喘,明显的腹式呼吸,精神沉郁,食欲减退,生长发育停滞,日渐消瘦,被毛粗乱,混合感染其它病原时常出现体温升高。以慢性病例多见,病程长达数月。使用药物治疗只能减轻临床症状,停药后很快复发。寒冷、潮湿、拥挤的环境会加剧本病的发生。
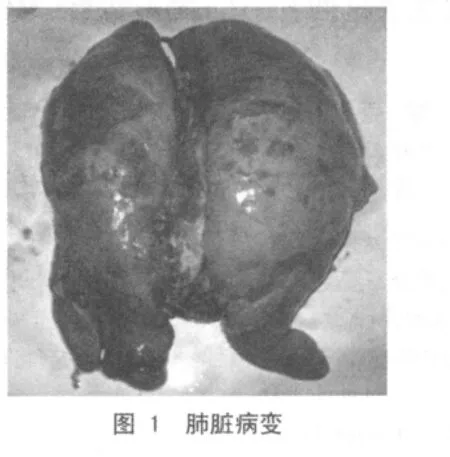
2.2 病理剖检结果 病肺呈现大面积肺炎以及不同程度的气肿;尖叶、心叶呈对称性实变,实变区大小不一,呈“肉样变”或“胰变”,硬度增强,病灶与非病变区有明显的界限(图1)。肺门淋巴结肿大、质硬,断面灰白色,呈髓样变。
2.3 Mhp血清抗体检测结果
2.3.1 各猪场血清抗体检测结果 Mhp抗体检测结果见表1
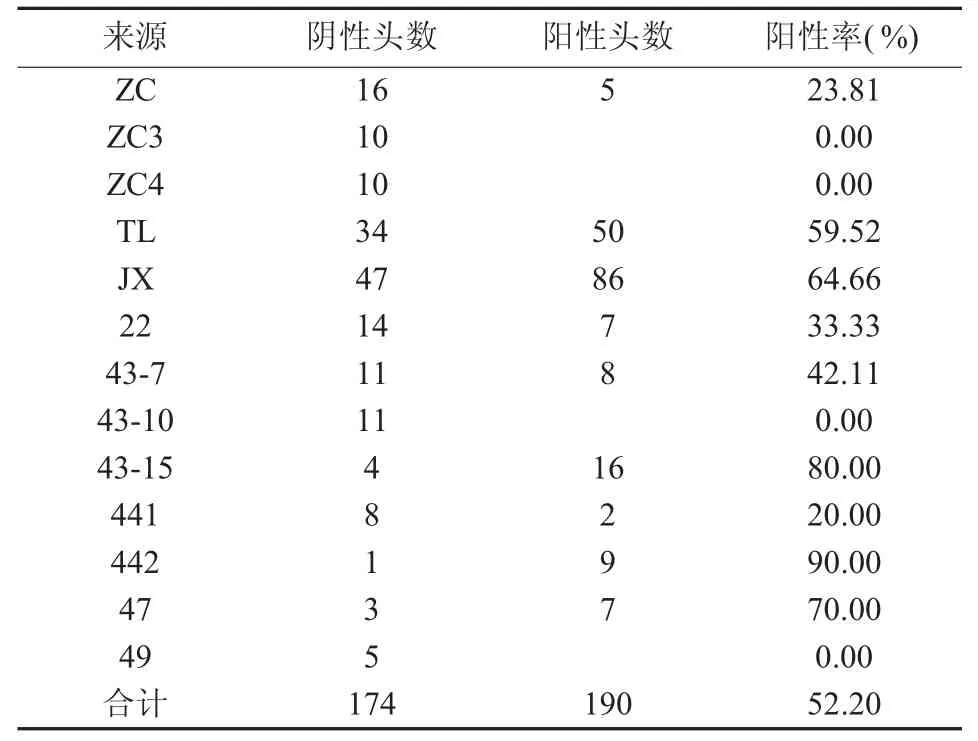
表1 Mhp抗体检测结果
结果显示:364份血清抗体阳性率为52.2%,13个规模猪场中阳性猪场有9个,猪场阳性率为69.23%;阳性率最高的猪场感染率达90%,说明部分规模猪场肺炎支原体感染情况比较普遍,个体感染情况比较严重。
2.3.2 不同年龄段Mhp抗体检测结果(见表2)
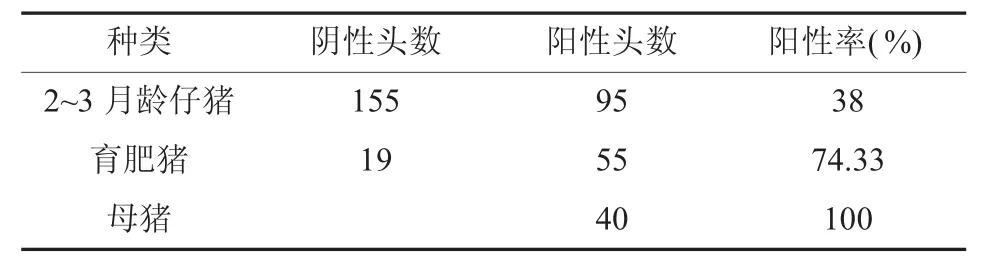
表2 不同年龄段Mhp抗体检测结果
由表2可知,不同年龄段猪Mhp的感染率不同,母猪感染率高达100%,仔猪感染率相对较低。原因可能是母猪呈隐性感染带菌或感染耐过后母猪在2~4胎后仍可携带此菌,哺育期仔猪与带菌母猪接触而被感染,此时仔猪从母乳获得了母源抗体的保护,但母源抗体不能保证新生仔猪免受感染。母源抗体从30天开始衰减,感染仔猪血清抗体逐渐转阳[5];即使仔猪未被感染,在断奶混群后如果与病猪和带菌猪接触也易被感染,猪感染肺炎支原体后需2~4周才能检测到抗体;因此育肥猪和母猪阳性率高于仔猪。
2.4 组织PCR检测结果 72份病变肺脏进行PCR检测,结果42份阳性,阳性率为58.33%,阳性率高于血清学检测结果。部分病变肺脏PCR检测结果见图2。

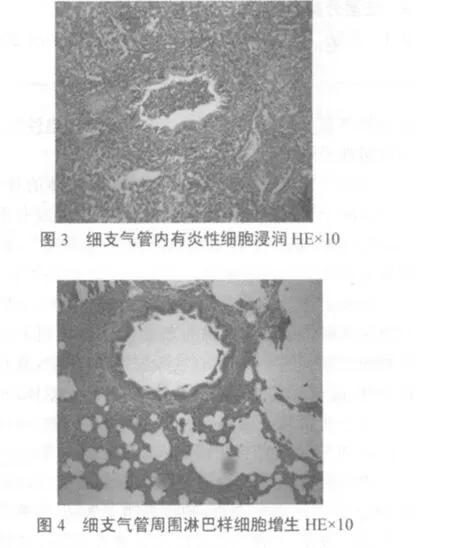
2.5 病理组织学观察 肺支气管内有淋巴样细胞浸润,夹杂有单核细胞,中性粒细胞及脱落的肺泡上皮细胞(图3),支气管周围淋巴样细胞增生(图4),从而使肺泡之间的间隙增厚。
3 讨论
猪支原体肺炎是猪呼吸道疾病综合征(PRDC)的重要病原之一,广泛分布于世界各地,其死亡率虽然不高,但由于流行的广泛性、长期性和消耗性,可使饲料转化率降低,并引起猪的多种并发病,是造成养猪业经济损失最重要的疾病之一[6]。常呈隐性发病,多取慢性经过,一旦感染,便难以消除。
血清学诊断虽然可以检测出Mhp抗体的存在,作为诊断是否感染肺炎支原体的依据,但并没有直接检测其病原,由于个体血清转阳时间差异较大,因此仅仅依靠血清学诊断来确诊其感染支原体还不够。
利用PCR方法进行猪肺炎支原体的检测,为确定猪感染率提供了更加精确的方法[7]。本试验用于PCR检测病变肺脏的Mhpldh(乳酸脱氢酶)引物,具有种特异性,能与其它种类的支原体(如猪鼻支原体)相区分[8],进一步提高了检测结果的准确性。因此,血清学方法和PCR方法结合可得到满意的诊断结果。
本研究首次系统地进行了新疆北疆部分规模猪场Mhp的流行病学调查,初步查明了Mhp的感染情况和流行规律,为该病的诊断和制定有效防控措施提供了科学依据。
[1]周绪斌,DanielT,李聪,等.规模化猪场肺炎支原体血清学动态监测与启示[J].猪业科学,2008(8):90-94.
[2]农业部畜牧兽医局.NY/T541-2002动物疫病实验室检验采样方法[S].北京:中国标准出版社,2002.
[3]刘茂军,张映,邵国青,等.猪支原体肺炎可疑肺组织PCR检测方法的建立 [J].山西业大学学报:自然科学版,2009,29(5):444-447.
[4]薛云,赵战勤,陈杨,等.多重PCR方法快速检测猪的5种呼吸道病原菌[J].畜牧兽医学报,2009,40(8):1222-1228.
[5]嵇辛勤,段志强,华再东,等.香猪场肺炎支原体的血清学调查与分析[J].黑龙江畜牧兽医,2009(9):92-93.
[6]李彦明,张映.猪肺炎支原体及其生物学研究进展[J].动物医学进展,2003,24(3):25-27.
[7]Marina Sibila,Maria Pieters,Thomas Molitor,etal.有关猪肺炎支原体感染诊断方法和流行病学的最新观点[J].沈权,译.国外畜牧学 -猪与禽,2009,29(3):4-10.
[8]Caron J,Ouardani M,Dea S.Diagnosis and differentiation ofmycoplasma hyopneumoniae and Mycoplasma hyorhinis infectionin pigs by PCR amplification of the p36 and p46 genes [J].JClin Microbiol,2000,38(4):1390-1396.
