兔SAH后NF-kB与脑血管内皮细胞凋亡及脑血管痉挛的关系
2011-08-07吴问亮徐善水
吴问亮,徐善水
(皖南医学院附属弋矶山医院 神经外科,安徽 芜湖 241001)
蛛网膜下腔出血(Subarachnoid hemorrhage,SAH)后脑血管痉挛(Cerebral Vasospasm,CVS)最早由Ecker和Riemenschneider在1951年提出,并经脑血管造影证实。近半个世纪以来,关于SAH后CVS产生的原因有大量的研究,一般认为SAH后CVS的发生是多因素、多环节的。最近的研究表明,SAH后血管内皮细胞存在凋亡,且血管内皮细胞凋亡在CVS形成机制中具有重要作用[1]。
NF-kB(核转录因子-kB)是 1986 年由 Sen 和Bltimore[2]在成熟的B淋巴细胞发现的一种重要的转录因子,因其能够与B细胞免疫球蛋白的K亲链基因的增强子kB序列(5'GGGACTTTCC3')特异结合而得名。研究表明,活化的NF-kB在细胞凋亡中具有抗凋亡和促凋亡双重作用。一些实验研究观察到在不同类型的细胞培养和体内模型中,NF-kB的活化可阻止细胞凋亡,抑制NF-kB活性可加重组织的损伤。Hill等[3]在大鼠的大脑中动脉缺血再灌注模型中,用NF-kB抑制剂PDTC(吡咯烷二硫代甲酸氨盐)抑制NF-kB的活化后发现脑组织神经细胞凋亡和脑组织的梗死体积较对照组明显增加。但关于NF-kB的活化对细胞凋亡的作用,也有学者得出相反的结果。肖国民等[4]使用β-七叶皂甙治疗创伤性脑水肿发现β-七叶皂甙可以抑制NF-kB的活性,进而达到减轻脑水肿的作用。
以上研究均表明,脑部在受到各种刺激后,NF-kB在中枢神经系统各部位均有表达,研究结果发现DCVS的这种凋亡现象既包括了海马、皮层等对缺血缺氧敏感的部位,也包括了基底节、皮质下等对缺血缺氧相对耐受的部位。然而,SAH后CVS所致的脑损害过程中,NF-kB与痉挛血管壁内皮细胞,平滑肌细胞之间的关系如何,是促进内皮细胞凋亡还是抑制凋亡?需要做进一步的研究。
1 材料和方法
1.1 实验动物 成年新西兰白兔40只,雌雄不分,兔龄4~6个月[南京青龙山动物实验中心提供,许可证号:scxk(苏)(2007-0008),体重2.0 ~2.5 kg]。
1.2 试剂 即用型SABC免疫组化染色试剂盒(5%BSA封闭液,二抗:山羊抗兔IgG,SABC:链酶亲和素-生物素-过氧化物酶复合物),细胞凋亡试剂盒(标记缓冲液,末端脱氧核糖核酸转移酶TDT,DIG-dUTP,封闭液,生物素化抗地高辛抗体,SABC,ProteinaseK,抗体稀释液),PDTC,以上材料均由武汉博士德公司提供。
1.3 动物分组 新西兰纯种大白兔40只,雌雄不限,月龄4 ~6 个月,平均体重(2.1 ±0.4)kg。按照完全随机的原则分三组:对照组、SAH组和干预组。其中空白对照组8只,SAH组根据不同时间点分为SAH 3 d组、SAH 7 d组、SAH 14 d组、每组8只,干预组8只为在7 d时间点注血后加入NF-kB的抑制剂PDTC(吡咯烷二硫代甲酸氨盐)SAH+PDTC。
1.4 SAH模型的制作 采用3%戊巴比妥(30 mg/kg),外缘耳静脉麻醉,用22G双腔套管针与躯体成角约30°穿刺枕大池,方向指向右眼外眦,当穿破环枕筋膜时有突破感,停止进针,退出针芯。按照0.8 ml/kg的剂量缓慢抽取脑脊液,自耳中央动脉快速抽取自体动脉血0.8 ml/kg缓慢注入枕大池,历时30 s。48 h后重复上述过程。
1.5 标本及病理切片的制备 实验兔分别在各时间点处死,将颅顶枕骨及上段颈椎棘突和双侧椎板咬除,取出脑组织及附有基底动脉全长的脑干部分。用于形态学观察的标本直接投入10%的福尔马林中,脱水后石蜡包埋,在切片机上切成5 μm的切片。HE染色,免疫组化染色方法(SABC法),TUNEL法检测基底动脉细胞凋亡均根据试剂盒要求操作。
2 结果
2.1 基底动脉管径和厚度测量 对照组基底动脉内径及管壁厚度基本正常。SAH组3 d、7 d、14 d与对照组相比管径明显变狭窄、管壁明显增厚,有显著差异,均产生脑血管痉挛,以7 d最为显著。在7 d时间点,与SAH组动脉内径比较,SAH+PDTC组痉挛血管明显缓解(见表1,图1、2)
表1 对照组与SAH各组不同时间点兔基底动脉直径变化(102μm,±s)Tab1 Changes in rabbits of the basilar artery diameter at different time points between control group and SAH group(102μm,±s)

表1 对照组与SAH各组不同时间点兔基底动脉直径变化(102μm,±s)Tab1 Changes in rabbits of the basilar artery diameter at different time points between control group and SAH group(102μm,±s)
SAH组与对照组比较,▲P<0.05(SNK-q检验);干预组与SAH 7 d比较,★P <0.05(SNK-q检验)
组别 n 直径 F值 P值23.99 ±2.00 SAH 3 d 组 8 15.80 ±2.40▲SAH 7 d 组 8 11.09 ±1.54▲ 59.233 <0.01 SAH 14 d 组 8 17.46 ±0.98▲干预组 8 19.60 ±1.47对照组8★
2.2 基底动脉壁NF-kB的表达 光学显微镜下观察结果的判断标准:NF-kB免疫组化染色后细胞核中有棕黄色颗粒者为NF-kB阳性表达细胞。每张切片随机选取5个不重叠视野,采用病理图文管理系统4.10(北航图像中心)记录阳性细胞百分比。
NF-kB免疫阳性反应主要在基底血管内皮细胞和平滑肌细胞胞核内表达,着色均匀,对照组仅有NF-kB少量表达。SAH组NF-kB表达明显从胞浆移位于胞核。在注血后3 d,NF-kB的免疫阳性反应在内皮细胞、平滑肌细胞和边缘部位可以观察到,呈浅黄色;注血后7 d,NF-kB免疫阳性反应可以在整个动脉壁内皮细胞和平滑肌细胞内观察到,着色均匀呈棕黄色且胞核染色增强;注血后14 d,NF-kB的免疫阳性反应明显减弱。SAH+PDTC组对NF-kB阳性细胞表达较SAH 7 d组明显下降(P<0.05)(见表 2,图3、4)。
表2 对照组与SAH各组不同时间点兔基底动脉NF-kB阳性细胞百分比变化(%,±s)Tab 2 Percentage fluctuation of the positive cells of the NF-kB in basilar artery of rabbits at separate time points between control group and SAH group(%,±s)
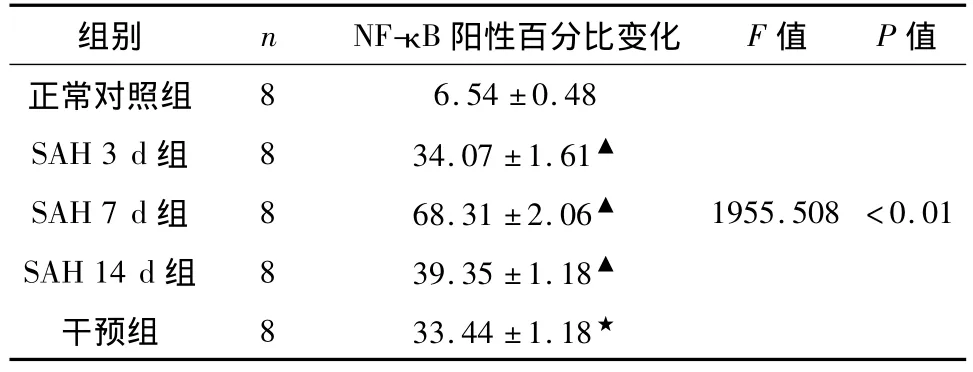
表2 对照组与SAH各组不同时间点兔基底动脉NF-kB阳性细胞百分比变化(%,±s)Tab 2 Percentage fluctuation of the positive cells of the NF-kB in basilar artery of rabbits at separate time points between control group and SAH group(%,±s)
SAH组与对照组比较,▲P<0.05(SNK-q检验);干预组与SAH 7 d比较,★P <0.05(SNK-q检验)
组别 n NF-kB阳性百分比变化 F值 P值6.54 ±0.48 SAH 3 d 组 8 34.07 ±1.61▲SAH 7 d 组 8 68.31 ±2.06▲ 1955.508 <0.01 SAH 14 d 组 8 39.35 ±1.18▲干预组 8 33.44 ±1.18正常对照组8★
2.3 凋亡细胞TUNEL检测结果 结果判定:细胞核中有棕黄色颗粒者为阳性细胞,即凋亡的细胞。TUNEL反应呈阳性的内皮细胞定位在皱缩的内弹力层表面,呈阳性反应的平滑肌细胞定位在血管中膜。在SAH组各时间点,细胞凋亡指数随时间呈现先增加后减少的趋势。SAH 7 d组基底动脉内皮细胞和平滑肌细胞的细胞核呈显著的TUNEL阳性反应。在SAH+PDTC组,有少量呈阳性表达的内皮细胞和平滑肌细胞,细胞凋亡指数较SAH 7 d组显著下降(P<0.05)。对照组的标本中几乎没有TUNEL反应阳性细胞(见表3,图5、6)。
表3 对照组与SAH组不同时间点兔基底动脉细胞凋亡指数变化(%,±s)Tab3 Change of the apoptosis index for basilar artery of rabbits at different time points between control group and SAH group(%,±s)
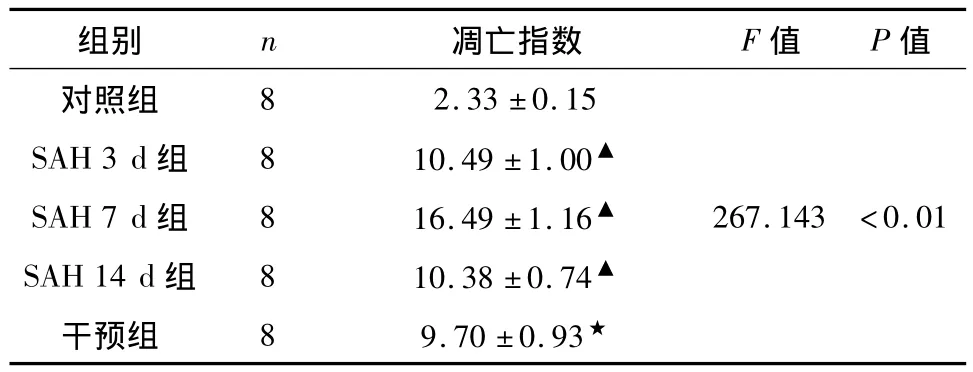
表3 对照组与SAH组不同时间点兔基底动脉细胞凋亡指数变化(%,±s)Tab3 Change of the apoptosis index for basilar artery of rabbits at different time points between control group and SAH group(%,±s)
SAH组与对照组比较,▲P<0.05(SNK-q检验);干预组与SAH 7 d比较,★P <0.05(SNK-q检验)
组别 n 凋亡指数 F值 P值2.33 ±0.15 SAH 3 d 组 8 10.49 ±1.00▲SAH 7 d 组 8 16.49 ±1.16▲ 267.143 <0.01 SAH 14 d 组 8 10.38 ±0.74▲干预组 8 9.70 ±0.93对照组8★

3 讨论
3.1 内皮细胞凋亡和脑血管痉挛 细胞凋亡又称程序性细胞死亡(programmed cell death,PCD),是指细胞在一定的生理或病理条件下,通过启动其自身内部机制而发生的细胞自杀性死亡过程。细胞凋亡形态上表现为胞核致密深染、胞体变小。本实验发现,对照组实验兔基底动脉TUNEL染色仅见微量凋亡内皮细胞表达;在SAH组3 d、7 d、14 d各时间点兔基底动脉形态学显示的血管痉挛改变(包括血管直径变狭窄和血管厚度增加)先加重后缓解,与之对应SAH组各时间点兔基底动脉TUNEL染色呈阳性反应的内皮细胞先增加后减少,细胞凋亡指数先上升后减少,说明SAH后CVS的出现是与内皮细胞凋亡的发生相伴随的。而国内外一些学者[5]认为凋亡在7 d以前表达最为明显,而血管痉挛发生在凋亡之后。分析其不同原因可能在于:①实验选取的动物不同。在本次实验中,我们选用兔制作SAH后CVS模型是因为兔脑内外循环之间没有丰富的血管网沟通,其血管类型比猫狗更接近于人,枕大池注血方法相对简单且血管痉挛效果满意。在SAH后CVS的发展时序中,兔已被证明表现为双时相,即早期CVS和迟发性CVS,此过程与人类CVS的发展时序相似。②注血方法的不同。本实验采用二次注血法优点在于操作简单,而且可以很好地控制出血速度和出血量。注血法是由于脑池内血块分解出代谢产物氧合血红蛋白,而氧合血红蛋白被认为是细胞凋亡的主要诱因,其再作用于血管内皮需要一段时间,因而可能表现为凋亡时间延迟。注血法不足之处在于反复穿刺可加重症状,本实验中时间窗过小也可能是导致结果不同的一个原因。③此外,注血量的不同也可能导致痉挛出现的时间不一样。2002年,Zubkov等[6]用电镜和脑血管造影观察犬SAH模型后3 d、5 d和7 d内皮细胞形态改变与CVS的关系,结果显示注血后第3天内皮细胞开始出现核染色体边集浓缩、胞膜芽生出泡和胞浆浓缩等凋亡样改变。并且上述病理改变的程度和范围与基底动脉痉挛程度和时程相一致,于基底动脉痉挛程度最严重的第7天达高峰。与本实验研究结果一致。正常情况下,内皮细胞衬贴在血管内壁,通过细胞间紧密连接形成单层连续的腔面,是物质转运的屏障。研究表明,SAH后CVS血管壁存在细胞凋亡,而且细胞凋亡在CVS形成过程中起着重要作用。其可能机制是,凋亡导致血管内皮细胞功能发生变化,造成缩血管和扩血管物质分泌失衡,NO和前列环素等扩血管物质显著减少,引起血管收缩;另一方面,内皮细胞凋亡导致血管完整性破坏,从而将血管平滑肌暴露于缩血管物质,加剧了CVS。此外,受损的内皮细胞还可引发血栓形成,造成血管狭窄,加重CVS后缺血性脑损伤[7]。
3.2 NF-kB与细胞凋亡 本次实验中应用免疫组化实验检测NF-kB蛋白的表达,NF-kB阳性细胞表现为胞核黄染。我们发现在注血后3 d,NF-kB的免疫阳性反应在内皮细胞、平滑肌细胞和边缘部位可以观察到,呈浅黄色;注血后7 d,NF-kB免疫阳性反应可以在整个动脉壁内皮细胞和平滑肌细胞内观察到,着色均匀呈棕黄色且胞核染色增强;注血后14 d,NF-kB的免疫阳性反应明显减弱。应用 PDTC(NF-kB特异性抑制剂)对兔二次枕大池注血后CVS的干预发现,在缓解基底动脉形态学改变的同时可以减轻基底动脉细胞凋亡指数及NF-kB表达;用TUNEL测定凋亡的细胞发现与NF-kB表达的时间一致。国内周政等[8]用兔二次枕大池注血发现NF-kB蛋白在出血后7 d达高峰,随后逐渐回落。与本实验研究结果一致。Hickenbottom等[9]用二次注血法诱导犬脑出血模型,发现在出血后4 d NF-kB水平升高1.8~2.5倍,分析其不同结果原因可能在于实验动物的不同和注血量的差异所造成。以上结果均表明NF-kB可以促进细胞凋亡,且与凋亡程度一致。关于NF-kB对内皮细胞凋亡的作用机制,我们可以从以下几个方面来探讨。
3.2.1 NF-kB与促凋亡基因 近年,对脑血管病研究的重要进展就是脑缺血诱导神经细胞凋亡过程中,凋亡相关基因的表达及作用。研究证实,SAH后,可诱导内皮细胞产生促凋亡因子如P53、C-myc、Bax等,经过级联反应,最后激活蛋白酶Caspase导致细胞凋亡。半胱天冬酶(caspase)是一类半胱氨酸天门冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,caspase或Casp)家族的简称,是一切凋亡信号转导的共同通路。Bcl-2(B淋巴细胞瘤基因)家族是与细胞凋亡相关中最受关注的基因之一。Bax与Bcl-2的相对比值在决定细胞生存或死亡中可能起关键作用。正常情况下Bcl-2/Bax比例保持着动态平衡,当在病理情况下,比值下降时,细胞就开始凋亡[10],报道低氧可诱导 NF-kB 活化,从而降低凋亡抑制因子 bcl-2蛋白的表达,使促凋亡因子caspase-3活性增加,引起细胞凋亡。Zhou等[11]在犬二次注血致CVS的模型中发现基底动脉Bax表达明显升高,而Bcl-2明显降低,同时也发现内皮细胞和平滑肌细胞凋亡。这也表明Bcl-2家族在SAH后CVS的血管壁细胞的凋亡中扮演重要角色。p53是最常见的促凋亡基因,具有降低bcl-2、升高bax蛋白的作用。另有利用转基因小鼠证明,缺失p53对脑缺血有保护作用,降低p53表达可以缓解SAH后血管痉挛[12],NF-kB 激活后,也可以上调 C-myc基因的表达,导致细胞凋亡。
3.2.2 NF-kB 与 NO、NOS NO(nitric oxide,一氧化氮)是中枢神经系统的一种可逆信使及气体性神经递质,对维持血管舒张,血流量及血压调节起重要作用。NOS(nitric oxide synthase,一氧化氮合成酶)是NO生物合成调节最关键的因素,是合成NO的关键酶,其亚型可分为诱导型NOS(induced NOS,iNOS),内皮型 NOS(endothelial NOS,eNOS)和神经元型NOS(neurons NOS,nNOS)。iNOS在通常状况下不表达,在某些病理条件下如高血压,蛛网膜下腔出血等条件下可诱导表达。由iNOS诱导生成的NO在氧化应激中生成的某些过氧化亚硝酸盐阴离子可损伤脑血管并可使血管壁发生重构而狭窄。我国台湾学者Chih-Lung Lin等[13]报道雌二醇能够抑制NF-kB的表达来降低iNOS的生成,并通过降低内皮素的合成来起到脑保护的作用。其机制在于:iNOS在5区存在NF-kB的目的基因,NF-kB被激活后能引起iNOS表达的增加,而雌激素可竞争性P65受体来影响NF-kB的生成,从而进一步来抑制iNOS的合成。NO一方面通过产生高反应性自由基、脂质过氧化、抑制线粒体酶、干扰基因转录以及参与炎症反应等作用导致细胞损伤,另一方面又有阻止细胞色素C的释放、抑制cGMP2依赖的凋亡、降低半胱天冬氨酸酶活性等细胞保护机制,故NO生成增多在CVS中的作用尚需进一步明确。
3.2.3 NF-kB与TRAF家族 肿瘤坏死因子受体偶联因子(Tumor necrotic factor receptor associated factor,TRAF)家族是一种重要的接头分子,目前发现的人类TRAF分子中以TRAF-2研究较为广泛。TRAF-2分子在NF-kB激活的信号转导过程中扮演重要的角色。通过激活NF-kB诱导激酶(NF-kB inducing kinase,NIK),由 NIK 活化 NF-kB 和 I-kB 的复合物,引起I-kB降解,释放有活性的NF-kB,通过激活凋亡执行蛋白 Caspase,从而诱发细胞凋亡。Zhou等[11]报道了NF-kB在SAH后CVS中的变化,最终发现SAH组的NF-kBDNA结合活性的基因表达量均显著增加,而给予NF-kB抑制剂组中,其含量均显著降低。
由于NF-kB是一种转录因子,其生物学作用就缺血再灌注损伤方面而言,涉及到炎症、自由基、凋亡等诸多病理过程,简单地去界定其一方面的作用,是目前各研究产生不同甚至相反结果的一个重要原因。NF-kB活化的调控是一个非常精细的过程,除受细胞因素的影响外,还与机体的内环境有关。何时诱导NF-kB活化?以及活化的持续时间及强度如何控制?由于NF-kB所涉及的调控机制众多,所以关于其在SAH后在引起迟发性血管壁病理变化的机制还需进一步研究,而且这些方面的研究可能为临床药物的开发及SAH后CVS的治疗开辟新的道路。
[1]GAO CHENG,LIU WEI,SUN ZHI DAN,et al.Atorvastatin ameliorates cerebral vasospasm and early brain injury after subarachnoid hemorrhage and inhibits caspase-dependent apoptosis pathway[J].BMC Neuroscience,2009,10(7):384 -397.
[2]SEN R,BALTIMORE D.Multiple nuclear factors interact with the immunoglobulin enhancer sequences[J].Cell,1986,46(5):705-716.
[3]HILL,HESS,CARROLL,et al.The NF-kappaB inhibitor diethyldithiocarbamate(DDTC)increases brain cell death in a transient middle cerebral artery occlusion model of ischemia[J].Brain Res Bull,2001,55(3):375 - 386.
[4]XIAO GM,WEI J.Effects of β-Aescin on the expression of nuclear factor-kB and tumor necrosis factor-α after traumatic brain injury in rats[J].Zhejiang Univ Sci B,2005,6(1):28 -32.
[5]OGIHARA K,ZUBKOV AY,BERNANKE DH,et al.Oxyhemoglobin-induced apoptosis in cultured endothelial cells[J].Neurosugery,1999,91:459 -465.
[6]ZUBKOV AY,TIBBS RE,CLOWER B,et al.Morphological changes of cerebral arteries in a canine double hemorrhage model[J].Neurosci Lett,2002,326(2):137 -141.
[7]王宣之,徐善水.细胞凋亡与蛛网膜下腔出血后脑血管痉挛[J].国际脑血管病杂志,2009,17(5):382 -385.
[8]张建忠,周政,刘俊,等.NF-kB在兔蛛网膜下腔出血模型基底动脉中的表达及其与血管平滑肌增殖的关系[J].第三军医大学学报,2010,32(18):1976 -1980.
[9]HICKENBOTTOM S,GROTTA J,STRONG R,et al.Nuclear factor-kB and cell death after experimental intracerebral hemorrhage in rats[J].Stroke,1999,30(11):2472 - 2477.
[10]ROGERIO F,JORDAO H J,VIEIRA A S,et al.Bax and Bcl-2 expression and TUNEL labeling in lumbar enlargement of neonatal rats after sciatic axotomy and melatonin treatment[J].Brain Res,2006,111(21):80 -90.
[11]ZHOU ML,SHI JX,HANG CH,et al.Potential contribution of nuclear factor-kappaB to cerebral vasospasm after experimental subarachnoid hemorhage in rabbits[J].Cereb Blood now Metab,2007,27(9):1583 - l592.
[12]WEI CHEN,JIE HOU,YAN YIN.Alpha-Bisabolol induces dose and time dependent apoptosis in HepG2 cells via a Fas-and mitochondrial-related pathway,involves p53 and NF-KB[J].Biochemical Pharmacology,2010,80(2):247 -254.
[13]CHIH-LUNG LIN,AARON S.DUMONT,et al.Attenuation of subarachnoid hemorrhage-induced apoptotic cell death with 17 betaestradiol[J].Neurosurg,2009,111:1014 - 1022.
