PCR法检测血液中白色念珠菌的敏感性研究
2011-08-07熊延靖
熊延靖,董 群
(皖南医学院 微生物学与免疫学教研室,安徽 芜湖 241002)
白色念珠菌(Candida.albicans,C.albicans)是寄居在正常人体消化道、呼吸道和女性生殖道黏膜上的正常菌群,也是念珠菌属中最常见的一种条件致病菌。近年来,由于免疫抑制剂的大量应用,肿瘤放疗、化疗,侵入性治疗,器官移植的开展,以及大量广谱抗生素的广泛应用导致正常菌群失调,白色念珠菌的感染率和发病率较以往有明显的增加[1,2]。1995~2002年美国49所医院连续7年的监测资料表明,念珠菌败血症在医院感染败血症中居第4位,病死率则居首位[3]。目前临床对该病的诊断主要依靠血培养和组织病理检查,但阳性率低且耗时长,致使不少患者因病情延误导致治疗失败,甚至丧失生命。因此,快速、准确地从临床标本中直接检出白色念珠菌对于疾病的早期诊断和治疗具有十分重要的意义。随着分子生物学的发展,包括PCR法在内的多种分子生物学技术开始应用于真菌病的诊断和研究,其敏感性高、特异性强、重复性好、快捷方便等优点引起了广大学者的高度关注。本研究旨在通过建立白色念珠菌DNA提取法和了解PCR检测的灵敏度,为进一步探索PCR技术在临床白色念珠菌的鉴定和白色念珠菌病的早期诊断中的应用奠定基础。
1 材料与方法
1.1 供试菌株 白色念珠菌(Candida.albicans,C.albicans)标准菌株:AX2-2086,购自广州市微生物研究所。临床分离念珠菌两株,经科马嘉培养基及API 20C AUX酵母菌鉴定系统鉴定,为白色念珠菌。
1.2 主要试剂与仪器 改良沙氏(Sabourand)固体培养基,ACD抗凝剂,红细胞裂解液,白细胞裂解液,琼脂糖,10×TAE缓冲液,1%琼脂糖凝胶,Biospin真菌基因组DNA提取试剂盒;引物1,2:根据真菌内转录间隔区(ITS)设计通用引物一对,由上海生工生物技术有限责任公司合成。ITS1:5'-TCC GTA GGT GAA CCT GCG G-3',ITS4:5'-TCC TCC GCT TAT TGA TAT GC-3';ESCO CLASSⅡBSC生物安全柜,MC012532型PCR热循环分析仪,BIO-RAD凝胶成像分析系统,ZF型紫外分析仪。
1.3 方法
1.3.1 白色念珠菌培养及菌液制备 将白色念珠菌标准菌株及两株临床分离菌株分别接种于改良沙氏固体培养基上,37℃细胞培养箱中培养48 h后,经无菌生理盐水洗下制成菌悬液,血球计数板调至浓度为2×107/ml,4℃冰箱保存备用。
1.3.2 白色念珠菌DNA的提取 用无菌生理盐水分别洗下培养48 h的白色念珠菌苔(标准菌株及临床分离菌株),9 000 rpm离心1 min,弃去上清,收集菌体。按Biospin真菌基因组DNA提取试剂盒说明书提取上述菌株DNA。
1.3.3 PCR特异性扩增 PCR反应成分(终浓度):1 × PCR Buffer液,1.5 mmol/L MgCl2,0.2 mmol/L dNTP,0.2 μmol/L 上、下游引物,DNA 模板,2.5U Taq DNA聚合酶,灭菌去离子水混至50 μl。扩增程序为:94℃预变性5 min、94℃变性30 s、58 ℃退火 60 s、72 ℃ 延伸 60 s,35 个循环、72 ℃延伸7 min。扩增完毕后,产物于4℃保存,等待电泳。
1.3.4 PCR扩增产物检测 取扩增产物依次点样于1% 琼脂糖凝胶(含 EB 0.5 μg/ml),于1×TAE电泳缓冲液中电泳,在紫外分析仪和BIO-RAD凝胶成像分析系统上进行分析、照相。
1.3.5 PCR敏感度测定 抽取健康人血液经ACD抗凝剂抗凝后,加入白色念珠菌标准菌株菌液,使其浓度依次为:1×106个/ml、1×105个/ml、1×104个/ml、1 ×103个/ml、1 ×102个/ml、1 ×101个/ml、1×100个/ml,制备成血液白色念珠菌感染模拟标本。取各浓度白色念珠菌感染模拟标本1 ml移入灭菌的Ep管中,加入0.8 ml红细胞裂解液,充分混匀后置37°C水浴箱中孵育10 min后取出,5 000 rpm离心10 min。重复此步骤一次。然后弃去上清,在沉淀中加入白细胞裂解液1 ml,充分振荡混匀后置65°C水浴箱中孵育1 h,取出,5 000 rpm 离心10 min,弃去上清,收集沉淀。按Biospin真菌基因组DNA提取试剂盒说明书提取DNA,PCR扩增,并设立阳性对照和阴性对照。
2 结果
2.1 白色念珠菌DNA的提取及PCR扩增结果见图1。
白色念珠菌标准菌株及临床分离菌株经DNA提取和PCR扩增后,扩增产物经1%琼脂糖凝胶电泳检测。结果显示,除阴性对照未见条带外,其余各样本均可扩增出约为500 bp的特异性条带。

图1 PCR产物电泳图谱Fig 1 Electrophoregram of PCR products
2.2 PCR敏感度测定结果 见图2。
从白色念珠菌标准菌株浓度分别为1×106个/ml、1 ×105个/ml、1 ×104个/ml、1 ×103个/ml、1 ×102个/ml、1 ×101个/ml、1 ×100个/ml的血液感染模拟标本中提取DNA并经PCR扩增后,于1% 琼脂糖电泳检测。结果显示,除阴性对照未见条带外,其余各样本均可扩增出约为500 bp的特异性条带。
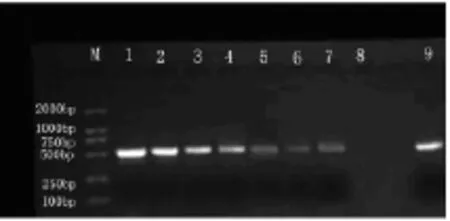
图2 不同浓度白色念珠菌PCR产物电泳图谱Fig 2 Electrophoregram of PCR products from different concentration of Candida albicans
3 讨论
系统性白色念珠菌病由于临床症状不典型,患者的临床表现亦无特异性,极易与细菌感染相混淆,故早期临床诊断比较困难。目前对该病的诊断主要依靠血培养和组织病理检查,但由于念珠菌病菌血症持续时间短且活菌数少[4],而组织穿刺往往不易被病人接受,且穿刺部位及所取组织量也会影响诊断结果。导致检测结果阳性率低且耗时长(通常需5~7 d),致使不少患者因延误治疗而病情加重甚至死亡。
近年来,随着分子生物学技术的发展,分子手段开始广泛地应用到临床疾病的诊断中。真菌DNA的提取方法有很多种,如氯化苄法[5]、蜗牛酶破壁法[6]、液氮研磨法[7]等。在本实验中,我们采用Biospin真菌基因组DNA提取试剂盒提取白色念珠菌标准菌株及两株临床分离菌株的DNA,并进行PCR扩增。所采用的引物为内转录间隔区(internal transcribed spacer region,ITS)通用引物 ITS1和ITS4。ITS1与18S rDNA的一段序列互补,具有一定的种间特异性和种内保守性。该对引物扩增片段包括ITSⅠ区、ITSⅡ区和5.8S rDNA。通过与标准分子量(2 000 ku)比较,该引物能将白色念珠菌DNA扩增出500 bp左右的特异性条带,与文献报道一致[8]。
在血液白色念珠菌感染模拟标本中,我们采用红、白细胞裂解液处理全血标本后,按照Biospin真菌基因组DNA提取试剂盒说明书提取DNA并进行PCR扩增,同样扩增出500 bp左右的特异性条带,并且能检测出1×100个/ml的白色念珠菌。说明此种方法在检测血液样本中白色念珠菌的敏感度高,可行性好,结果稳定。
全血白色念珠菌从DNA提取到PCR扩增的全部过程只需6 h,远远低于血培养和组织病理检查的时间,大大缩短了临床诊断时间,为疾病的治疗争取时间。说明PCR法不仅灵敏度高、特异性强,而且具有快速、方便、重复性好的优点,可以为白色念珠菌感染的早期诊断提供实验依据。
[1]廖万清,吴绍熙.病原真菌生物学研究与应用[M].第1版.北京:化学工业出版社,2006:106-107.
[2]廖万清,顾菊林.深部真菌感染治疗的现状与对策[J].中国感染与化疗杂志,2007,7(2):101-103.
[3]WISPLINGHOFF H,SEIFERT H,TALLENT SM,et al.Nosocomial bloodstream infections in pediatric patients in United States hospitals:epidemiology,clinical features and susceptibilities[J].Pediatr Infect Dis J,2003,22(8):686-691.
[4]GAVIRIA JM,VAN BURIK JA,DALE DC,et al.Comparison of interferon-gamma,granulocyte colony-stimulating factor,and granulocyte-macrophage colony-stimulating factor for priming leukocytemediated hyphal damage of oppeotunisticfungal pathogens[J].J Infect Dis,1999,179(4):1038-1041.
[5]朱衡,瞿峰.利用氯化苄提取适于分子生物学分析的真菌DNA[J].真菌学报,1994,13(1):34-40.
[6]王萍,董群,厉荣玉.白假丝酵母菌分离和鉴定方法的探讨[J].皖南医学院学报,2007,26(2):91-93.
[7]张明,赵呈裕.丝状真菌高分子量DNA的提取研究[J].广西医科大学学报,1998,15(2):41-43.
[8]SCHALLER M,BOELD U,OBERBAUER S,et al.Polymorphonuclear leukocytes(PMNs)induce protective Th1-type cytokine epithelial responses in an in vitro model of oralcandidosis[J].Microbiology,2004,150(9):2807-2813.
