4-HPR体外诱导A549细胞凋亡与Bax/Bak蛋白相关性研究
2011-08-07桂淑玉
张 玲,桂淑玉,左 莉,何 苇,周 青,汪 渊
(1.皖南医学院 生物化学教研室,安徽 芜湖 241002;2.安徽医科大学第一附属医院 呼吸内科,安徽 合肥 230022;3.安徽医科大学 分子生物学实验室,安徽 合肥 230022)
肺癌居全球癌症病死率之首,目前化学药物应用在其治疗过程中仍起到重要作用。N-(4-羟基苯基)维生素甲酰胺(4-HPR)是反式维甲酸(ATRA)的衍生物之一,它将ATRA羧基端以一个酰胺基所连接的4-羟苯基取代,是一种活性很高的凋亡诱导因子[1]。本研究观察了4-HPR对人肺腺癌细胞株A549体外生长抑制作用和诱导凋亡情况,并对其机制进行初步探讨。
1 材料与方法
1.1 试剂 ATRA和4-HPR购于Sigma公司,用二甲基亚砜(DMSO)溶解各配制成10 mmol/L的储备液,-20℃避光保存,使用前用细胞培养液稀释到所需浓度。细胞凋亡-Hoechst染色试剂盒购于Beyotime公司。
1.2 实验分组、细胞培养和倒置显微镜观察 实验分6个组,即细胞对照组、溶剂对照组(1‰的DMSO)、1 μmol/L ATRA 组、5 μmol/L ATRA 组、1 μmol/L 4-HPR 组、5 μmol/L 4-HPR 组。将肺腺癌细胞A549培养于含10%小牛血清(购于杭州四季青生物公司)的DMEM(GIBICO公司)培养基中,置37℃、饱和湿度、5%CO2培养箱中。待细胞呈对数期生长时加药处理,3 d后倒置显微镜下观察6个处理组细胞生长情况及形态变化,并拍照记录。肺腺癌细胞株购于ATCC,由安徽医科大学分子生物学实验室保存。
1.3 Hoechst 33258凋亡染色 取普通洁净无菌处理盖玻片置于24孔板内,按4×104/孔种入细胞,次日更换培养基,按1.2中实验分组培养,每组4个实验复孔。待细胞长至约50%~60%时进行染色。吸尽培养液,固定20 min;PBS洗涤;加入Hoechst 33258染色液染色5 min;PBS洗涤;滴抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,使细胞生长面接触封片液。荧光显微镜调节激发波长在350 nm左右,发射波长在460 nm左右,观察细胞核形态并拍照记录。
1.4 Western Blot观察细胞Bax/Bak、P53的表达收集药物处理3 d的细胞,PBS漂洗,加入蛋白提取缓冲 液 (Tris-HCl,pH 7.4;150 mmol/L NaCl,1 mmol/L EDTA,1%Triton,0.1%SDS,5 mg/L Leupeptin,1 mmol/L PMSF)裂解细胞,离心收集蛋白。蛋白定量采用 BCA(Bicinchoninic acid)(PIERCE,USA)法。上样50 μg蛋白进行 SDS-PAGE电泳。然后将蛋白转移至PVDF(聚偏氟乙烯)膜上。5%脱脂奶粉封闭2 h,加入抗兔多克隆抗体Bak、P53,抗鼠单克隆抗体Bax、β-actin(Santa Cruz,USA)4 ℃孵育过夜,经PBST洗涤后再加入相应浓度的二抗(PIERCE,USA)室温孵育2 h,洗涤后在暗室中加ECL(PIERCE,USA)检测试剂,用 X线片曝光,显影,定影。
2 结果
2.1 不同实验组A549细胞生长和形态变化 药物处理3 d后,倒置显微镜下观察可见细胞和溶剂对照组及1 μmol/L ATRA组A549细胞密度大,生长旺盛,光泽度好(如图1A~C);5 μmol/L ATRA组细胞密度减小,无堆叠生长,但形态改变不明显(如图1D);1 μmol/L 和5 μmol/L 4-HPR 组细胞数量明显减少,生长稀疏,光泽度下降,细胞变小变圆,失去正常生长,高浓度组现象更明显(如图1E、F)。与前期研究[2]MTT实验结果相吻合。
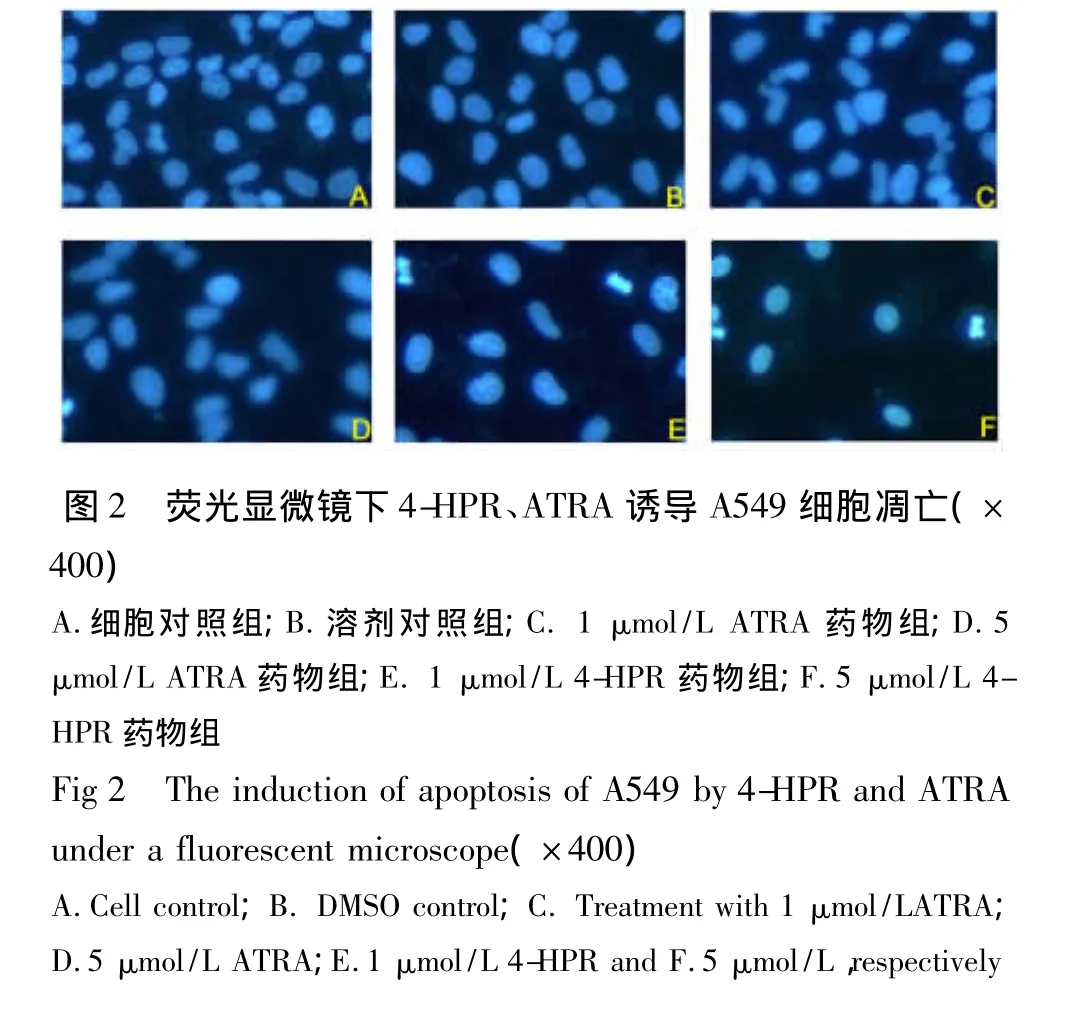
2.2 不同实验组诱导A549细胞凋亡 不同浓度药物处理3 d后,行Hoechst染色检测细胞凋亡情况。显微镜下可见1 μmol/L ATRA组(如图2C)细胞核与对照组(如图2A、B)区别不大;5 μmol/L ATRA组(如图2D)细胞核数目相比对照组减少,有凋亡小体出现;1 μmol/L 4-HPR 和 5 μmol/L 4-HPR处理组(如图2E、F)细胞核数目较对照组明显减少,细胞核致密浓染或碎裂,折光性增强,高浓度组更明显。与我们前期研究[2]流式细胞术检测调亡的结果相吻合。

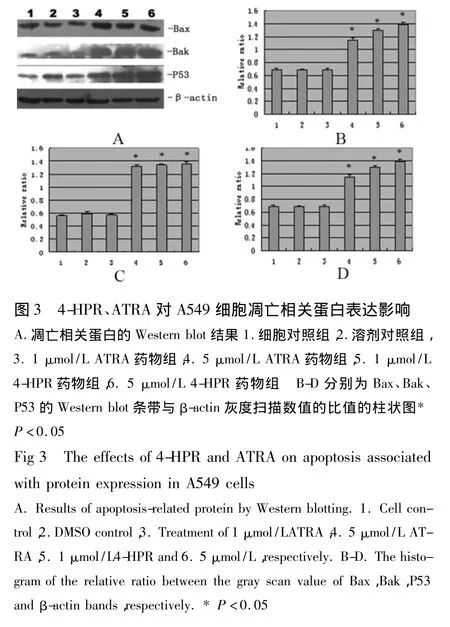
2.3 不同实验组对A549细胞凋亡相关蛋白表达的影响 收集药物处理3 d的A549细胞,提取蛋白后行Western blot检测凋亡相关蛋白表达情况。从图3 可以看出,1 μmol/L 4-HPR 和5 μmol/L 4-HPR处理组促凋亡蛋白Bax/Bak的表达增加;转录调节因子P53表达亦增加,并随药物浓度的提高而显著增强。1 μmol/L ATRA组蛋白表达变化不明显,5 μmol/LATRA组促凋亡蛋白Bax/Bak以及P53的表达亦增加。
3 讨论
肺腺癌在各类肺癌中约占20% ~30%,女性病人多见,男性亦有增多趋势,发病年龄较小,早期一般没有明显临床症状,易发生早期转移,病死率较高。对放疗不敏感,化疗仍是其目前主要治疗方法。4-HPR是ATRA衍生物之一,与其他维甲酸类化合物相比其毒性小,在临床上已经成为非常有潜力的癌症预防药物[3]。它能抑制多种类型的肿瘤细胞增殖,包括头颈鳞癌[3]、肺癌[4]、乳腺癌[5]等。本课题组前期实验[2]和现阶段研究均显示其有明显的抑制肺腺癌A549细胞增殖,诱导凋亡的作用。抗癌促凋亡机制目前仍不清楚。有报道显示4-HPR诱导一些类型的头颈部鳞癌和非小细胞肺癌细胞的凋亡,不能被抗氧化剂和 RAR特异阻断剂所抑制[1]。前期研究[2]显示其诱导凋亡与抗凋亡蛋白Bcl-2、Bcl-xS/L表达下降相关,提示4-HPR诱导细胞凋亡机制可能与Bcl-2家族相关。Bcl-2家族蛋白位于线粒体信号通路上游,对线粒体诱导的凋亡具有重要的调节作用[6]。根据Bcl-2家族蛋白在细胞凋亡中的功能分为两类,一类是抗凋亡的,如:Bcl-2、Bcl-xS/L等;一类是促进凋亡的,如 Bax、Bak等。Bax/Bak位于胞浆,激活后转位到线粒体膜上,能够在线粒体外膜形成同源聚合物,促进凋亡因子的释放,诱导细胞凋亡。Bcl-2、Bcl-xS/L通过与促凋亡蛋白形成异源二聚物抑制Bax/Bak的活化。本次实验Western Blot检测Bax/Bak蛋白表达显示:药物作用同时,促凋亡蛋白Bax/Bak表达增多。验证了之前的推论。
本次研究亦观察到P53蛋白表达在4-HPR诱导A549细胞凋亡过程中显著提高。P53是抑癌基因p53表达的蛋白,与细胞周期的调控、细胞分化、细胞凋亡等重要生物学功能有关。相关报道指出山楂酸诱导人结肠癌HT-29细胞凋亡是通过激活P53促发线粒体相关凋亡通路,伴有Bax表达增加和Bcl-2表达减少[7];生长抑素诱导大肠癌细胞凋亡的同时伴随Bax的高表达,P53和Bcl-2的低表达[8];国内亦有研究指出4-HPR在体内外抑制肝癌细胞增殖的过程中,出现P53过表达和Bcl-2/Bax表达比率下降[9]。以上均提示4-HPR诱导肺腺癌A549细胞凋亡可能依赖P53的Bcl-2家族通路来发挥作用。
ATRA是4-HPR的前体,在研究中作为对照药物,对于该药体外抑制细胞增殖、诱导凋亡和作用机制一并进行了探讨。相继研究结果表明[2,10],高浓度组(5 μmol/L)有较弱抑制细胞增殖、促进凋亡的作用,凋亡相关蛋白表达水平亦有一定改变。综合国内外报道[11,12],考虑 ATRA 对 A549 细胞作用可能以促进分化为主。
总之,4-HPR通过上调Bax/Bak的表达促进A549细胞凋亡,P53参与该药物作用的信号通路,凋亡作用机制的进一步阐明,将为肺腺癌病人的治疗提供新思路。
[1]SUN SY,LI W,YUE P,et al.Mediation of N-(4-Hydoxyphenyl)retinamide-induced apoptosis in human cancer cells by different mechanisms[J].Cancer Res,1999,59(10):2493-2498.
[2]张玲,桂淑玉,李庆,等.4-HPR体外诱导 A549细胞凋亡与Bcl-2家族蛋白相关性研究[J].安徽医科大学学报,2007,42(6):616-619.
[3]SHISHODIA S,GUTIERREZ AM,LOTAN R,et al.N-(4-Hydroxyphenyl)retinamide inhibits invasion,suppresses osteoclastogenesis,and potentiates apoptosis through down-regulation of IkBα kinase and nuclear factor-kB-regulated gene products[J].Cancer Res,2005,65(20):9555-9565.
[4]SUN SY,SCHROEDER CP,YUE P,et al.Enhanced growth inhibition and apoptosis induction in NSCLC cell lines by combination of celecoxib and 4HPR at clinically relevant concentrations[J].Cancer Biol Ther,2005,4(4):407-413.
[5]SIMEONE AM,DENG CX,KELLOFF GJ,et al.N-(4-Hydroxyphenyl)retinamide is more potent than other phenylretinamides in inhibiting the growth of BRCA1-mutated breast cancer cells[J].Carcinogenesis,2005,26(5):1000-1007.
[6]白世平,罗绪刚,吕林,等.线粒体在细胞凋亡中的介导作用[J].生命科学,2006,18(4):368-372.
[7]REYES-ZURITA FJ,PACHON-PENA G,LIZARRAGA D,et al.The natural triterpene maslinic acid induces apoptosis in HT29 colon cancer cells by a JNK-p53-dependent mechanism[J].BMC Cancer,2011,11(1):154-188.
[8]茆家定,吴佩,夏祥厚,等.生长抑素与大肠癌细胞凋亡及调控基因bcl-2、bax及p53关系的研究[J].皖南医学院学报,2003,22(4):250-252.
[9]SHENTU J,ZHANG B,FAN L,et al.Anti-proliferative activity of fenretinide in human hepatoma cells in vitro and in vivo[J].Anticancer Drugs,2007,18(1):47-53.
[10]桂淑玉,张玲,李庆,等.ATRA诱导A549细胞凋亡机制的初步探讨[J].安徽医学,2008,29(1):1-3.
[11]CSOMÓS K,NÉMET I,FÉSÜS L,et al.Tissue transglutaminase contributes to the all-trans-retinoic acid-induced differentiation syndrome phenotype in the NB4 model of acute promyelocytic leukemia[J].Blood,2010,116(19):3933-3943.
[12]倪永丰,牛朝诗,陈建民,等.全反式维甲酸对脑肿瘤干细胞增殖和分化的影响[J].中华神经医学杂志,2009,8(3):240-245.
