RP-HPLC测定盐酸卡替洛尔骨架缓释微丸的含量及有关物质
2011-08-04罗永煌田翠翠戈振凯张玉洁罗玲艳
张 贺 罗永煌 田翠翠 戈振凯 张玉洁 罗玲艳
(西南大学药学院,重庆 400715)
盐酸卡替洛尔(Carteolol Hydrochloride)最早由日本大冢制药株式会社于1972年研制成功,1991年收载于日本第十二版药局方[1],剂型有片剂、颗粒剂、滴眼剂和缓释胶囊剂等。中国药典从2000年版开始收载盐酸卡替洛尔,目前仅有滴眼剂上市。在日本、美国等,盐酸卡替洛尔已广泛用于高血压、心律失常、心绞痛、心肌梗死以及心脏神经症(Cardiac Neurosis)和小儿法洛四联症(Congenital Fetralogy of Fallot)等的治疗[2,3],是国外目前唯一一个上市的用于治疗心脏神经症的β受体阻断剂,有效率可达73%以上[4]。本课题组与重庆市北碚现代应用药物研究所合作,研发了盐酸卡替洛尔骨架缓释微丸,该缓释微丸能够实现药物12h内缓慢释放,提供平稳的血药浓度,减少服药次数,提高患者的依从性。迄今为止,国内外未见盐酸卡替洛尔骨架缓释微丸的研究报道,仅有本课题组申请的盐酸卡替洛尔缓释微丸专利[5]。
2010年版中国药典采用电位滴定法测定盐酸卡替洛尔原料药的含量,采用紫外-可见分光光度法测定盐酸卡替洛尔滴眼液含量[6],本文参照美国药典对盐酸卡替洛尔普通片的含量测定方法[7],建立了RPHPLC测定盐酸卡替洛尔骨架缓释微丸含量及有关物质的方法。
1 仪器与试药
1.1 仪器
高效液相色谱仪(SPD-M20A检测器,LC-20AD泵,日本岛津公司);PHS-3C型酸度计(上海虹益仪器仪表有限公司);药品强光照射实验箱(重庆市永兴实验仪器厂);HitachiU-1800型紫外分光光度计(日本Hitachi公司)。
1.2 试药
盐酸卡替洛尔工作对照品(重庆北碚现代应用药物研究所,含量99.86%,批号:100801);盐酸卡替洛尔骨架缓释微丸(自制,批号为110701、110702和110703);乙腈为色谱纯(天津四友精细化学品有限公司);其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:VP-ODSC18柱(4.6mm×150mm,4.6μm);流动相:0.067%的Na2HPO4溶液(H3PO4调节pH至3.0)-乙腈(87∶13);流速:1mL/min;检测波长:251nm;柱温30℃。进样量:20μL;进样前过0.22μm的微孔滤膜。理论板数按盐酸卡替洛尔峰计算不低于3000,分离度>1.5,盐酸卡替洛尔色谱图,见图1。
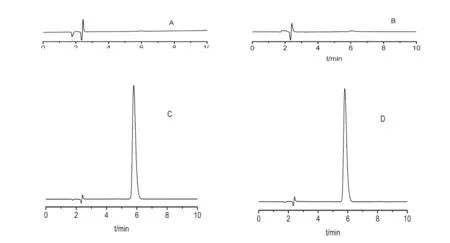
图1 盐酸卡替洛尔色谱图
2.2 溶液制备
2.2.1 对照品溶液
精密称取盐酸卡替洛尔工作对照品适量,加流动相溶解并定容制成0.1mg/mL溶液,精密量取5mL置50mL容量瓶中,用流动相定容,摇匀,即为对照品溶液(10μg/mL)。
2.2.2 供试品溶液
取盐酸卡替洛尔缓释微丸,研细,精密称定约相当于10mg盐酸卡替洛尔的粉末,置100mL容量瓶中,加流动相适量,机械振摇1h,再以流动相定容至刻度,摇匀,过滤,从续滤液中精密量取10mL置于100mL容量瓶中,用流动相定容至刻度,摇匀,即为供试品溶液。
2.2.3 空白辅料溶液
按处方比例称取辅料制成空白微丸,照“2.2.2”项下方法制备空白辅料溶液。
2.3 专属性试验
称取盐酸卡替洛尔缓释微丸粉末适量,配制浓度为500μg/mL样品溶液,量取样品溶液5mL,分别经2mL的30%过氧化氢溶液(室温放置3h),4500Lx±500Lx光照12h,2mL的1mol/L氢氧化钠溶液100℃水浴加热3h,2mL的1mol/L盐酸溶液100℃水浴加热3h,100℃水浴加热3h处理,作为氧化破坏、光破坏、碱破坏、酸破坏和高温破坏溶液。照“2.1”项下色谱条件测定其含量,记录色谱图。结果,盐酸卡替洛尔在高温、强光照射、酸性条件下较稳定;在氧化、碱性条件下有降解产物出现,其色谱图,见图2。
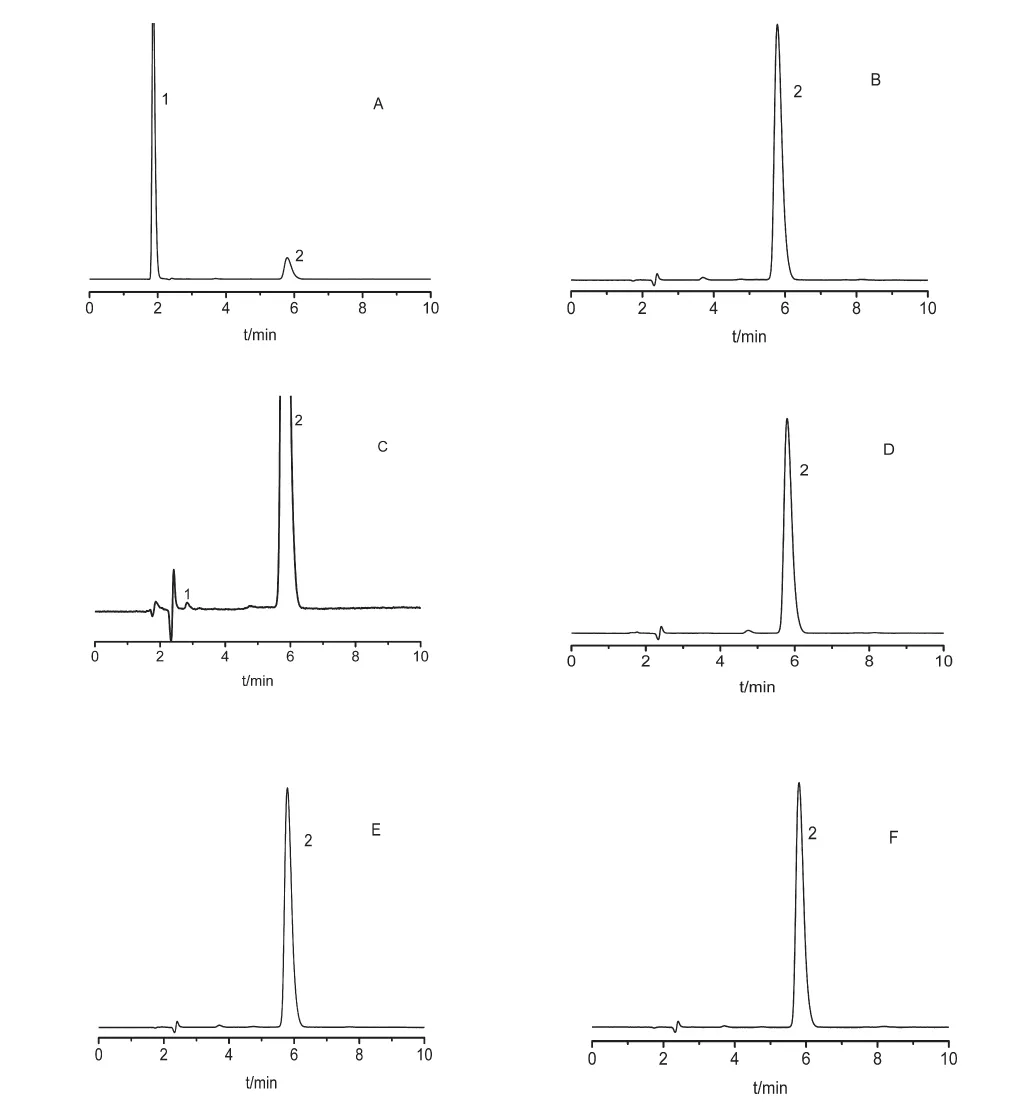
图2 盐酸卡替洛尔骨架缓释微丸破坏性试验色谱图
2.4 线性关系考察
按“2.2.1”项下方法配制2、4、10、20、40μg/mL 5个不同浓度的对照品溶液,以浓度(μg/mL)为X轴,以峰面积为Y轴,绘制标准曲线。结果,盐酸卡替洛尔浓度在2~40μg/mL范围内与峰面积线性关系良好。线性回归方程为:Y=33419X+4040.5,r=0.9998。
2.5 日内精密度
精密吸取对照品溶液20μL,注入液相色谱仪,连续进样6次,按盐酸卡替洛尔峰面积计算RSD为0.09%。
2.6 重复性
按“2.2.2”方法配制6份10μg/mL样品溶液,滤过,进样,记录色谱图,盐酸卡替洛尔峰面积的RSD为0.68%。
2.7 回收率试验
称取处方量盐酸卡替洛尔骨架缓释微丸空白辅料3份,分别加入盐酸卡替洛尔对照品40mg、50mg、60mg,混合均匀后,研细,分别称取细粉适量至100mL量瓶中,加流动相适量,机械振摇1h,再定容至刻度,使其浓度分别为0.4mg/mL、0.5mg/mL和0.6mg/mL,过滤,取续滤液作为待测溶液,在上述色谱条件下,进样测定,测得盐酸卡替洛尔3种浓度的回收率(n=3)分别为101.2%(RSD=0.35%)、101.1%(RSD=0.41%)、101.4%(RSD=0.32%),平均回收率(n=9)为101.2%(RSD=0.36%)。
2.8 样品溶液稳定性
取同一批供试品溶液,分别于0、4、8、12、18、24h进样20μL测定峰面积,RSD为0.16%,结果表明样品溶液在室温条件下,24h内基本稳定。
2.9 最低检测限和最低定量限
取“2.2.1”项下对照品溶液,加流动相不断稀释,记录峰面积,在信噪比S/N为3∶1测得最低检出限为0.4ng,在信噪比S/N为10∶1测得最小定量限为1.6ng。
2.10 样品含量测定
取3批样品,每批三份,照“2.2”项下方法制备供试品溶液及对照品溶液,分别进样20μL,记录色谱图。按外标法以峰面积计算盐酸卡替洛尔的含量。结果,见表1。
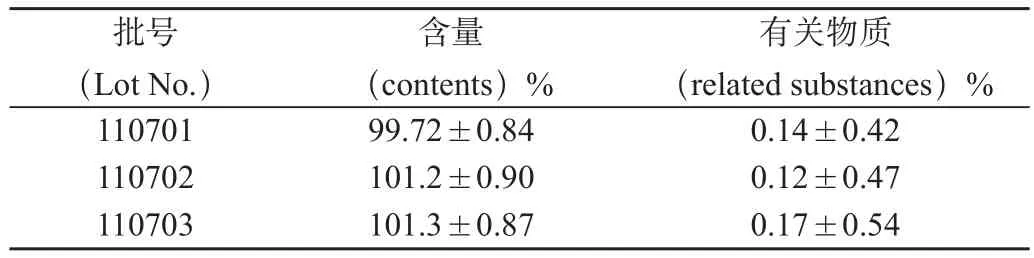
表1 盐酸卡替洛尔骨架缓释微丸含量及有关物质测定结果(%,n=3)
2.11 有关物质检查
精密称取盐酸卡替洛尔骨架缓释微丸细粉适量(约相当于盐酸卡替洛尔50mg),照“2.2.2”项下方法制成0.5mg/mL的溶液作为供试品溶液,将供试品溶液用流动相稀释100倍,作为1%的自身对照液。分别吸取上述两种溶液各20μL注入液相色谱仪,计算除盐酸卡替洛尔以外的各杂质峰面积总和,并与对照液主成分峰面积比较,以不加校正因子的自身对照法计算总杂质含量,3批样品的有关物质含量均低于0.2%,符合药典相关要求,结果见表1,色谱图,见图3。
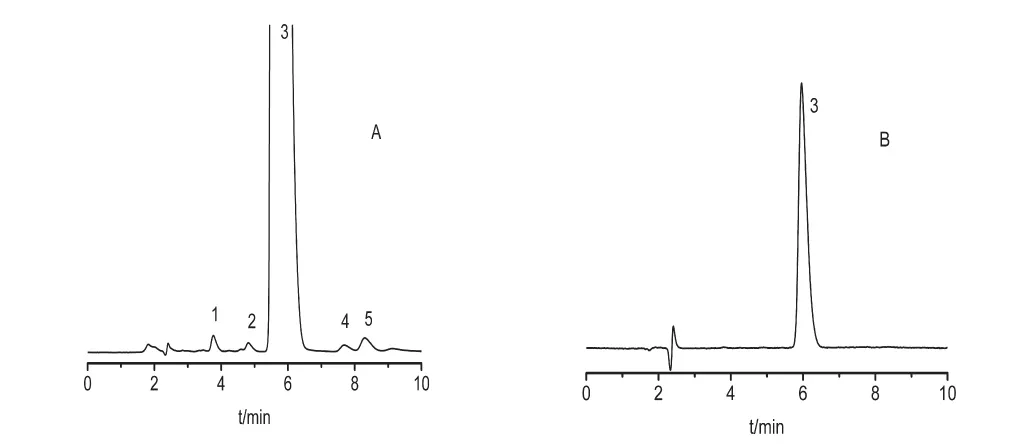
图3 盐酸卡替洛尔骨架缓释微丸有关物质色谱图
3 讨 论
3.1 检测波长的选择
照2.2.1项下配置盐酸卡替洛尔10μg/mL的溶液,以溶剂为空白,在400~200nm波长范围内测定紫外吸收光谱。根据测定结果可知盐酸卡替洛尔在215nm和251nm 波长处均有最大吸收,分别以215nm和251nm作为检测波长,发现在251nm波长处杂质峰与主峰分离良好,且能避免溶剂的末端吸收,故选用251nm作为检测波长。
3.2 稳定性
盐酸卡替洛尔在强氧化条件下不稳定,在碱性条件下会产生少量杂质;在酸性、高温和强光照射条件下比较稳定。因此,盐酸卡替洛尔原料药及其制剂在使用和储存过程中,应避免强氧化和强碱性环境。
3.3 有关物质
2010年版中国药典采用薄层色谱法,对盐酸卡替洛尔原料药进行有关物质检查,规定有关物质不得超过0.2%;英国药典[8]采用高效液相色谱法对盐酸卡替洛尔原料药和滴眼剂进行了有关物质检查。本文对3批盐酸卡替洛尔骨架缓释微丸进行了总有关物质考察,结果显示,3批样品有关物质总量均小于0.2%,符合2010年版中国药典对盐酸卡替洛尔原料药有关物质的控制要求。
[1]Kikuchi T,Uwahodo Y,Tottori K,et al.The attenuating effect of carteolol hydrochloride,a β-adrenoceptor antagonist,on neurolepticinduced catalepsy in rats[J].Psychopharm,1997,131(2):108-114.
[2]黄贤胜,宫春明,赵红莲,等.心血管神经症诊治进展[J].中西医结合心脑血管病杂志,2001,8(1):93-95.
[3]刘永欣.了解心脏神经症[J].中国临床医生杂志,2008,36(3):40.
[4]Ohtsuka pharmaceutical CO.Specif i cations of carteolol hydrochloride tablets[Z].2008,10.
[5]罗永煌,乔彦茹,聂延君,等.盐酸卡替洛尔微丸及其制备方法与制剂[P].中国:101690718,2010-04-07.
[6]国家药典委员会.中国人民共和国药典2010版第二部[S].北京:化学工业出版社,2010:661.
[7]The United States Pharmacopeial Conventio.USA Pharmacopoeia(USP32–NF27).Carteolol Hydrochloride Tablets[S].USP32-NF27:1810.
[8]British Pharmacopoeia2009 (英国药典2009).Carteolol Hydrochlo ride[S].2009:1080.
