曲美他嗪对急性心肌梗死大鼠胶原的影响
2011-08-02李佳彧倪维华李佳睿马丕勇吉林大学中日联谊医院吉林长春30033
李佳彧 倪维华 李佳睿 马丕勇 (吉林大学中日联谊医院,吉林 长春 30033)
急性心肌梗死(AMI)后心肌纤维化的程度是心室重构的重要部分。梗死后心肌纤维化包括心肌梗死区瘢痕组织中胶原网络重构,同时伴有左室非梗死区心肌——远离梗死区的心肌组织胶原增生〔1〕。因而,作为细胞间基质的主要成分——胶原,在心梗后心肌纤维化的发展过程中占有重要地位。调节胶原的合成与成熟成为临床治疗心室重构的重要治疗靶点〔2〕。大量的循证医学证实倍他乐克(琥珀酸美托洛尔)能够有效抑制心梗后心室重构。有报道,曲美他嗪用于治疗AMI,能够改善心功能〔3〕,但其机制尚不十分清楚。本文通过建立实验性AMI大鼠模型,测定梗死区、非梗死区胶原Ⅰ分子表达,进而探讨曲美他嗪与倍他乐克对胶原合成的抑制及其对心肌纤维化进程延缓的机制。
1 材料与方法
1.1 试剂 倍他乐克由阿斯特拉(无锡)制药有限公司生产。曲美他嗪由施维雅(天津)制药有限公司生产。逆转录多聚酶链反应(RT-PCR)试剂盒购自宝生物工程(大连)有限公司。引物由上海生工生物工程有限公司合成。
1.2 动物模型及分组 随机取健康80只(雌鼠30只,雄鼠50只)体重200~240 g Wistar大鼠,由吉林大学基础医学院动物室提供。采用左前降支冠状动脉结扎术制备AMI模型,参考文献〔4〕方法,应用4%水合氯醛麻醉,快速打开胸廓,暴露心脏,在左心耳下约2 mm处冠状动脉左前降支用6/0线结扎,迅速关闭胸腔并缝合,复苏动物。同时另取8只大鼠(雌鼠4只,雄鼠4只),同样的方法手术,但术中只挂线,不结扎,作为假手术组。术后每天予青霉素24万U/kg,共3 d,预防感染。饲养8 w。术后AMI模型大鼠存活59只(雌鼠28只,雄鼠31只)存活率73.75%(雌鼠70%,雄鼠77.5%)。随机选取存活鼠48只(雌鼠24只,雄鼠24只),将其分为:模型组、倍他乐克组和曲美他嗪组各16只,每组大鼠雌雄各半。每日给药量分别为倍他乐克组2 mg/kg体重,曲美他嗪组10 mg/kg体重。上述药物溶于1 ml自来水中灌胃,模型组每日仅1 ml自来水灌胃。大鼠均自由饮食,分笼饲养,给药过程中无一死亡。
1.3 标本采集及胶原-ⅠmRNA的检测 8 w后处死大鼠,分别留取心脏的梗死区及非梗死区心肌组织,检测各组织中胶原-Ⅰ蛋白mRNA的表达水平。用Trizol试剂处理梗死区心肌组织提取总RNA。使用逆转录酶将3 μg总RNA合成双链DNA(互补DNA,cDNA)。胶原-Ⅰ,β-actin通过 GenBank获得(http://www.ncbi.nlm.nih.gov),并设计引物。胶原-Ⅰ上游引物5'-AGG GTC ATC GTG GCT TCT C-3',下游引物5'-ACC TTC GCT TCC ATA CTC G-3'。β-actin上游引物5'-GCT CGT CGT CGA CAA CGG CTC-3',下游引物5'-CAA ACA TGA TCT GGG TCATCT TCT C-3'。取3 μl逆转录产物分别应用上述蛋白上下游引物进行PCR扩增。PCR反应体系包括:10×反应缓冲液2.5 μl,1 μl dNTPs,上下游引物各 1 μl,1 μl TaqDNA 多聚酶,加DEPC处理H2O至总体积为25 μl,混匀后进行PCR反应。反应参数为:94℃预变性5 min,95℃变性40 s,54℃退火30 s,72℃延伸45 s,循环30次,最后72℃延伸10 min。取10 μl PCR反应产物进行1.5% 琼脂糖电泳,光密度扫描后图片经Image J软件分析,结果以检测蛋白/β-actin的积分光密度比值表示。
2 结果
2.1 梗死区心肌组织的胶原-ⅠmRNA的表达 与假手术组比较,模型组大鼠的梗死区心肌组织中胶原-Ⅰ mRNA表达上调(P﹤0.001)。与模型组比较,倍他乐克组表达下调(P﹤0.001),曲美他嗪组表达亦下调(P﹤0.001)。其中,倍他乐克组与曲美他嗪组表达水平接近,差异不显著(P>0.05)。
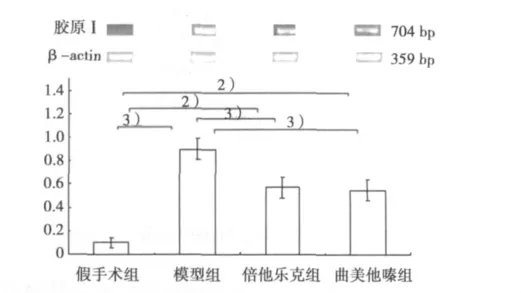
图1 各组梗死区心肌组织胶原ⅠmRNA的表达
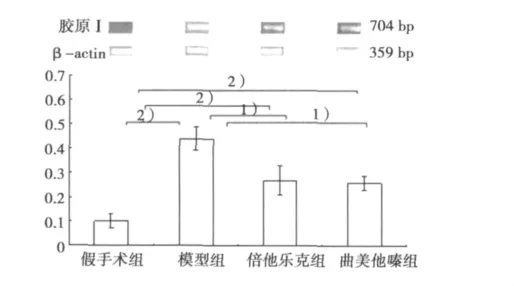
图2 各组非梗死区心肌组织胶原ⅠmRNA的表达
2.2 非梗死区心肌组织胶原-Ⅰ mRNA表达 与假手术组比较,模型组大鼠非梗死区心肌组织中胶原-Ⅰ mRNA表达上调(P<0.01)。与模型组比较,倍他乐克组表达下调(P<0.05),曲美他嗪组表达亦下调(P<0.05)。其中,倍他乐克组与曲美他嗪组表达水平接近,两组间差异不显著(P>0.05)。
3 讨论
心肌纤维化是AMI后心室重构的特征性改变,也是发展为心力衰竭的重要结构基础〔5〕。抑制心梗后心肌组织纤维化过程是预防和治疗心肌梗死的目标和重要靶点。心肌纤维化在分子水平上表现为间质内纤维细胞增殖和胶原生成增加。
大量研究已经证明倍他乐克能够降低心梗和心衰患者的发病率和死亡率。曲美他嗪临床治疗AMI及改善预后的机制尚在探讨中。故本实验结果提示曲美他嗪对胶原-Ⅰ分子的合成具有显著抑制作用,且与倍他乐克相似。且无论是梗死区还是非梗死区的心肌组织中胶原分子生成均显著下降。
曲美他嗪通过选择性抑制线粒体长链3-酮酰基辅酶A硫解酶,从而部分抑制长链脂肪酸β氧化;促进葡萄糖氧化〔6〕。曲美他嗪有效抑制心梗后胶原合成考虑与如下机制相关:心肌梗死后心肌梗死区修复过程通常分为两个连续阶段:炎症阶段和瘢痕形成阶段。在炎症阶段,心肌缺血缺氧,有氧氧化受抑制,ATP产生不足,无氧酵解增强,乳酸堆积,细胞内酸中毒,使心肌收缩力下降,同时缺血,导致线粒体肿胀,氧化磷酸化障碍〔7~9〕。曲美他嗪利用有限的氧产生更多的ATP,提高氧利用率,增加心肌收缩功能,从而减少缺血期间细胞内酸中毒及钙超载,保护心肌细胞〔10~12〕,且曲美他嗪能抑制白细胞向缺血部位聚积减少组织损伤〔13〕,减少坏死心肌细胞数量,能够减少梗死面积;在瘢痕阶段,曲美他嗪调节心肌细胞能量代谢,有效利用仅有的少量血供,增加残存心肌活性,并使残存心肌得到最有效的能量获取途径。也就是对于梗死区无论在心梗后心肌修复的炎症阶段,还是在心肌修复的瘢痕阶段,曲美他嗪通过对心肌细胞能量代谢途径的调节,下调组织中胶原分子的生成。对于非梗死区,由于改善心肌细胞的代谢途径,同时清除氧自由基,减少心肌细胞损伤,进而减少成纤维细胞激活和胶原合成相关蛋白激活,从而减少了心肌组织中胶原合成。在分子水平上,心梗后梗死区和非梗死区胶原合成减少,成为延缓心肌纤维化、心室重构的重要基础。同时该研究也证实倍他乐克在抑制心肌纤维化的进程方面有相似疗效,与其他研究结果一致。胶原重构的调节对于抑制心梗后的心肌纤维化中具有重要意义,成为抑制心梗后左室重构的治疗靶点〔14〕。
1 McCormick RJ,Musch TI,Bergman BC,et al.Regional differences in LV collagen accumulation and mature cross-linking after myocardial infarction in rats〔J〕.Am J Physiol,1994;266:H354-9.
2 Bornstein P.Matricellular proteins:an overview〔J〕.Matrix Biol,2000;19:555-6.
3 El-Kady T,El-Sabban K,Gabaly M,et al.Effects of trimetazidine on myo-cardial perfusion and the contractile response of chronically dysfunctional myocardium in ischemic cardiomyopathy:a 24-month study〔J〕.Am J Cardiovasc Drugs,2005;5:271-8.
4 Zhang RY,Yu P,Wang F,et al.Effects of Trimetazidine upon ventricular remodeling and GLUT4 in diabetic rats after myocardial infarction〔J〕.Zhonghua Yi Xue Za Zhi,2009;89(18):1240-5.
5 Pelouch V,Dixon IMC,Golfman L,et al.Role of extracellular matrix proteins in heart function〔J〕.Mol Cell Biochem,1993;129:101-2.
6 Lopaschuk GD,Kozak R.Trimetazidine inhibit s fatty acid oxidation in the hear〔tJ〕.J Mol Cell Cardiol,1998;30:A112.
7 Lopaschuk GD.Treating ischemic heart disease by pharmacologically improving cardiac energy metabolism〔J〕.Presses Med,1998;27:2100-4.
8 Mody FV,Singh BN,Mohiuddin IH,et al.Trimetazidine in duced enhancement of myocardial glucose utilization in normal and ischemic myocardial tissue:an evaluation by position emission tomography〔J〕.Am J Cardiol,1998,82:42k-9.
9 Vasiuk YA,Shkol'nik EL,Kudriakov ON,et al.Effect of therapy with trimetazidine modified release on quality of life of patients with stable effort angina survivors after acute myocardial infarction.Results of PRIMA study〔J〕.Kardiologiia,2010;50(4):45-9.
10 Kantor PF,Lucien A,Kozak R,et al.The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme thiolase〔J〕.Circ Res,2000;86(5):580.
11 Mouquet F,Rousseau D,Domergue-Dupont V,et al.Effects of trimetazidine,a partial inhibitor of fatty acid oxidation,on ventricular function and survival after myocardial infarction and reperfusion in the rat〔J〕.Fundam Clin Pharmacol,2010;24(4):469-76.
12 Iyengar SS,Rosano GM.Effect of antianginal drugs in stable angina on predicted mortality risk after surviving a myocardial infarction:a preliminary study(METRO)〔J〕.Am J Cardiovasc Drugs,2009;9(5):293-7.
13 Williams FM,Tanda K,Kus M,et al.Trimetazidine inhibits neutrophil accumulation after myocardial ischemia and reperfusion in rabbits〔J〕.J Cardiovasc Pharmacol,1993;22(6):828-33.
14 Wang D,Oparil S,Feng JA,et al.Effects of pressure overload on extracellular matrix expression in the heart of the atrial natriuretic peptidenull mouse〔J〕.Hypertension,2003;42:88-95.
