分枝杆菌Mycobacterium Neoaurum NwIB-01 3-甾酮-Δ1-脱氢酶基因的克隆表达
2011-07-26张成刚王风清魏东芝
张成刚,王风清,魏东芝
(华东理工大学生物工程学院 鲁华生物技术研究所,上海 200237)
甾体激素类药物是临床上不可缺少的一类药物,对机体起着非常重要的调节作用[1]。如肾上腺皮质激素具有抗炎、抗过敏、抗休克、抗变态反应等功效,广泛用于治疗类风湿性关节炎、支气管哮喘和湿疹等皮肤病,可治疗和缓解胶原性疾病、过敏性休克等难治或危险性疾病;各类性激素是医治雄性器官衰退和某些妇科疾病的主要药物,也是口服避孕药的主要成分[2]。由于甾类药物疗效独特,临床应用广泛,已成为仅次于抗生素的第二大类药物,年增长率在15%以上,且药物的品种也不断增多。
甾体化合物广泛存在于动、植物体内,但从自然界获取的这些天然结构的化合物往往活性很低。目前,常用的甾体激素生产方法是利用化学合成和微生物转化相结合的工艺路线,即其中的几步关键反应采用微生物转化法进行,如11α-羟基化、11β-羟基化、A环的1,2位脱氢等。微生物转化技术已成为许多甾体药物或其中间体合成路线中不可缺少的关键技术[3]。
甾体母核的1,2位、4,5位、7,8位、9,11位、14,15位及16,17位等都可以采用微生物转化进行脱氢,在这些反应中,尤以C1,2位脱氢反应最为重要。微生物的C1,2位脱氢反应是工业生产氢化泼尼松及其同系物最有价值的一种反应,也是采用发酵法工业生产甾类药物的典型代表。当抗炎甾体激素药物的母核在C1,2位导入双键后,能成倍地增加其抗炎作用。许多微生物具有3-酮基甾体-1(2)位的脱氢能力,比较常见的有节杆菌属(Arthrobactersp.)[3~8]、棒状杆菌属(Corymebacteriumsp.)[9]、 假单胞菌属(Pseudomonassp.)[10]、分枝杆菌属(Mycobacteriumsp.)[11]、芽孢杆菌属(Bacillussp.)[12]以及诺卡氏菌属(Nocardiasp.)[13]等。作者选用筛选的分枝杆菌属(Mycobacteriumsp.),根据已知的分枝杆菌的3-甾酮-Δ1-脱氢酶(kstD)碱基保守序列设计简并引物,克隆获得部分脱氢酶序列并通过染色体走读获得kstD全基因序列,并在大肠杆菌中进行表达,以此为基础构建3-甾酮-Δ1-脱氢酶基因工程大肠杆菌。
1 实验
1.1 菌株与质粒
分枝杆菌(Mycobacteriumneoaurum) NwIB-01为脱氢酶基因的受体菌,自行从土壤中筛选得到;E.coliDH5α为克隆和表达的宿主菌。克隆/表达载体 pMD19-T、pUC18。
1.2 培养基及培养条件
LB液体培养基(%):胰蛋白胨1,酵母提取物0.5,NaCl 1,pH值7.0。
MYC摇瓶培养基(g·L-1):磷酸氢二钾0.5,柠檬酸铁铵0.05,柠檬酸2,甘油20,硫酸镁0.5,硝酸铵2,碳酸钙10,pH值5.8~6.5,搅拌5 min,灭菌后pH值7.5~7.8。
含质粒的单克隆菌株接入含50 μg·mL-1Kanamycin或50 μg·mL-1Apramycin的2 mL LB培养基中,220 r·min-1、37 ℃下摇床培养过夜,4000 g离心收集菌体;较大规模的质粒提取,培养基体积增加到50 mL,其余不变。
1.3 PCR扩增及重组质粒构建
通过比较已经被验证功能的分枝杆菌1位脱氢酶基因,选择Mycobacteriumsmegmatis和Mycobacteriumtuberculosis的1位脱氢酶基因序列,经过对比,发现保守碱基序列,根据这一序列设计并合成简并引物FZs和FZa:
FZs:GTGTTCTACATGACTGMYCAGGAG
FZa:TGCGGATYCCGCCCTTG
以FZs和FZa为引物对,以MycobacteriumneoaurumNwIB-01基因组DNA为模板进行PCR扩增(94 ℃ 1 min,50 ℃ 30 s,72 ℃ 2 min,30个循环)。提取氨苄青霉素(Amp)抗性平板上长出的转化子质粒,分别用双酶切验证重组子质粒中带有片段大小。然后以经过鉴定的重组子的质粒为模板,进行PCR扩增,经胶回收纯化后与pMD19-T载体连接,转化大肠杆菌E.coliDH5α,筛选重组子经EcoRI、HindⅢ双酶切鉴定。M13正反向引物测序得到插入片段的DNA序列。
1.4 分枝杆菌基因组提取方法改进[14]
染色体走读需要大量分枝杆菌基因组,而分枝杆菌的细胞壁坚韧,含有分枝酸,裂解困难,一般的裂解剂不易将结核分枝杆菌菌壁裂解。分枝杆菌DNA的制备方法有:酚氯仿抽提法、Triton法、SDS法、胰酶法、CTAB(N-Cetyl-N,N-trimethyl ammonium bromide,十六烷基三甲基溴化铵)抽提法和酚抽提法,但这些方法在提取MycobacteriumneoaurumNwIB-01 DNA时效果并不好。因此,将以上方法加以改进:从培养了36 h的摇瓶中取3 mL分枝杆菌菌体置于管中,10 000 r·min-1离心1 min,去上清,将沉淀用3 mL 4%的NaOH溶液悬浮,置于37 ℃水浴振荡30 min。10 000 r·min-1离心1 min,去上清。用去离子水洗涤2次,离心,去上清。
每管中加600 μL TE 缓冲溶液,沸水浴中加热10 min,并立即将离心管放入-20 ℃冰箱,放置30 min;再于常温下加入40 μL(20 mg·mL-1)溶菌酶,置于37 ℃水浴中振荡120 min,加入蛋白酶K和SDS至终浓度分别为250 μg·mL-1和1%;提高水浴温度至65 ℃,振荡30 min;加入CETAB和NaCl 至终浓度为1%,置于水浴中20 min。随后用酚∶氯仿∶异戊醇(25∶24∶1)沉淀蛋白质,再用2 BV乙醇沉淀,离心得MycobacteriumneoaurumNwIB-01基因组。
1.5 分枝杆菌3-甾酮-Δ1-脱氢酶基因全序列的获得
为获得3-甾酮-Δ1-脱氢酶序列片段上、下游序列,根据已经得到的序列分别设计基因特异性引物Fzks1、Fzks2、Fzks3和Fzks4:
Fzks1:GTGTCTTTGACGTAGTGGTGGTAGGGAGC
Fzks2:CGGAGATGTTGTCGTTCGTGCTGAA
Fzks3:TCGTTGAGAAGGCTCCGCACTATGGC
Fzks4:CCATCGAACGGTTCAACGGTTTCGC
将MycobacteriumneoaurumNwIB-01基因组总DNA分别用粘性末端限制性内切酶Sau3AI、EcoRI、HindⅢ和PstI消化后纯化回收,在T4 DNA 连接酶作用下与相应步行接头Sau3AI Cassette、EcoRI Cassette、HindⅢ Cassette和PstI Cassette 连接得到步行文库。应用与分析kstD保守序列上、下游序列类似的方法得到DNA片段下游的序列。
1.6 Mycobacterium neoaurum NwIB-01 3-甾酮-Δ1-脱氢酶全长基因的克隆与表达载体构建
根据MycobacteriumneoaurumNwIB-01 3-甾酮-Δ1-脱氢酶基因的序列设计其全长引物Fzps和Fzpa:
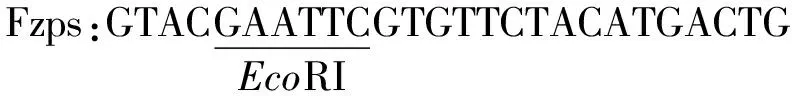

以MycobacteriumneoaurumNwIB-01的基因组DNA为模板PCR扩增得到其全长基因。PCR扩增条件为:94 ℃ 30 s;55 ℃ 30 s;72 ℃ 120 s,30个循环。
采用MycobacteriumneoaurumNwIB-01 3-甾酮-Δ1-脱氢酶的全长引物Fzps、Fzpa,以MycobacteriumneoaurumNwIB-01基因组DNA为模板进行PCR扩增得到3-甾酮-Δ1-脱氢酶全长基因片段,此片段纯化并用EcoRI 和HindⅢ限制性内切酶双酶切,胶回收双酶切基因片段,与经限制性内切酶EcoRI 和HindⅢ双酶切的pUC18载体在T4 DNA连接酶的作用下连接,得到质粒pTQ002。对构建好的pTQ002进行EcoRI 和HindⅢ双酶切,PCR验证。
1.7 3-甾酮-Δ1-脱氢酶基因在 E.coli DH5α中的表达与酶活测定[15]
挑出经双酶切和PCR验证过的E.coliDH5α转化子,在一级种子50 mL LB液体培养基/Ampicillin中37 ℃培养过夜;再以1%的接种量接入50 mL LB液体培养基/Ampicillin中,37 ℃培养至菌体OD600为0.4时开始诱导,分别在诱导前IPTG终浓度为1 mmol·L-1和诱导14 h时取样,进行SDS-PAGE电泳。
酶活检测采用分光光度法。kstD的酶活检测是通过测定600 nm处的光密度值,该值反映了2,6-二氯酚靛酚(DCPIP)减少的情况。1 mL反应混合物由50 mmol·L-1的Tris-HCl(pH 值7.0)、40 μmol·L-1DCPIP、1.5 mmol·L-1吩嗪硫酸甲酯(PMS)、500 μmol·L-14-AD(溶于2%的甲醇)和适量的酶液组成,在30 ℃的水浴中保温3 min。
酶活用mU表示,一个酶活单位(U)定义为1 min内产生1 nmol DCPIP所需要的酶量。
2 结果与讨论
2.1 分枝杆菌3-甾酮-Δ1-脱氢酶基因的PCR扩增、克隆以及序列分析
以简并引物FZs和FZa为引物对,以MycobacteriumneoaurumNwIB-01基因组DNA为模板进行PCR扩增,得到大小为1500 bp的片段,见图1。
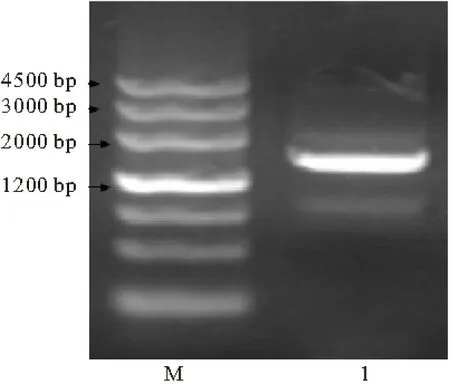
1.PCR Product with the primers FZs、FZa M.DNA Marker
该片段经胶回收纯化后与pMD19-T载体连接,转化大肠杆菌E.coliDH5α,并鉴定。M13正反向引物测序得到插入片段的DNA序列,NCBI Blastn(http://www.ncbi.nlm.nih.gov/BLAST/)比对,该片段与MycobacteriumgilvumPYR-GCK延胡索酸脱氢酶/琥珀酸盐脱氢酶基因(Genbank CP000656)有84%同源性,与Mycobacteriumsmegmatisstr.MC2155的3-甾酮-Δ1-脱氢酶基因(Genbank CP000480)有83%同源性,与MycobacteriumvanbaaleniiPYR-1延胡索酸脱氢酶/琥珀酸盐脱氢酶有82%的同源性,与Mycobacteriumavium104的3-甾酮-Δ1-脱氢酶基因(Genbank CP000479)有79%同源性。由此判断该DNA片段是3-甾酮-Δ1-脱氢酶基因的部分序列,同时也暗示该kstD有可能在TCA循环中发生作用。
2.2 分枝杆菌3-甾酮-Δ1-脱氢酶基因全序列的获得
按照1.4方法提取分枝杆菌基因组,如图2所示。

1.The genomic DNA of Mycobacterium neoaurum NwIB-01 M.DNA Marker
通过染色体走读,得到MycobacteriumneoaurumNwIB-01 3-甾酮-Δ1-脱氢酶基因的全序列以及该片段后面的一段序列,比对后发现该片段与Mycobacteriumsmegmatisstr.MC2155 3-甾酮-Δ1-脱氢酶基因(Genbank CP000480)序列的部分同源性达到 82%,与Mycobacteriumavium104 3-甾酮-Δ1-脱氢酶基因(Genbank CP000479)同源性达到76%。
不同来源的kstD氨基酸序列比较见图3。由图3可知,3株菌的kstD在氨基酸序列开始的部分同源性相当高,而后续部分同源性较低。

M.s.=Mycobacterium smegmatis str.MC2155 M.sp.=Mycobacterium neoaurum NwIB-01 M.a.=Mycobacterium avium 104
MycobacteriumneoaurumNwIB-01 kstD氨基酸序列FAD的结合位点见图4,方框位置为推测的FAD结合位点。

图4 Mycobacterium neoaurum NwIB-01 kstD氨基酸序列FAD的结合位点
2.3 大肠杆菌表达载体的构建及在E.coli DH5α中的表达
双酶切基因片段与经限制性内切酶EcoRI 和HindⅢ双酶切的pUC18载体在T4 DNA连接酶的作用下连接,得到质粒pTQ002,见图5。

图5 pTQ002构建过程图
对pTQ002质粒进行SDS-PAGE电泳,由于pUC18只有弱启动子,产生的3-甾酮-Δ1-脱氢酶含量较低,无法从电泳图谱看出。
2.4 E.coli DH5α中3-甾酮-Δ1-脱氢酶的酶活测定
按照1.7方法测得E.coliDH5α3-甾酮-Δ1-脱氢酶酶活为(0.37±0.05)U·mL-1,约为MycobacteriumneoaurumNwIB-01酶活的一半。
2.5 讨论
由于分枝杆菌的3-甾酮-Δ1-脱氢酶(kstD)是一种膜蛋白酶,利用大肠杆菌高效表达系统表达单独的膜蛋白,往往会使其在膜内大量聚集而形成包涵体,载体pUC18的启动子为弱启动子,用pUC18作为载体表达的蛋白量比较少,不易形成包涵体,酶活较低,约为原酶活的一半。在后续的研究当中,可以考虑将分枝杆菌的3-甾酮-Δ1-脱氢酶的基因在铅青链霉菌中表达,既可以提高酶量,也可以分泌到胞外表达,有望大幅提高酶活。
3 结论
通过分析已知两种分枝杆菌的3-甾酮-Δ1-脱氢酶(kstD)碱基保守序列,设计简并引物,以甾醇降解菌株MycobacteriumneoaurumNwIB-01的DNA作模板,得到一个kstD基因片段,通过染色体走读得到其完整的阅读框。以pUC18为异源表达载体,构建pTQ002表达质粒,在E.coliDH5α中对kstD进行了胞内活性表达,测定MycobacteriumneoaurumNwIB-01 kstD 酶活为(0.37±0.05)U·mL-1,约为原酶活的一半,为构建高效转化生成3-酮基-1,4-二烯类固醇的基因工程菌奠定了基础。
[1] 张辉,姜文勇,牟宏晶.大豆甾醇的微生物降解及酶抑制剂的选择[J].哈尔滨理工大学学报,2000,5(4):75-78.
[2] 徐诗伟,徐清,法幼华.犁头霉11α-羟基化制备16β-甲基-11α,17α,21-三羟基孕甾-1,4-二烯-3,20-二酮[J].生物工程学报,2000,16(4):482-484.
[3] 徐诗伟,徐清,法幼华.甾体1,4-脱氢和11α-羟化反应的两种不同微生物转化[J].生物工程学报,2000,16(5):651-652.
[4] Alekhina T M,Ryzhkova V M,Gusarova T I,et al.Microbiological transformation of steroid-13-cyclodextrininclusion compounds[J].Khim Farm Zh,1993,27(4):59-62.
[5] Belikov V Q,Kompantseva E V,Gavrilin M V.Potential use of cyclodextrin to improve the procedure for obtaining predinsolone[J].Khim Farm Zh,1991,25(2):48-49.
[6] Hesselink P G M,Van Vliet S,de Vries H, et al.Optimization of steroid side chain cleavage byMycobacteriumsp.in the presence of cyclodextrins[J].Enzyme Microb Technol,1989,11(7):398-404.
[7] Fokina V V,Karpov A V,Sidorov I A,et al.The influence ofβ-cyclodextrin on the kinetics of 1-en-dehydrogenation of 6α-methylhydrocortisone by theArthrobacterglobiformiscells[J].Appl Microb Biotechnol,1997,47(6):645-649.
[8] Jeries Jadoun,Raphael Bar.Microbial transformations in a cyclodextrin medium.Part 3.Cholesterol oxidation byRhodococcuserythropolis[J].Appl Microb Biotechnol,1993,40(2-3):230-240.
[9] Krook M,Hewitt B D.Preparation of 6-methyleneaneandrosta-1,4-diene-3,17-dione,uses a dehydrogenation reaction usingA.simplexcells[P].WO 0 104 342,2001.
[10] Abou E I,Hawa M,Mahfouz W,et al.Δ1-Dehydrogenation of cortisol with bacteria:Some biochemical aspects of Δ1-dehydrogenation of cortisol withCorynebacteriumegui[J].E J Microb,1993,28(3):281-287.
[11] Adham N Z,El-Hady A A,Naim N.Biochemical studies on the microbial dehydrogenation of cortisol byPseudomonasfluorescens[J].Process Biochem,2003,38(6):897-902.
[12] Lestrovaya N N.Localization of 3-oxosteroid-Δ1-dehydrogenase inMycobacteriumrubruandArthrobacterglobilormiscells[J].Mikrobiologiya,1981,50(4):619-725.
[13] Lestrovaya N N,Matveeva N I.Interaction of phospholipids with 3-oxo-Δ1-dehydrogenase in adsorption membrane models,interaction of theMycobacteriumrubrumenzyme with liposomes[J].Biokhimiya,1982,47(8):1272-1277.
[14] Amita Jain,Vandana Tiwari,Guleria R S,et al.Qualitative evaluation of mycobacterial DNA extraction protocols for polymerase chain reaction[J].Molecular Biology Today,2002,(3):43-50.
[15] van der Geize Robert,Hessels Gerda I,Dijkhuizen Lubbert.Molecular and functional characterization of thekstD2 gene ofRhodococcuserythropolisSQ1 encoding a second 3-ketosteroid Δ1-dehydrogenase isoenzyme[J].Microbiology,2002,148(10):3285-3292.
