带锚链的甲基对硫磷水解酶的基因构建及表达纯化
2011-07-26刘立坚李雨亭谢卫红
刘立坚,冷 艳,李雨亭,谢卫红
(1.湖北工业大学生物工程学院 发酵工程省部共建教育部重点实验室,湖北 武汉 430068;2.中国科学院武汉病毒研究所 病毒学国家重点实验室,湖北 武汉 430071)
有机磷农药是世界上使用范围最广、用量最大的农药品种。我国作为高毒农药生产大国,其中有机磷农药的产量大约占整个农药工业的57%[1],有关有机磷农药的急性中毒事件时有发生[2]。甲基对硫磷虽属慎用或禁用有机磷农药之列[3],但由于其廉价高效,至今仍被违规使用,其残毒造成了食品和环境的严重污染,检测及监控其使用情况是亟待解决的问题。
湖北工业大学生物工程学院发酵工程省部共建教育部重点实验室欲采用分子印迹技术[4]制备甲基对硫磷水解酶 (Methyl parathion hydrolase,MPH,E.C 3.1.8.1)的均质印迹膜。研制过程中制备的印迹模板可利用MPH催化甲基对硫磷生成黄色对硝基苯酚的反应[5]对农药残留进行检测。以此模板制备的分子印迹膜可作为生物检测器件的雏形,其检测信号的准确性与重复性关键在于膜的均质性,而膜的均质性则很大程度上取决于印迹模板的均质性。作者在此设计在甲基对硫磷水解酶的C端连上一段末端为半胱氨酸的锚链,使其能定向地固定于经硅烷化修饰的基底表面,以此制备均质性良好的印迹模板。因此,甲基对硫磷水解酶的重组表达及纯化是其中重要一环。作者在此进行了带锚链的甲基对硫磷水解酶的基因构建及表达纯化研究。
1 实验
1.1 菌株、质粒及主要试剂
E.coliBL21(DE3)、E.coliDH5α、pET5a-mph、pET28a(+)均由武汉病毒研究所惠赠;限制性内切酶EcoRⅠ、NdeⅠ和XhoⅠ、TaqDNA聚合酶、Pyrobest DNA聚合酶、T4 DNA连接酶,Takara公司;质粒小量提取试剂盒及琼脂糖凝胶回收试剂盒,Omega Bio-Tek公司;PCR引物及Linker由上海英骏生物技术有限公司合成;Ni Sepharose,GE Healthcare公司;甲基对硫磷(纯度为99%),自行合成;BCA蛋白质浓度测定试剂盒,Beyotime公司;其它试剂均为分析纯。
1.2 mph基因的PCR扩增
以质粒pET5a-mph为模板,根据测序结果设计引物,扩增两端分别带有NdeⅠ和EcoRⅠ酶切位点的mph基因编码序列,合成的上游引物为5′-ACTCTCATATGGCCGCACCGCA-3′,下游引物为5′-TCCGGAATTCCTTGGGGTTGAC-3′。在30 μL PCR反应体系中含1×Pyrobest DNA聚合酶缓冲溶液3 μL,2.5 mmol·L-1dNTP 1 μL,pET5a-mph0.5 μL,200 μg·mL-1上、下游引物各0.5 μL,100 μg·mL-1BSA溶液1 μL,Pyrobest DNA聚合酶(5 U·μL-1)0.3 μL ,ddH2O。PCR条件为:94 ℃ 5 min;94 ℃ 1 min,45 ℃ 40 s,72 ℃ 1 min,5个循环;94 ℃ 1 min,55 ℃ 45 s,72 ℃ 1 min,25个循环;72 ℃ 5 min。反应结束后进行0.7%琼脂糖凝胶电泳检测。
1.3 重组质粒pET28a-mph的构建
经电泳验证PCR产物片段大小后,用试剂盒纯化。纯化产物用NdeⅠ、EcoRⅠ双酶切,然后将mph酶切片段插入经同样双酶切的pET28a(+)载体中。连接体系为:10×T4 DNA连接酶缓冲溶液1 μL,载体pET28a(+) 1 μL,目的片段mph2 μL,T4 DNA连接酶0.1 μL,ddH2O补足至10 μL。16 ℃过夜连接后转化至大肠杆菌DH5α感受态细胞,并用含有50 μg·mL-1Kan的LB平板进行筛选,对阳性转化子进行NdeⅠ和EcoRⅠ双酶切鉴定。
1.4 重组质粒pET28a-mph-lc的构建
人工合成带编码半胱氨酸-(Gly-Ser)5-Cys的寡聚核苷酸序列(含有克隆所需的EcoRⅠ、XhoⅠ酶切位点),Linker-c1:5′-AATTCAGCGGCTCTGGTTCCGGTAGCGGTTCCGGTTGCTAAC-3′,Linker-c2:3′-GTCGCCGAGACCAAGGCCATCGCCAAGGCCAACGATTGAGCT-5′,将此两条单链在94 ℃ 5 min、65 ℃ 15 min条件下退火得到双链Linker-c。与经同样双酶切且胶回收纯化的pET28a-mph在T4 DNA连接酶作用下16 ℃过夜连接,10 μL连接体系如下:10×T4 DNA连接酶缓冲溶液1 μL,pET28a-mph1 μL,Linker-c 2 μL,T4 DNA连接酶0.1 μL,ddH2O。转化至大肠杆菌BL21(DE3)感受态细胞,用含有50 μg·mL-1Kan的LB平板进行筛选,对筛选到的阳性转化子进行PCR和NdeⅠ、XhoⅠ双酶切验证。
1.5 目的蛋白的诱导表达
从新鲜的LB平板上挑取重组菌菌落,接种于5 mL带有相应抗性的LB培养基中,37 ℃、200 r·min-1过夜培养,以1%的比例接种到抗性LB培养基中,37 ℃、200 r·min-1振荡培养至对数生长期(OD600≈0.5~0.6),加入终浓度为1 mmol·L-1的IPTG,30 ℃诱导表达5 h。将菌液倒入离心管中平衡,于高速冷冻离心机中4 ℃、8000 r·min-1下离心10 min,弃上清收集菌体。用含20 mmol·L-1咪唑的Tris-HCl缓冲溶液(pH值 8.0)洗涤沉淀2次,并最终将其溶于40 mL相同缓冲溶液中。将重悬液冰水浴置于超声波细胞破碎仪中进行破碎:功率200 W,每超声3 s间隔5 s,共200次。4 ℃、10 000 r·min-1下离心30 min,取上清,用0.45 μm滤膜过滤,待上柱纯化。
1.6 目的蛋白的纯化
由于甲基对硫磷水解酶末端连接有pET28a(+)载体表达的6个组氨酸(His),故可以采用Ni-NTA 亲和层析柱进行纯化。取Tris-HCl缓冲溶液(含20 mmol·L-1咪唑、0.5 mol·L-1NaCl,pH值8.0)平衡柱子,流速为1 mL·min-1。将甲基对硫磷水解酶粗酶液上柱,流速为0.6 mL·min-1,His与镍结合使带His标记的蛋白质吸附在镍柱上,不带His标记的蛋白质穿流下来。分别用含60 mmol·L-1、100 mmol·L-1、150 mmol·L-1咪唑的缓冲溶液进行梯度洗脱,流速为1 mL·min-1,同时在280 nm处进行连续紫外检测,根据监测波峰收集蛋白并留样进行SDS-PAGE(12%)电泳,然后于20 mmol·L-1Tris-HCl缓冲溶液(pH值8.0)中透析以获得纯化蛋白。
1.7 蛋白浓度测定
采用BCA法测定蛋白浓度[6],以BSA 作为标准蛋白。
1.8 甲基对硫磷水解酶活性分析
底物甲基对硫磷溶液在甲基对硫磷水解酶催化下生成于405 nm处有最大吸收峰的黄色产物对硝基苯酚,造成溶液吸光度的变化,据此可分析甲基对硫磷水解酶的酶学活性。配制100 mmol·L-1甲基对硫磷甲醇溶液,将其用20 mmol·L-1Tris-HCl缓冲溶液(pH值8.0)稀释至10 mmol·L-1;将融合型蛋白MPH-L及野生型蛋白MPH-W用Tris-HCl缓冲溶液稀释至10 μg·mL-1;取190 μL MPH-L、MPH-W及Tris-HCl缓冲溶液分别加到96孔板中,然后同时加入10 μL 10 mmol·L-1的甲基对硫磷溶液,即底物终浓度为0.5 mmol·L-1,反应总体积为200 μL,计时1 min,室温下于酶标仪中测定其在405 nm处吸光度。做多组平行。
2 结果与讨论
2.1 PCR扩增目的片段mph
以质粒pET5a-mph为模板,用所设计的引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳,结果见图1。
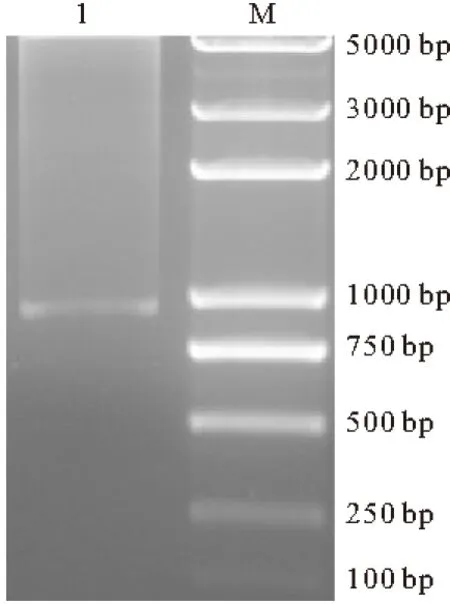
1. PCR product of mph M. DL 5000 DNA marker
由图1可以看出,泳道1上检测到一个约890 bp的DNA片段(PCR扩增产物),大小与预期结果相符,且无其它非特异性的杂带存在,初步确定该890 bp左右的DNA片段为mph基因。
2.2 重组表达载体的酶切鉴定
从菌液中提取重组质粒pET28a-mph-lc,利用限制性内切酶NdeⅠ、XhoⅠ进行双酶切,酶切产物经琼脂糖凝胶电泳,结果见图2。
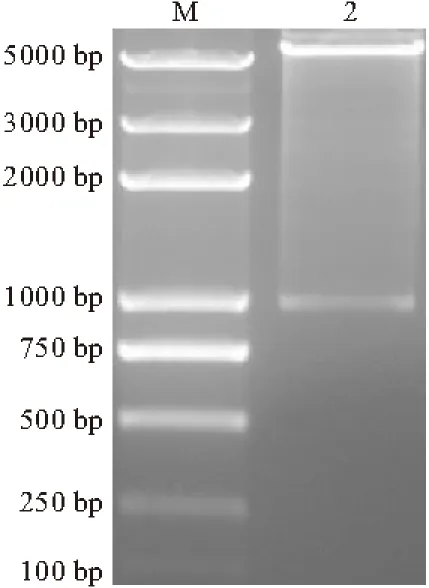
M. DL 5000 DNA marker
由图2可以看出,经NdeⅠ及XhoⅠ双酶切后,重组质粒获得两个特异性条带,大小分别与目的片段及载体相符,表明目的基因已成功构建到表达载体。
2.3 目的蛋白的表达与纯化
经优化表达条件,最终获得目的蛋白最优诱导表达条件为:30 ℃下0.4 mmol·L-1IPTG诱导表达5 h。确定的适宜梯度洗脱条件为:100 mmol·L-1Tris-HCl缓冲溶液(含20 mmol·L-1咪唑、0.5 mol·L-1NaCl,pH值8.0),洗脱流速为1 mL·min-1。SDS-PAGE电泳结果(图3)显示,含pET28a-mph-lc的重组菌能够生成分子量约35 ku的融合型蛋白MPH-L,与理论值相符。

M. Low molecular weight marker 1.MPH-L 2.MPH-W
2.4 甲基对硫磷水解酶活性分析(表1)
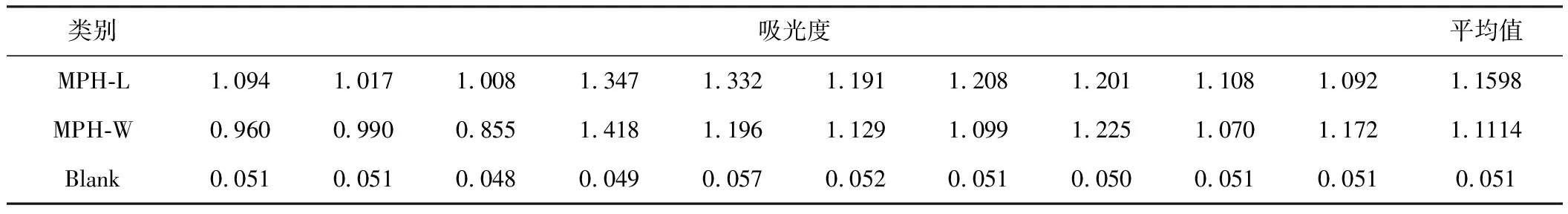
表1 MPH-L与MPH-W酶学反应后吸光度值比较
由表1可知,溶液状态下,MPH-L与底物反应吸光度均值为1.1598,MPH-W为1.1114,两者差别不大,初步证明对MPH-L的基因改造于其酶学活性几乎无影响。
3 结论
用PCR方法获得甲基对硫磷水解酶编码基因,构建了重组表达质粒pET28a-mph-lc,将其转化至E.coliBL21(DE3)中进行表达。当OD600达到0.5~0.6时,用终浓度0.4 mmol·L-1的IPTG在30 ℃下诱导表达5 h,破碎离心后,利用Ni-NTA亲和层析纯化得到具有活性的融合蛋白MPH-L,即在甲基对硫磷水解酶的C端连上一段末端为半胱氨酸的锚链,使得其能定向地固定于经硅烷化修饰的基底表面,为制备生成均质分子印迹膜的模板奠定了基础。
[1] 华小梅,单正军.我国农药的生产使用状况及其污染环境因子分析[J].环境科学进展,1996,4(2):33-44.
[2] 杨亚平,林森.气相色谱法测定蔬菜中有机磷农药的残留量[J].化学分析计量,2003,12(5):23-24.
[3] 东宇.五种高毒农药复配产品禁止销售使用[J]农药市场信息,2004,(14):1.
[4] 小宫山真,竹内俊文,务川高志,等. 分子印迹学——从基础到应用[M] 北京:科学出版社,2006:3-4.
[5] Fu Guoping,Cui Zhongli,Huang Tingting,et al. Expression,purification,and characterization of a novel methyl parathion hydrolase[J]. Protein Expression and Purification,2004,36(2):170-176.
[6] Margaret G R,Rickie B T.Adaptation of the bicinchoninic acid protein assay for use with microtiter plates and sucrose gradient fractions[J]. Analytical Biochemistry,1986,153(2):267-271.
