N-杂环卡宾催化Stetter反应的研究进展
2011-07-26谢益明晁雪静
谢益明,吴 杰,晁雪静
(兰州理工大学石油化工学院,甘肃 兰州 730050)
1 引言
卡宾又名碳烯,是亚甲基及其衍生物的总称,是有机反应过程中形成的不同于正、负碳离子的另一类缺电子的活性中间体。虽然光谱研究已经证明了游离卡宾的存在,但是由于其在大多数条件下反应活性高、寿命短,因而难以分离和表征。此外,游离卡宾的高活性和低反应选择性也常常限制了其在有机化学中的应用。20世纪中期,化学工作者即开始了卡宾的研究工作[1],其中许多早期的实验室工作是由Skell完成的[2]。1964年,Fischer等[3]首次将卡宾引入到无机和金属有机化学中,此后金属卡宾在有机合成和大分子化学中得到了广泛的应用。1968年,Wanzlick等[4]和Öfele[5]合成了N-杂环卡宾(N-Heterocyclic carbene,NHC)的金属络合物,但他们并未分离出游离的NHC,仅限于金属络合物的研究。1991年,Arduengo等[6]首次成功分离得到了第一个稳定的N-杂环卡宾——咪唑-2-碳烯,立即引起了化学界极大的关注,推动了NHC化学的迅速发展。卡宾不再仅仅是原有意义上那种不可捕获的活性中间体。随后,人们通过结构修饰与改造,不断地设计、合成了多种NHC化合物。
在卡宾家族中,NHC由于其结构的特殊性,一直是卡宾化学工作者的关注热点[7]。NHC具有比普通碳卡宾更稳定的化学结构,并且具有毒性小、给电子能力强、空间和电子效应很容易通过改变氮原子上取代基进行调控等特点,其性质类似于富电子的膦配体,且具有良好的热稳定性、耐水性和耐氧化性,在许多情况下可以代替不稳定的膦配体应用于催化反应中。近年来,NHC已成为有机化学家们研究的热点之一,其在催化反应中的应用也越来越广泛,如催化安息香缩合反应[8]、酮与安息香类型化合物反应[9]、醇与醛反应[10]、醛与亚胺反应[11]、不饱和醛与酮反应[12]、酯基交换反应[13,14]、聚合反应[15]、Stetter反应[16,17]等,特别是在安息香缩合反应、分子内不对称Stetter反应的催化中取得了很好的效果。NHC作为有机合成化学的优良催化剂,已在诸多有机小分子催化的反应中扮演着重要的角色[18]。作者在此对近年来NHC催化Stetter反应的研究成果及在天然产物合成中的应用进展作一概述。
2 N-杂环卡宾催化的Stetter反应
2.1 Stetter反应简介
醛经过极性反转后所形成的卡宾与α,β-不饱和酮、酯、腈等发生1,4-加成并得到相应的1,4-二羰基化合物的反应,称之为Stetter反应[19]。NHC催化Stetter反应的机理首先是由噻唑盐经碱去质子得到NHC,然后NHC对醛进行极性反转,再与α,β-不饱和酮、酯和腈等发生1,4-加成,分别得到γ-二酮、4-氧代羧酸酯和4-氧代腈等。Stetter反应找到了一条新的催化途径来合成1,4-双官能团分子,该反应可以由多种噻唑盐催化完成。Stetter反应通常分为分子间的Stetter反应、分子内的Stetter反应、聚合物支撑的Stetter反应和Stetter-Paal-Knorr反应等类型。经过几十年的发展,Stetter反应已经成为有机化学中最重要的合成反应之一,并且在很多天然产物、药物以及新型材料的合成中起到了关键的作用[20]。
2.2 分子间的Stetter反应
在分子间的Stetter催化循环反应中,醛通过卡宾的活化,得到Breslow中间体,随后,酰基阴离子亲核进攻Michael受体。对于直链型的醛,产率通常在60%~80%,α-取代的脂肪醛产率较低,含有共轭或孤立双键的不饱和醛和含孤立三键的醛效果一样。大部分α,β-不饱和酮都可以作为合成1,4-二酮的受体,芳香酮和杂环的α,β-不饱和酮尤为合适。这种方法在有机中间体和各种天然产物的合成中已经得到了广泛的应用。
1989年,Enders研究小组[21]首次尝试了不对称的分子间Stetter反应,并研究了手性噻唑盐(化合物1)等作为催化剂的情况。正丁醛(化合物2)和查尔酮(化合物3)在两相体系中反应得到ee值为39%的1,4-二酮(化合物4),但产率很低,仅有4%(图1)。噻唑钅翁盐和三唑钅翁盐在Stetter反应中的催化活性一直都很低。在非对映选择性的Stetter反应中,三唑钅翁盐表现出一定的催化活性。某些情况下,可以观测到它们和Michael受体形成稳定的加合物,这可能是它们催化活性低的原因。
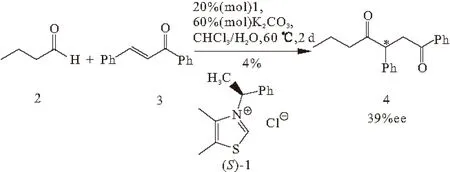
图1 不对称的分子间的Stetter反应
2.3 分子内的Stetter反应
1995年,Ciganek[22]报道了分子内的Stetter反应。2-甲酰基苯氧基巴豆酸酯(化合物6,n=1)和2-甲酰基苯氧基丙烯酸酯(化合物6,n=0)被证明是Stetter反应中反应活性较高的反应物(图2)。可能是由于熵的原因,反应物的活性增强了。这些反应通常在三乙胺作为碱的条件下发生。催化剂的活性常通过DMF的作用提高。为了比较NHC催化剂的效率,由水杨醛的衍生物(化合物6,R1=H)环化得到相应的苯并二氢吡喃(化合物7),同时这也成为了一个基准反应。首次报道出来时,很少有人关注这一重要的反应。

图2 分子内的Stetter反应
2002年,Kerr等[23]取得了重大的进展。用20%(mol)的氨基酸茚醇派生的三唑钅翁盐(化合物8)或苯丙氨酸派生的三唑钅翁盐(化合物9)作为催化剂时,可以得到ee值82%~97%和产率63%~95%的不同的苯并二氢吡喃及其氮杂、硫代和其它杂环类物质(化合物11)(图3)。可是,反应只能用(E)-烯烃作为Michael受体,因为只有这种构型的活性足够高。使用催化剂(R)-9时,受体的γ-位上缺少杂原子的脂肪族可以作为反应物。由于构型自由度增大,Michael受体的亲电性增大,使得形成相应的环烷酮类成为可能。
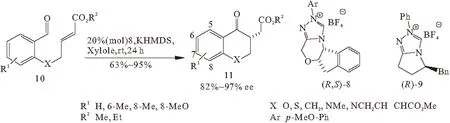
图3 高立体选择性催化的分子内Stetter反应
Moore等[24]、Nakamura等[25]研究发现,催化剂苯环上的取代基是一个决定性因素。研究表明,β,β-二取代的底物(化合物13)反应生成相应的环化物(化合物14),N-五氟苯基取代的催化剂(R,S)-12最有效(图4),ee值达到99%。含多种杂环原子的醛类,如含氧和硫等,很容易和Michael受体反应。(E)-构型体与相应的(Z)-构型体作为反应物,能得到几乎同等的高产率及ee值。生成的六元环类化合物已被证明是一种极具挑战性的目标分子,只有活性很强的反应物,例如酮类Michael受体才能达到较可观的产率,且ee值可达99%。

图4 四元立体中心的Stetter反应
2.4 聚合物支撑的Stetter反应
Enders等[26]首次提出了固定NHC催化剂。Yadav等[16]用分散在氧化铝表面的噻唑盐在微波促进下进行Stetter反应,在无溶剂条件下,脂肪醛、芳香醛和杂环醛与α,β-不饱和酮能得到较高产率的相应1,4-二酮。Barrett等[27]以噻唑(化合物15)为原料,通过开环复分解聚合反应(ROMP)合成了一种凝胶支撑的噻唑碘钅翁盐(化合物17)(图5),它被成功应用于Stetter反应中,并能得到高产率、高纯度的产物。
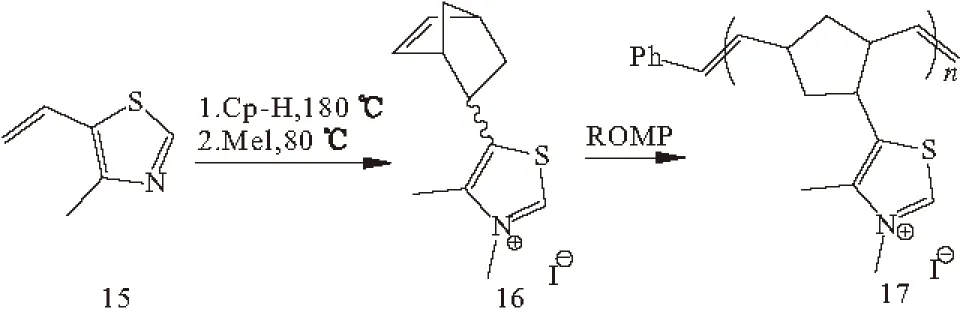
图5 噻唑碘钅翁盐的合成反应
Raghavan等[28]、Kobayashi等[29]报道了负载在树脂上的α,β-不饱和羰基化合物(化合物18)在Stetter反应中的研究(图6)。许多1,4-二酮(化合物20)可从固相中分离得到,这种方法的适用性非常广泛。
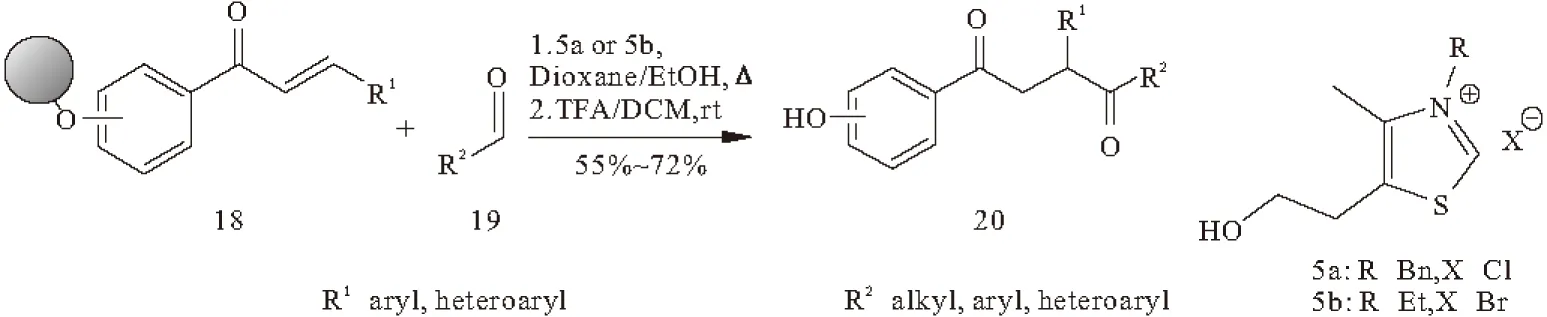
图6 固相合成1,4-二酮的反应
2.5 Stetter-Paal-Knorr反应
Stetter反应产生的1,4-二羰基化合物(化合物25)是合成杂环化合物的重要前体,曾被Braun等[30]和Bharadwaj等[31]用于一锅法Stetter-Paal-Knorr反应来合成多取代的吡咯(化合物27)。用同样的方法,Scheidt等也通过sila-Stetter的串联反应合成多取代的吡咯。在酸存在的条件下,完全转化为化合物25后,伯胺的简单加成得到高产率的多取代吡咯(化合物27),它们是天然产物的重要结构单元之一。Müller等以及Scheidt等也将这种方法应用于呋喃(化合物26)的合成中[32](图7)。

R1=Me,Et,Ph,Cy,o-furyl,p-F-Ph,2-pentyl,p-Me-Ph,p-Cl-Ph,p-MeO-Ph,n-pentyl,2-furyl,(CH2)5OH
Stetter-Paal-Knorr反应还可以用于合成更多的杂环体系[33]。聚1,4-二酮(化合物30)可以通过乙二醛芳烃(化合物28)和双-曼尼希碱(化合物29)反应得到。环闭合后,生成交替共聚物(化合物31)(图8)。
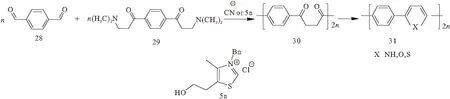
图8 通过Stetter反应合成杂环聚合物
2.6 Stetter反应在天然产物合成中的应用
虽然1,4-二羰基化合物容易获得,但是迄今为止,在天然产物的合成中,只报道了少数几例Stetter反应的应用。1975年,Stetter等[34]报道了顺式-茉莉酮和二氢茉莉酮的合成(图9)。经过催化亲核酰化反应,相应的1,4-二酮环化生成高产率的顺式-茉莉酮(化合物34a)和二氢茉莉酮(化合物34b)。
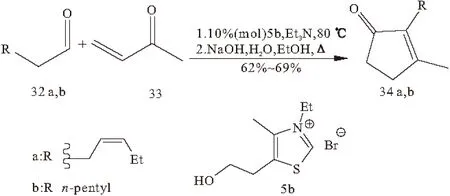
图9 顺式-茉莉酮(34a)和二氢茉莉酮(34b)的合成
Trost等[35]报道了化合物35的分子内Stetter反应,该反应合成三环倍半萜烯(±)多毛真菌酸C(化合物37)的关键步骤之一。化合物37的7个手性中心中的4个通过合适的构型转化形成,并控制着其余3个手性中心的形成。当时的合成难度很大,但是通过三环酮(化合物36),巧妙地得到了实现(图10)。

图10 (±)-多毛真菌酸C的合成
Galopin[36]在(±)-反式-水合桧烯(化合物41)的合成中应用了分子内发生Stetter反应,异戊醛(化合物38)和甲乙烯酮(化合物39)发生Stetter反应生成了1,4-二酮化合物(化合物40),然后环化生成相应的环戊烯酮,是合成化合物41的一种重要中间体(图11)。

图11 (±)-反式-水合桧烯的合成
3 展望
近年来,NHC催化Stetter反应的研究已经取得了迅速的发展,并已经成为最有价值的有机合成反应之一,尤其是催化立体选择性的Stetter反应已经成为当前有机合成化学的热点与前沿领域。对它们的研究重点除了合成新的化合物以外,更重要是在于寻求新的应用领域。而NHC对Stetter反应的不对称催化以及寻求更新、更简洁的方法,为这类反应拓展了更大的发展空间,将成为今后主要的研究目标,其应用也会处于不断的探索和拓展中。同时应该看到,目前对这类反应的研究时间还比较短,至今尚未用于大规模的工业生产中。随着研究的不断深入,NHC催化的Stetter反应必将获得进一步的发展,其在有机合成反应中的应用前景也会更加广阔。可以预见,这类反应必定会对丰富和发展有机化学作出其应有的贡献,发展潜力巨大。
[1] Brookhart M,Studabaker W B.Cyclopropanes from reactions of transition metal carbine complexes with olefins[J].Chemical Reviews,1987,87(2):411-432.
[2] Skell P S,Sandier S R.Reactions of 1,1-digalocyclopropanes with electrophilic reagents.Synthetic route for inserting a carbon atom between the atoms of a double bond[J].Journal of the American Chemical Society,1958,80(8):2024-2025.
[3] Fischer E O,Maasböl A.On the existence of a tungsten carbonyl carbene complex[J].Angewandte Chemie International Edition in English,1964,3(8):580-581.
[4] Wanzlick H W,Schönherr H J.Direct synthesis of a mercury salt-carbene complex[J].Angewandte Chemie International Edition in English,1968,7(2):141-142.
[5] Öfele K.1,3-Dimethyl-4-imidazolinyliden-(2)-pentacarbonylchrom ein neuer übergangsmetall-carben-komplex[J].Journal of Organometallic Chemistry,1968,12(3):42-43.
[6] Arduengo A J,Harlow R L,Kline M.A stable crystalline carbine[J].Journal of the American Chemical Society,1991,113(1):361-363.
[7] Bourissou D,Guerret O,Gabbaï F P,et al.Stable carbenes[J].Chemical Reviews,2000,100(1):39-92.
[8] Enders D,Kallfass U.An efficient nucleophilic carbene catalyst for the asymmetric benzoin condensation[J].Angewandte Chemie International Edition,2002,41(10):1743-1745.
[9] Johnson J S.Catalyzed reactions of acyl anion equivalents[J].Angewandte Chemie International Edition,2004,43(11):1326-1328.
[10] Chan A,Scheidt K A.Conversion ofα,β-unsaturated aldehydes into saturated esters:An umpolung reaction catalyzed by nucleophilic carbenes[J].Organic Letters,2005,7(5):905-908.
[11] Mattson A E,Scheidt K A.Catalytic additions of acylsilanes to imines:An acyl anion strategy for the direct synthesis ofα-amino ketones[J].Organic Letters,2004,6(23):4363-4366.
[12] Burstein C,Glorius F.Organocatalyzed conjugate umpolung ofα,β-unsaturated aldehydes for the synthesis ofγ-butyrolactones[J].Angewandte Chemie International Edition,2004,43(45):6205-6208.
[13] Suzuki Y,Yamauchi K,Muramatsu K,et al.First example of chiralN-heterocyclic carbenes as catalysts for kinetic resolution[J].Chemical Communications,2004,4(23):2770-2771.
[14] Kano T,Sasaki K,Maruoka K.Enantioselective acylation of secondary alcohols catalyzed by chiralN-heterocyclic carbenes[J].Organic Letters,2005,7(7):1347-1349.
[15] Duong H A,Cross M J,Louie J.N-Heterocyclic carbenes as highly efficient catalysts for the cyclotrimerization of isocyanates[J].Organic Letters,2004,6(25):4679-4681.
[16] Yadav J S,Anuradha K,Reddy Subba B V,et al.Microwave-accelerated conjugate addition of aldehydes toα,β-unsaturated ketones[J].Tetrahedron Letters,2003,44(50):8959-8962.
[17] de Alaniz J Read,Rovis T.A highly enantio-and diastereoselective catalytic intramolecular Stetter reaction[J].Journal of the American Chemical Society,2005,127(17):6284-6289.
[18] Marion N,Díez-González S,Nolan S P.N-Heterocyclic carbenes as organocatalysts[J].Angewandte Chemie International Edition,2007,46(17):2988-3000.
[19] Stetter H,Kuhlman H.Addition of aliphatic aldehydes to activated double bonds[J].Angewandte Chemie International Edition in English,1974,13(8):539.
[20] Christmann M.New developments in the asymmetric Stetter reaction[J].Angewandte Chemie International Edition,2005,44(18):2632-2634.
[21] Enders D,Bockstiegel B,Dyker H,et al.Dechema-Monographies[C].VCH:Weinheim,Germany,1993:129,209.
[22] Ciganek E.Esters of 2,3-dihydro-3-oxobenzofuran-2-acetic acid and 3,4-dihydro-4-oxo-2H-1-benzopyran-3-acetic acid by intramolecular Stetter reactions[J].Synthesis,1995,1995(10):1311-1314.
[23] Kerr M S,de Alaniz J Read,Rovis T.A highly enantioselective catalytic intramolecular Stetter reaction[J].Journal of the American Chemical Society,2002,124(35):10298-10299.
[24] Moore J L,Kerr M S,Rovis T.Enantioselective formation of quaternary stereocenters using the catalytic intramolecular Stetter reaction[J].Tetrahedron,2006,62(49):11477-11482.
[25] Nakamura T,Hara O,Tamura T,et al.A facile synthesis of chroman-4-ones and 2,3-dihydroquinolin-4-ones with quaternary carbon using intramolecular Stetter reaction catalyzed by thiazolium salt[J].Synlett,2005,(1):155-157.
[26] Enders D,Gielen H,Breuer K.Immobilized triazolium salts as precursors to chiral carbenes-rhodium-catalyzed asymmetric hydrosilylation as a first test reaction[J].Molecules Online,1998,2(7):105-108.
[27] Barrett A G M,Love A C,Tedeschi L.ROMP gel-supported thiazolium iodide:An efficient supported organic catalyst for parallel Stetter reactions[J].Organic Letters,2004,6(19):3377-3380.
[28] Raghavan S,Anuradha K.Solid-phase synthesis of heterocycles from 1,4-diketone synthons[J].Synlett,2003,(5):711-713.
[29] Kobayashi B,Kaku Y,Higurashi K,et al.A library construction of 2,5-disubstituted pyrrole compounds by using solid/solution-phase syntheses[J].Bioorganic & Medicinal Chemistry Letters,2002,12(13):1747-1750.
[30] Braun R U,Müller T J J.Coupling-isomerization-Stetter and coupling-isomerization-Stetter-Paal-Knorr sequences—A multicomponent approach to furans and pyrroles[J].Synthesis,2004,(14):2391-2406.
[31] Bharadwaj A R,Scheidt K A.Catalytic multicomponent synthesis of highly substituted pyrroles utilizing a one-pot sila-Stetter/Paal-Knorr strategy[J].Organic Letters,2004,6(16):2465-2468.
[32] Mattson A E,Bharadwaj A R,Zuhl A M,et al.Thiazolium-catalyzed additions of acylsilanes:A general strategy for acyl anion addition reactions[J].The Journal of Organic Chemistry,2006,71(15):5715-5724.
[33] Jones R A,Civcir P U.Extended heterocyclic systems. 2.The synthesis and characterisation of (2-furyl)pyridines,(2-thienyl)pyridines,and furan-pyridine and thiophene-pyridine oligomers[J].Tetrahedron,1997,53(34):11529-11540.
[34] Stetter H,Kuhlmann H.Addition von aldehyden an aktivierte doppelbindungen;VII1.Eine neue einfache synthese voncis-jasmon und dihydrojasmon[J].Synthesis,1975,(6):379-380.
[35] Trost B M,Shuey C D,DiNinno Jr F.A stereocontrolled total synthesis of (.+-.)-hirsutic acid C[J].Journal of the American Chemical Society,1979,101(5):1284-1285.
[36] Galopin C C.A short and efficient synthesis of (±)-trans-sabinene hydrate[J].Tetrahedron Letters,2001,42(33):5589-5591.
