烟曲霉Aspergillus Fumigatus 3-甾酮-Δ1-脱氢酶基因的克隆、异源表达和活性鉴定
2011-07-26陈苗苗林良才马昱澍王风清魏东芝
陈苗苗,林良才,马昱澍,王风清,魏东芝
(华东理工大学 生物反应器工程国家重点实验室 鲁华生物技术研究所,上海 200237)
甾体激素在临床上应用广泛,是仅次于抗生素的第二大类药物。目前甾体药物的合成主要依赖于半合成,常用方法是利用微生物转化和化学修饰相结合的方式对天然甾体化合物进行结构改造[1]。其中,C1,2位脱氢反应是甾体微生物转化中最重要的反应类型[2]。许多具有抗炎活性的甾体药物在C1,2位导入双键后,能成倍地增加抗炎活性[3]。3-酮基-4-烯-甾体的C1,2位脱氢反应一般由3-甾酮-Δ1-脱氢酶(KstD)负责[4]。目前,放线菌属的多种细菌被证实存在KstD活性,如简单节杆菌[5]、红球菌[6]、分枝杆菌[7]、诺卡氏菌[8]等。为了提高野生菌活性,研究者尝试对KstD进行异源表达。大肠杆菌是最成功和最有效的异源表达宿主之一[9,10],该系统具有成本低廉、生产效率高和操作简单等优点,但是将简单节杆菌(Arthrobactersimplex)KstD在大肠杆菌中表达时,活性却几乎为零[11];同时,将红串红球菌(Rhodococcuserythropolis)KstD在大肠杆菌中进行异源表达,所得KstD蛋白中40%~50%为包涵体,且重组菌不具有C1,2位脱氢活性[12]。此外,由于大肠杆菌没有甾体泵入泵出机制,只能靠发酵液中分子的自然扩散,而甾体是几乎不溶于水的,因此,虽然对于各种KstD在大肠杆菌系统中异源表达的研究较多,但其甾体转化效果并不十分理想。
烟曲霉酸是烟曲霉(Aspergillusfumigatus)的次生代谢产物,其C1,2位有双键结构[13],据推测烟曲霉烟曲霉酸合成基因簇中含有负责3-甾酮-Δ1-脱氢反应[13,14]的基因。烟曲霉烟曲霉酸合成基因簇已经被全基因测序(Genbank ),根据已经报道的kstD序列与基因簇序列同源比对分析,得到唯一一个具有同源性的编码基因,命名为kstDF。推测烟曲霉素1,2位的双键就是此基因脱氢形成的。烟曲霉能高效产生烟曲霉酸,预示着KstDF应该有较强的C1,2位脱氢能力,如果在异源表达过程中能表现出良好的活性,该酶就很适合用来开发高活性的甾体C1,2位脱氢反应的基因工程菌。加之kstDF来源新颖,从序列上分析,该基因与细菌源kstD核苷酸相似性较低,也具有很高的研究价值。
作者首次克隆了烟曲霉烟曲霉酸合成基因簇中的kstDF,并验证了该真菌基因在大肠杆菌系统中的表达效果,研究了不同诱导条件下KstDF的蛋白表达和活性,进而确定KstDF表达最有利的实验条件,最后考察了该重组菌转化甾体药物的最大能力。
1 实验
1.1 菌株、质粒和培养基
烟曲霉(A.fumigatus) 菌株CICC 40167,中国工业微生物菌种保藏管理中心(CICC)。大肠杆菌DH5α、BL21(λDE3)及质粒pET28a(+),Novagen公司。
大肠杆菌LB培养基:Tryptone 10 g,Yeast extract 5 g,NaCl 10 g,加水至1000 mL;若配制固体培养基,再加入15 g琼脂。
1.2 主要试剂
限制性内切酶、LATaq酶、T4 DNA连接酶、pMD19-T Simple Vector,TaKaRa公司。Plasmid Miniprep Kit、DNA Gel Extraction Kit、Cycle pure Kit,美科美(北京)生物医学科技有限公司。引物均由英潍捷基(上海)贸易有限公司合成。
1.3 烟曲霉基因组的提取[15]
将从培养皿上刮取的菌体或抽滤收获的菌体放入研钵中,加液氮后研磨成粉末。向该粉末中以一定比例(2 mL/0.1 g粉末)加入一定量的DNA抽提液[0.2 mol·L-1Tris-HCl(pH值7.5),NaCl 0.5 mol·L-1,EDTA 0.01 mol·L-1,SDS 1%]和与抽提液等体积的酚-氯仿-异戊醇混合液(体积比为25∶24∶1),于涡旋器上剧烈涡旋3~6 min,然后8000 r·min-1、4 ℃离心5 min。将上清液转移到一新离心管,向该离心管中加入2.5 BV的无水乙醇,-20 ℃放置30 min。取出离心管,10 000 r·min-1、4 ℃离心10 min,弃上清液,在空气中放置10 min使乙醇挥发完全。加入适量的TE溶液[10 mmol·L-1Tris-HCl(pH值7.4),1 mmol·L-1EDTA(pH值8.0)]溶解沉淀即得到基因组DNA。
1.4 烟曲霉kstDF基因的克隆
运用同源序列比对从烟曲霉酸基因簇中钓取出kstDF序列全长,根据kstDF基因序列,设计扩增引物kstDF-U:5′-CCGAGAATTCATGGCCGCAAGACAGCTC-3′(下划线部分为EcoRⅠ酶切位点)和kstDF-D:5′-ATGCAAGCTTCTATACATGCTCAGAAGCAATAT-3′(下划线部分为HindⅢ酶切位点)。
以烟曲霉基因组DNA为模板,用上述引物扩增kstDF基因。PCR反应体系:2×PCR Mix 25.0 μL,5′-端引物1.0 μL,3′-端引物1.0 μL,模板DNA 0.2 μL,ddH2O 23.0 μL。PCR反应条件:95 ℃变性4 min;95 ℃变性30 s,48 ℃退火30 s,72 ℃延伸2 min,29个循环;72 ℃保温10 min,4 ℃保温。
1.5 重组质粒的构建
PCR产物和提取的质粒pET28a(+)分别用EcoRⅠ和HindⅢ进行双酶切,酶切产物经纯化回收后,用T4 DNA连接酶于16 ℃过夜连接,重组质粒转化大肠杆菌DH5α,挑取阳性转化子分别用PCR和双酶切法进行验证,并进行测序。再将验证完全正确的阳性转化子的质粒转入宿主菌 BL21(λDE3)中,获得产KstDF的基因工程菌。
1.6 3-甾酮-Δ1-脱氢酶基因(kstDF)在大肠杆菌中的表达及诱导条件的优化
按1%接种量,将上述基因工程菌接种于50 mL LB液体培养基(含50 μg·mL-1卡那霉素)中,于37 ℃、250 r·min-1振荡培养,同时以空宿主BL21(λDE3)作对照。待OD600至0.4~0.6,加入终浓度为0.5 mmol·L-1的异丙基-β-D-硫代吡喃半乳糖苷(IPTG),分别于20 ℃、30 ℃、37 ℃的诱导温度下进行实验,150 r·min-1培养6 h,诱导外源蛋白的表达。检测菌液的OD600,7000 r·min-1、4 ℃离心5 min,收集菌体,用0.05 mol·L-1pH值7.5 Tris-HCl缓冲溶液(0.05 mol·L-1Tris,0.04 mol·L-1HCl)重悬,将OD600浓缩至4.0。取100 μL浓缩后的菌液,加入一定量的蛋白上样缓冲溶液,煮沸5 min,取10 μL进行十二烷基磺酸钠聚丙烯酰胺电泳(SDS-PAGE)。
1.7 3-甾酮-Δ1-脱氢酶(KstDF)的活性检测
向10 mL不同诱导温度下的重组大肠杆菌浓缩液和BL21(λDE3)浓缩液中分别加入终浓度为13.3 mg·L-1的底物雄甾-4-烯-3,17-二酮(AD,用乙醇溶解),在30 ℃、200 r·min-1条件下进行反应,12 h后取样1 mL,加入等体积乙酸乙酯萃取3次,然后12 000 r·min-1离心10 min,将上清转移至干净离心管进行薄层色谱分析(TLC)。同时,将20 ℃诱导6 h的菌株加入AD反应2 h后,用乙酸乙酯萃取3次,进行HPLC分析。
1.8 TLC和HPLC分析方法
TLC分析方法:采用硅胶G板薄层层析技术分离底物AD和目标产物雄甾-1,4-二烯-3,17-二酮(ADD),展层剂中石油醚和乙酸乙酯的体积比为3∶2,点样量为30 μL。点样结束后,将薄板置于层析缸中,待层析液的前沿迁移至距离硅胶板前沿1 cm时,取出硅胶板。向硅胶板上喷淋15%(体积分数)硫酸,100 ℃烘烤10 min,待板上物质显色完全后进行分析鉴定。
HPLC分析方法:将用于TLC的样品置于通风橱中,待乙酸乙酯挥发干,向离心管中加入等体积色谱级甲醇,振荡使沉淀溶解,12 000 r·min-1离心10 min,取出上清进行HPLC实验。色谱条件:Agilent1100型高效液相色谱仪,Agilent XDB-C18(4.6 mm×250 mm)色谱柱,柱温40 ℃;采用DAD紫外检测器,检测波长254 nm;流动相为甲醇∶水=7∶3,流速1 mL·min-1,进样量10 μL。
1.9 大肠杆菌表达KstDF酶动力学参数的测定
以HPLC法检测大肠杆菌以AD为底物表达KstDF的酶动力学参数,测定过程中,酶的浓度恒定,改变底物的浓度(不存在底物过量的情况),测得一组反应初速度。检测菌液OD600,7000 r·min-1、4 ℃离心5 min收集菌体,用Tris-HCl缓冲溶液(pH值7.5)重悬,将OD600浓缩至4.0。超声处理破碎细胞(功率200 W,每超声5 s间隔20 s,共超声10次,全程在冰上操作),得到细胞破碎液。1 mL反应混合物(5 mL管盛装)由800 μL大肠杆菌破碎液、150 μmol·L-1吩嗪二甲酯硫酸盐(PMS)以及一定浓度的底物AD组成[每个反应体系对应的AD浓度(μmol·L-1)分别为8、16、32、64、100、128],在30 ℃、200 r·min-1条件下培养15 min。向每管各加乙酸乙酯萃取3次,12 000 r·min-1离心10 min,取上层溶液,待有机相挥发后,加1 mL甲醇复溶,12 000 r·min-1离心10 min,取上层溶液进行HPLC检测。
2 结果与讨论
2.1 3-甾酮-Δ1-脱氢酶基因(kstDF)的克隆
根据烟曲霉的kstDF(Genbank accession number XM_746255)全长基因序列,扩增目的基因kstDF。PCR产物的琼脂糖凝胶电泳检测结果如图1所示。
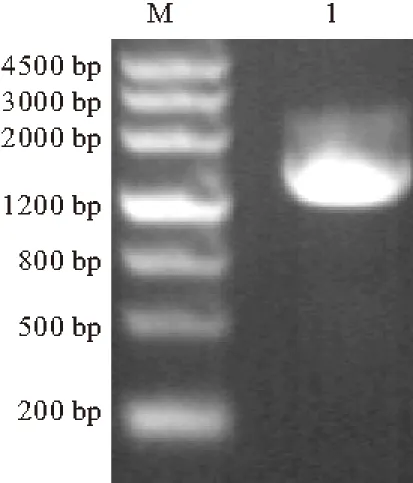
M.DNA分子质量标准 1.kstDF
由图1可知,kstDF基因大小约1791 bp,不包含任何内含子,编码596个氨基酸,预测分子量为64.53 kDa,等电点为7.81(http://www.expasy.org/cgi-bin/protparam)。与已报道的玫瑰色热微菌(Thermomicrobiumroseum) DSM 5159 3-甾酮-Δ1-脱氢酶的kstD的氨基酸序列一致性为51%。在KstDF氨基酸序列的N端含有保守的FAD结合结构域,即GSG(A/G)(A/G)(A/G)X17E(图2)。推测烟曲霉KstDF的活性中心是位于296~323位的27个氨基酸:GERSIRARCGVLLCAGGFAHNQGLRER。

M.tubertulosis:结核分枝杆菌KstD R.erythropolis:红平红球菌KstD A.simplex:简单节杆菌KstD A.fumigatus:烟曲霉KstD;实线方框和虚线方框分别指示FAD结合结构域和酶活性中心
2.2 重组质粒的构建与转化
将来源于烟曲霉的3-甾酮-Δ1-脱氢酶基因(kstDF)克隆到质粒pET28a(+)中,所得重组质粒转化E.coliBL21(λDE3),随机选择可能的阳性重组子进行菌落PCR和双酶切鉴定,琼脂糖凝胶电泳分析如图3所示。
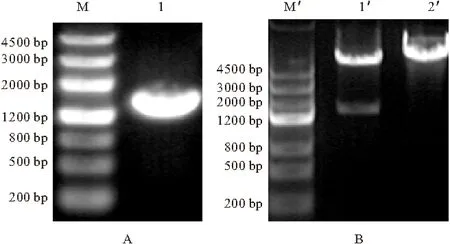
A:M.DNA标准分子质量 1.烟曲霉kstDF B:M′.DNA标准分子质量 1′.Hind Ⅲ和Eco RⅠ酶切pET28a(+)-kstDF 2′.pET28a(+)-kstDF
由图3可知,PCR扩增出的条带大小约为1800 bp,与实际kstDF大小(1791 bp)相符,对重组质粒进行双酶切获得大小分别为5400 bp[pET28a(+)]和1800 bp(kstDF)的两条DNA片段,说明重组菌株构建成功,命名为BL21(DE3)-pET28a-kstDF。
2.3 KstDF的表达及诱导条件的优化
重组菌在三个不同的温度下(20 ℃、30 ℃、37 ℃)分别进行诱导实验,150 r·min-1诱导6 h后,进行SDS-PAGE鉴定,结果如图4所示。
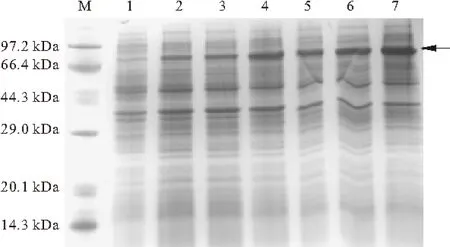
M.蛋白标准分子质量 1.E.coli BL21(λDE3) 2,3.20 ℃诱导 4,5.30 ℃诱导 6,7.37 ℃诱导
由图4可知,目的蛋白大小约为66 kDa(箭头指示位置),与对照相比,BL21-pET28a-kstDF目的蛋白的表达量较高,且不同诱导温度的蛋白表达差异明显。20 ℃表达量最低,37 ℃表达量最高,蛋白表达量随着诱导温度的升高而增加。
2.4 KstDF重组大肠杆菌对底物AD的全细胞转化
向不同诱导条件下的大肠杆菌中分别加入终浓度为13.3 mg·L-1的底物AD,30 ℃、200 r·min-1条件下反应12 h,萃取3次,TLC分析C1,2位脱氢产物ADD的生成量,结果如图5所示。
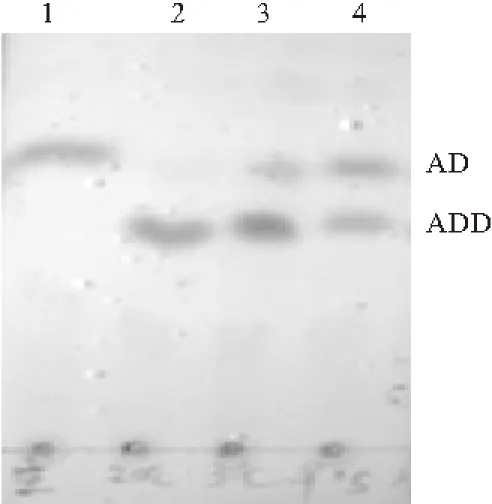
1.E.coli BL21(λDE3) 2.20 ℃诱导 3.30 ℃诱导 4.37 ℃诱导
由图5可知,37 ℃诱导的蛋白表达量最高,但是酶活最低,底物AD有很多剩余;而20 ℃诱导的菌体,虽然蛋白表达量较低但酶活最高,将AD全部转化为ADD。由此推测低温诱导有利于KstDF的酶活表达;高温诱导时,在相同时间内KstDF表达量比低温诱导的表达量高很多,可能因为表达速度过快导致大量KstDF非正确折叠,失去生物学活性。
2.5 重组大肠杆菌转化AD的HPLC分析
将20 ℃诱导6 h的菌株加入AD反应2 h,萃取3次,挥发干燥,再用甲醇溶解固形物,用C18色谱柱分析,结果如图6所示。
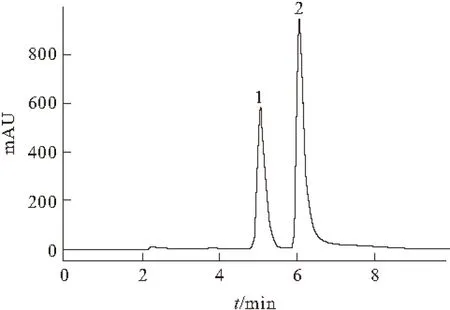
1.ADD 2.AD
根据标准曲线(标准品ADD摩尔浓度与254 nm下光吸收值之间的关系曲线),积分计算峰面积,比上各自的消光系数,就可以推算出转化率。经计算,反应2 h,约17%的AD转化为ADD。张艺[16]报道简单节杆菌转化AD的水平为:投入5 mg·L-1底物AD反应 48 h后,转化率为45%。与之相比,本研究重组菌的活性表现良好。但是,Li等[11]报道,转化简单节杆菌kstD的重组枯草杆菌48 h转化1 g·L-1AD的转化率为45.3%。因此,重组大肠杆菌离生产应用仍存在一定差距,这可能是因为大肠杆菌没有甾体物质主动运输机制,且甾体物质的水溶性很差,因此其传质和反应效率无法与那些可以主动摄取甾体的生产菌株(如分支杆菌、链霉菌、枯草芽孢杆菌、酵母菌和丝状真菌等)相比较。
2.6 大肠杆菌表达KstDF的酶动力学参数测定
以HPLC法检测大肠杆菌以AD为底物表达KstDF的酶动力学参数。取一定量粗酶液加入不同浓度的底物AD,将反应液在30 ℃、200 r·min-1条件下培养15 min。加乙酸乙酯终止反应,萃取代谢产物进行HPLC分析。基于Lineweaver and Burk方法对实验数据作图,x轴为1/[AD]、y轴为1/v。根据双倒数法公式,Km等于x轴截距的倒数的负数,计算得Km值为0.2 mmol·L-1。Mycobacteriumsp.VKM Ac-1817D以9-OH-AD为底物表达KstD时Km值为(0.81±0.20)mmol·L-1,由于AD的水溶性更低,Km值必然更高[17]。相比之下,本实验KstDF与底物AD显示出较好的亲和力。

图7 BL21-pET28a-kstDF表达KstD反应动力学双倒数图
2.7 讨论
从A.fumigatus克隆出一个真菌来源的kstDF基因,首次鉴定了该基因的3-甾酮-Δ1-脱氢酶功能。该基因编码596个氨基酸,与该基因同源性最高的是来源于玫瑰色热微菌(Thermomicrobiumroseum) DSM 5159的kstD,两者氨基酸序列一致性为51%。与细菌来源的KstD比对后发现kstDF的氨基酸序列包含相似FAD结合结构域和活性中心。
关于3-甾酮-Δ1-脱氢酶的研究报道很多,其中功能基因得到鉴定的3-甾酮-Δ1-脱氢酶包括简单节杆菌[5]、珊瑚诺卡氏菌[18]、灰暗诺卡氏菌[19]、偶发分枝杆菌[7]和红串红球菌[6]等。但是以上KstD的研究都是局限在细菌范围内,没有出现过关于真菌KstD的报道。基于Lodeiro等[14]报道的烟曲霉产烟曲霉酸基因簇序列,以及对烟曲霉酸结构的分析,本实验推测KstDF负责烟曲霉酸C1,2位脱氢反应。通过克隆和大肠杆菌异源表达实验,KstDF显示不同于细菌来源KstD的特点,在大肠杆菌中表现良好的活性。分析原因可能是与细菌来源的膜蛋白相比[5,7,20,21],真菌来源KstDF溶解性较好,结合并催化等量甾体物质的相对酶浓度更高,从而表现出良好的生物学活性。本研究首次鉴定了一个真菌来源KstD,该酶具有将AD脱氢转化为ADD的活力。通常真菌中具有庞大的甾体转化相关的基因,但很少被了解和研究。本研究为开发真菌资源在科研和应用方面的价值奠定了基础。
3 结论
以烟曲霉(A.fumigatus)为出发菌株,运用同源序列比对从烟曲霉酸基因簇中钓取出kstDF序列。该基因与玫瑰色热微菌(Thermomicrobiumroseum) DSM 5159的kstD一致性为51%。构建pET28a(+)-kstDF表达载体,转化大肠杆菌(Escherichiacoli) BL21(λDE3),获得高表达重组子菌株。经IPTG诱导、SDS-PAGE电泳分析,发现高温(37 ℃)有利于KstDF蛋白表达,低温(20 ℃)有利于酶活的保持。实验中该重组菌显示出良好的甾体转化能力,在12 h内完全转化13.3 mg·L-1雄甾-4-烯-3,17-二酮(AD),为构建高效转化3-酮基-4-烯类固醇的基因工程菌奠定了基础。
[1] Kieslich K.Microbial side-chain degradation of sterols[J].Journal of Basic Microbiology,1985,25(7):461-474.
[2] Adham N E,El-Hady A A,Naim N.Biochemical studies on the microbial-Δ1-dehydrogenation of cortisol byPseudomonasfluorescens[J].Process Biochemistry,2003,38(6):897-902.
[3] Fokina V V,Arinbasarova A Y,Zubov L A,et al.Dehydrogenation of steroid substrates by the cells ofArthrobacterglobiformis193 incorporated in poly(vinyl alcohol) cryogels[J].Appllied Biochemistry and Microbiology,1995,31(2):18-19.
[4] Itagaki E,Matsushita H,Hatta T.Steroid transhy-activity of 3-ketosteroid-Δ1-dehydrogenase fromNocardiacorallina[J].Journal of Biochemistry,1990,108(1):122-127.
[5] Penasse L,Peyre M.Studies of 3-oxosteroid-Δ1-oxidoreductase ofArthrobactersimplex[J].Steroids,1968,12(4):525-544.
[6] Kaufmann G,Thole H,Kraft R,et al.Steroid-1-dehydrogenase ofRhodococcuserythropolis:Purification and N-terminal amino acid sequence[J].Journal of Steroid Biochemistry and Molecular Biology,1992,43(4):297-301.
[7] Wovcha M G,Kevin E.Brooks evidence for two steroid 1,2-dehydrogenase activities inMycobacteriumfortuitum[J].Biochimica et Biophysica Acta,1979,574(3):471-479.
[8] Buckland B C,Dunnill P,Lilly M D.The enzymatic transformation of water-insoluble reactants in nonaqueous solvents.Conversion of cholesterol to cholest-4-ene-3-one by aNocardiasp.[J].Biotechnology and Bioengineering,1975,17(6):815-826.
[9] Hockney R C.Recent developments in heterologous protein production inEscherichiacoli[J].Trends of Biotechnology,1994,12(11):456-463.
[10] Grisshammer R,Tate C G.Overexpression of integral membrane proteins for structural studies[J].Quarterly Review of Biology,1995,28(3):315-422.
[11] Li Y,Lu F,Sun T,et al.Expression ofksdDgene encoding 3-ketosteroid-Δ1-dehydrogenase fromArthrobactersimplexinBacillussubtilis[J].Letter of Applied Microbiology,2007,44(5):563-568.
[12] Wagner M,Atrat P G,Wagner B.Overexpression of aRhodococcuserythropolisprotein inEscherichiacoliwith immunological identity to theRhodococcussteroid 1-dehydrogenase.Immunoelectron microscopic localization and electrophoretic studies[J].Journal of Basic Microbiology,1992,32(4):269-277.
[13] Mitsuguchi H,Seshime Y.Biosynthesis of steroidal antibiotic fusidanes:Functional analysis of oxidosqualene cyclase and subsequent tailoring enzymes fromAspergillusfumigates[J].Journal of the American Oil Chemists Society,2009,131(18):6402-6411.
[14] Lodeiro S,Xiong Q B.Protostadienol biosynthesis and metabolism in the pathogenic fungusAspergillusfumigates[J].Organic Letter,2009,11(6):1241-1244.
[15] 方卫国.真菌核酸的一种快速提取方法[J].应用与环境生物学报,2002,8(3):305-307.
[16] 张艺.简单节杆菌催化甾体化合物C1,2位脱氢规律的研究[J].中国新药杂志,2008,17(24):2103-2107.
[17] Sukhodolskaya G V,Nikolayeva V M,Khomutov S M,et al.Steroid-1-dehydrogenase ofMycobacteriumsp.VKM Ac-1817D strain producing 9α-hydroxy-androst-4-ene-3,17-dione from sitosterol[J].Applied Microbiology and Biotechnology,2007,74(4):867-873.
[18] Itagaki E,Wakabayashi T, Hatta T.Purification and characterization of 3-ketosteroid-Δ1-dehydrogenase fromNocardiacoralline[J].Biochimica et Biophysica Acta,1990,1038(1):60-67.
[19] Drobnic K,Krizaj I,Gubensek F,et al.Improved purification of steroid 1,2-dehydrogenase fromNocardiaopacaand partial characterization of its cloned gene sequence[J].Biochemistry and Biophysiology Research Communication,1993,190(2):509-515.
[20] Sih C J,Bennet R E.Steroid 1-dehydrogenase ofNocardiarestrictus[J].Biochimica et Biophysica Acta,1962,56:584-592.
[21] Plesiat P,Grandguillot M,Harayama S.Cloning,sequencing,and expression of thePseudomonastestosteronigene encoding 3-oxosteroid-△1-dehydrogenase[J].Journal of Bacteriology,1991,173(12):7210-7219.
