基于Au-Ni复合材料的新型葡萄糖传感器的研究
2011-06-26姚天明杨卉彦齐骏飞王炜祺黄杉生
姚天明,杨卉彦,齐骏飞,王炜祺,黄杉生
(上海师范大学生命与环境科学学院,上海200234)
0 引言
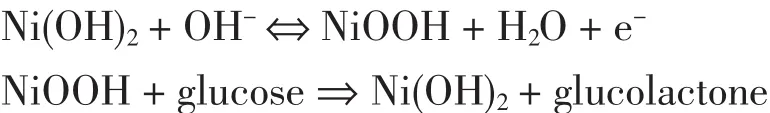
合金以及复合材料因有着比单一金属或材料更为出色的性能被大量的制备和研究[10~13]。以Ni合金及其与其他材料,如聚苯胺,碳纳米管混合制备的化学传感器可用于葡萄糖的检测[14~17]。金纳米粒子由于具有出色的电子传递性,良好的生物相容性,较大的比表面积,因而常被用来作为电极上的电子导线。近年来金纳米粒子一直被广泛研究[18~19]。该文制备了一种金和镍的核壳复合材料,将其修饰在电极表面,利用上所述Ni对于葡萄糖的催化原理,结合金的出色电子传递性来加强信号,借助各种电化学方法实现对葡萄糖快速,方便,精确的检测。
1 实验部分
1.1 试剂与仪器
壳聚糖(Chitss)、氯金酸(HAuCl4)购于上海化学试剂有限公司;聚乙烯吡咯烷酮(PVP,40000),NiCl2·6H2O购于上海国药;[Fe(CN)6]4-/3-溶液由定量的铁氰化钾,亚铁氰化钾和氯化钾配制;其他使用试剂均为分析纯。实验用水为2次水(>18 MΩ·cm)
电化学实验均在CHI 760 C型电化学工作站(上海辰华仪器有限公司)上进行,三电极体系:修饰电极为工作电极,铂丝电极为对电极,饱和甘汞电极为参比电极(SCE)。紫外-可见(UV-VIS)光谱实验采用UV-2020型紫外-可见分光光度计(上海优尼科仪器有限公司);其他仪器为实验室pH计;超声仪;真空干燥箱。XRD测试采用Rigacu公司D2000型X射线衍射仪,对样品进行物相分析。
1.2 传感器的制备
1.2.1 Au-Ni复合材料的制备
在室温20℃下,分别称取0.2 g聚乙烯吡咯烷酮(PVP,40000),0.034g NiCl2·6H2O,溶于 200mL去离子水中,超声溶解并用氮气净化各15 min,迅速将新鲜配置的 80mL NaBH4(0.04 g)逐滴滴加入上述溶液并搅拌,全部滴加完毕后,在保持搅拌情况下, 迅速逐滴滴加 1;2;4;8mL HAuCl4(4.8 mmol/L)水溶液,不断搅拌 30 min 后离心,再用乙醇和水分别洗涤3次,得到镍金复合材料,用Au-Ni表示。图1为该文制备的Au-Ni复合材料的XRD谱图,曲线1到4分别为加入不同浓度Au的谱图,与标准谱图卡比较,随着加入HAuCl4的量的不断增加,Au的衍射峰越发明显,Ni的衍射峰只在曲线1中可以看出,XRD的结果显示材料是外层Au包裹Ni的结构。
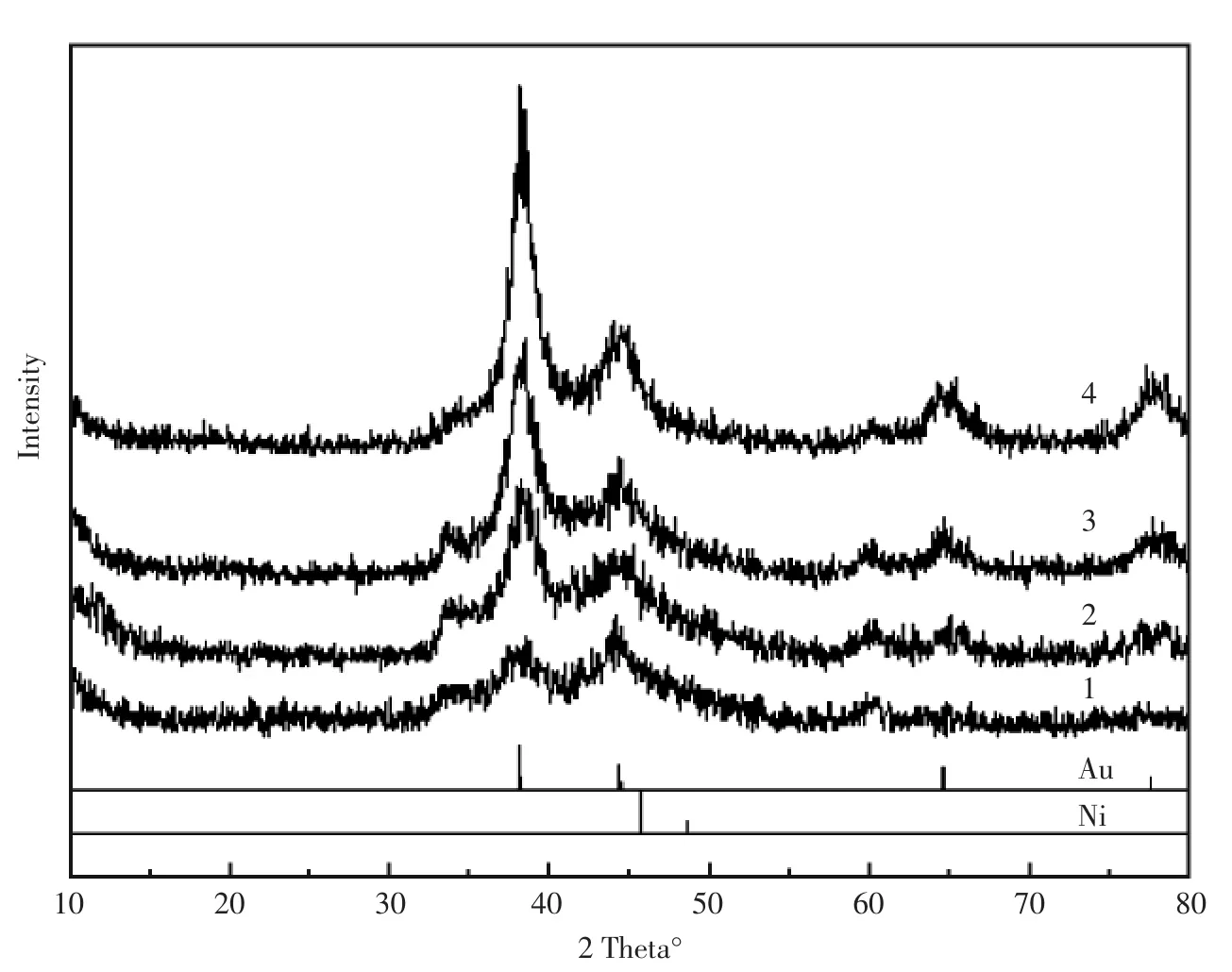
图1 不同Au含量的Au-Ni材料的XRD谱图Fig.1 XRD image of Au-Ni with different content of Au
纳米Au和纳米Ni的制备分别按文献所述制备[19~20]。
1.2.2 电极的制备
12月25日晚间,三七互娱公告称,代理董事长李卫伟提议公司回购股份,回购资金总额不低于3亿元,不超过6亿元,回购价格不超过15元/股。若全额回购且按回购总金额上限和价格上限测算,预计可回购约4000万股,回购比例约占公司总股本的1.88%。
玻碳电极分别用 1.0、0.3、0.05 mm 的氧化铝粉末打磨抛光,直至产生一个光亮、平滑的表面。电极再依次用超纯水,无水乙醇,超纯水超声清洗3 min后,用氮气将其表面吹干。
(1)将5 μL w=0.5%的壳聚糖溶液滴加到处理好的电极表面,放入干燥器中,形成一层壳聚糖薄膜Chitss/GCE。然后将修饰电极浸泡到不断搅拌着的Au-Ni水溶液(2 mg/mL)中 12 h,得到Au-Ni/Chitss/GCE,用超纯水彻底冲洗,以除去吸附不牢的Au-Ni,用同样的方法也可得到Au/Chitss/GCE,Ni/Chitss/GCE,电极放入干燥器备用。
(2)将事先混合了的含有2 mg/mL Au-Ni,Ni,Au 的壳聚糖溶液(w=0.5%)5 μL 直接滴加到处理好的电极表面,为了区别于上述依吸附法得到的电极,按滴涂混合溶液得到的电极加上大括弧,以示区别:{Au-Ni/Chitss}/GCE, {Ni/Chitss}/GCE,{Au/Chitss}/GCE,制好的电极放入干燥器备用。
2 结果与讨论
2.1 修饰电极的循环伏安表征
图2为不同修饰电极在0.6 V到-0.2 V的电位范围内, 在含有0.1 mol/L KCl的 1 mmol/L[Fe(CN)6]4-/3-溶液中的循环伏安曲线。混合法修饰得到的{Au-Ni/Chits}/GCE(d)所产生氧化还原峰明显强于用吸附法所修饰的Au-Ni/Chits/GCE(f)(为突出比较这两根循环伏安曲线,将其放在了图2中的左上插图 )。 虽然Au作为一个良好的电子媒介体可以起增强电信号的作用,但吸附修饰会因为Au本身带负电,屏蔽了壳聚糖表面氨基所带的正电荷,所以阻碍了Fe(CN)63-/4-之间的电子转移[9,21],使得信号变小。吸附法几乎无法将Ni修饰于电极表面,所以Ni/Chits/GCE(c)的响应电流比较接近裸玻碳电极(a)。
2.2 电极修饰过程的电化学交流阻抗表征
EIS可用来表征电极在每一步修饰过程中的阻抗变化,图3谱图所示半圆的直径表示电子迁移阻抗,而阻抗的大小控制[Fe(CN)6]4-/3-在电极表面迁移的动力学[22]。裸GCE(a)在低频区是一个小半径的半圆,在高频区几乎是一条直线,Chits/GCE(b)低频区的半圆变小,因为壳聚糖表面有大量带正电荷的氨基,促进Fe(CN)63-/4-之间的电子转移。而{Au-Ni/Chits}/GCE(c)阻抗变大是由于Au的存在部分阻碍了电子的转移,Au/Chits/GCE(d)的阻抗则相对较大。左上内插图 中外围的高频区2个大半径阻抗分别对应的是吸附法制备的Au-Ni修饰电极和Ni修饰电极。所有的阻抗图与CV图中的表征结论相一致。通过CV和EIS结果发现混合法修饰了Au-Ni材料的电极有着比较好的电化学响应。
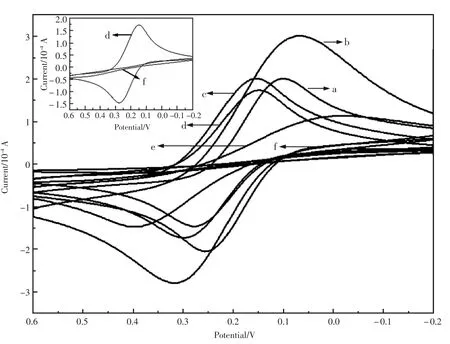
图2 不同修饰电极在含有0.1 mol/L KCl 1 mmol/L[Fe(CN)6]4-/3-溶液中的循环伏安图(a)GCE;(b)Chits/GCE;(c)Ni/Chits/GCE;(d){Au-Ni/Chits}/GCE;(e)Au/Chits/GCE.左上插图 为曲线(d)和曲线(f)的对比Fig.2 The CV images of different modified electrodes in 1 mmol/L[Fe(CN)6]4-/3-contaiNing 0.1 mol/L KCl The illustration in the upper left corner is the comparison of curve(a)and curve(f)
图3 不同修饰电极在 10 mmol/L[Fe(CN)6]4-/3-(含有 0.1 mol/L KCl)中的交流阻抗图,(a)GCE,(b)Chits/GCE ,(c){Au-Ni/Chits}/GCE, (d)Au/Chits/GCE, (e)Au-Ni/Chits/GCE, (f){Ni/Chits}/GCEFig.3 The EIS images of different layers modified electrodes,(a)GCE,(b)Chits/GCE , (c){Au-Ni/Chits}/GCE,(d)Au/Chits/GCE, (e)Au-Ni/Chits/GCE, (f){Ni/Chits}/GCE
2.3 修饰电极的性能测定
不同修饰电极在含有2×10-4mol/L葡萄糖的0.2 mol/L NaOH溶液中的循环伏安图(图4)。图4中内插图 为葡萄糖在裸玻碳电极以及以吸附法制备的修饰电极上的电化学响应,由图可见,它们几乎没有电流响应。而葡萄糖在{Au-Ni/Chits}/GCE有明显的响应信号。
图5 为葡萄糖(0.2 mol/L NaOH 溶液)在{Au-Ni/Chits}/GCE电化学响应。随着葡萄糖的量的增加,电极的响应电流增加,且氧化峰没有发生峰位移[23],说明复合材料中的Au,Ni的协同作用不仅可以稍微降低对于葡萄糖氧化的电位,同时Au的存在更有利于电子的传递。
考察了不同扫数下电极在含有2×10-4mol/L葡萄糖的NaOH(0.2 mol/L)溶液中循环伏安曲线,由图6可见,氧化峰的峰电流随着扫速的增加而变大,而氧化峰电流与扫描速度的平方根呈线性关系,表明这是一个受扩散控制的反应过程。
2.4 修饰电极响应条件的优化
2.4.1 Au-Ni材料对电极响应的影响
考察了修饰不同Au-Ni材料中Au的含量对传感器的电流响应的影响。在Au-Ni材料中分别加入1; 2; 4; 8mL HAuCl4(HAuCl4浓度为 4.8 mmol/L),Au-Ni对应的电流响应。结果表明加入了2mL HAuCl4的Au-Ni制备的电极有着相对较好的电流响应。
2.4.2 NaOH溶液浓度的选择
使用Ni修饰电极测定葡萄糖时选用碱性介质pH值一般为13或稍高[24~25],因此选择接近0.1 mol/L浓度NaOH溶液进行测定。分别维持底液中 NaOH 浓度为 0.05;0.1;0.2;0.5;1.0 mol/L,考察了葡萄糖在电极上的电化学响应。过高NaOH浓度下,葡萄糖容易被其它的氧化介质氧化或解离。会对测定结果产生一定的误差。实验选择0.2 mol/L的NaOH溶液作为测试底液。
2.4.3 工作电位的选择
从循环伏安曲线中可以得到修饰电极对葡糖糖的氧化峰在0.4 V左右, 选择0.3 V到0.5 V这一电位区间对葡萄糖进行计时电流测定,发现0.4 V电位条件下得到最佳的响应。
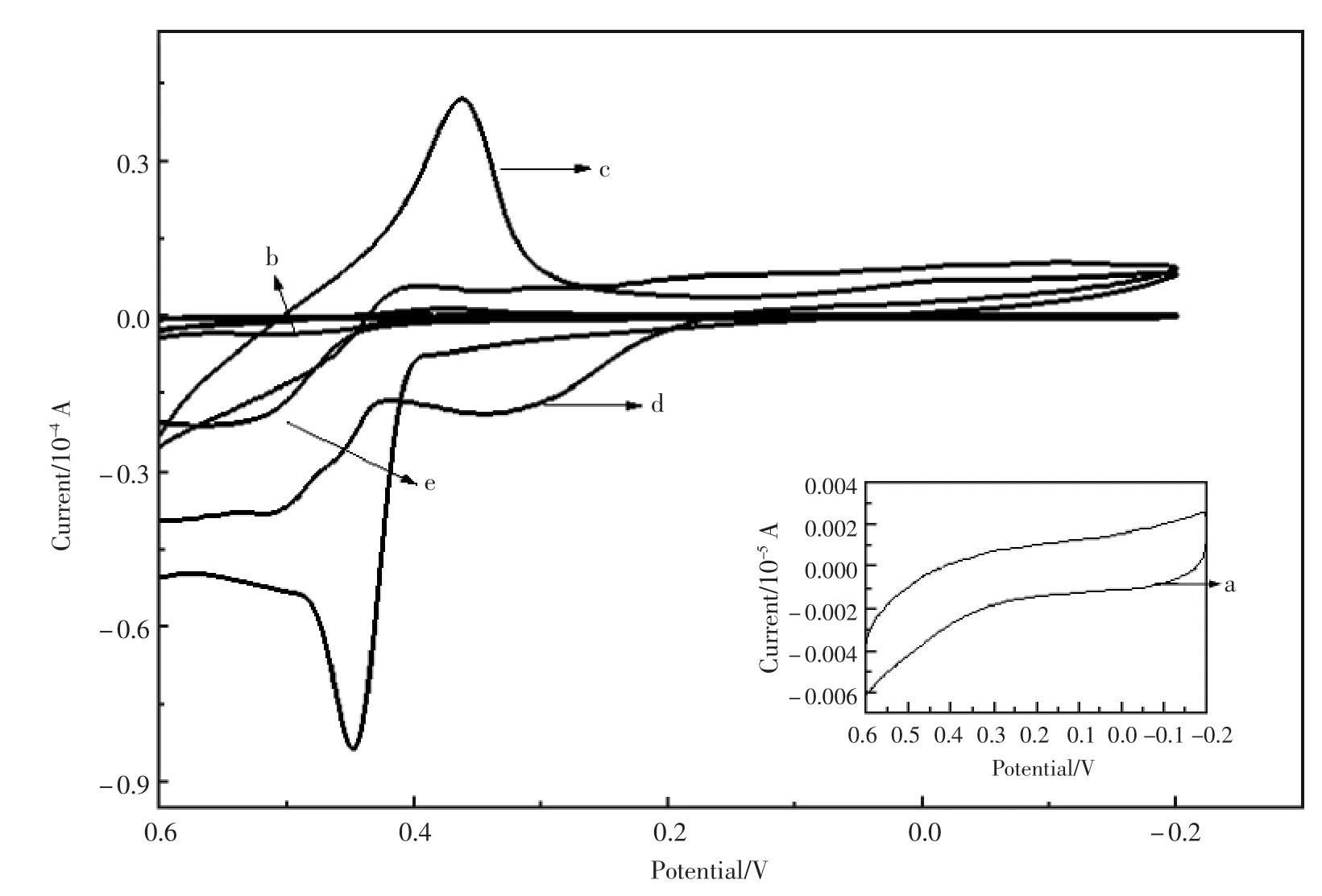
图4 不同修饰电极在含有2×10-4mol/L葡萄糖的0.2 mol/L NaOH溶液中的循环伏安图(a)GCE;(b)Au/Chits/GCE;(c){Ni-Au/Chits}/GCE;(d){Ni/Chits}/GCE;(e)Ni-Au/Chits/GCEFig.4 The CV images of different modified electrodes in 0.2 mol/L NaOH containing 2×10-4mol/L glucose(a)GCE;(b)Au/Chits/GCE;(c){Ni-Au/Chits}/GCE;(d){Ni/Chits}/GCE;(e)Ni-Au/Chits/GCE

图5 修饰电极对葡萄糖的响应,从上到下为0,0.2,0.4,0.6,0.8,1.0 mmol/L 葡萄糖的 0.2 mol/L NaOHFig.5 The cyclic voltammograms of the modifies electrode in 0.2 mol/L NaOH contaiNing different concentration of glucose
综上所述,最终选择加入2mL 4.8 mmol/L HAuCl4制备的 Au-Ni壳聚糖(2 mg/mL)修饰电极,在 0.4 V 的工作电位下,在 0.2 mol/L 的 NaOH溶液中进行测定。
2.5 修饰电极的计时电流响应,抗干扰实验,稳定性及重现性
修饰电极在 0.4 V的工作电位下,向 0.2 mol/L NaOH溶液中连续加入葡萄糖,得到电极的计时电流响应曲线(图7)。响应电流随每次葡萄糖的加入而增加并快速达到90%以上的稳态电流。右上内插图 为该传感器在不同的葡糖糖浓度下对催化电流的线性校正关系,对葡萄糖的检测浓度范围为 2.5×10-5~9.5×10-4mol/L, 线性相关系数r=0.995 0(n=27),检测限为1×10-5mol/L。
维持底液中葡糖糖浓度为2.5×10-5mol/L,考察了尿酸和抗坏血酸对测定葡糖糖的干扰情况(图8)。由图8可见,尿酸及抗坏血酸对葡糖糖的检测几乎没有干扰。
以相同方法制备的5支电极对同一浓度的葡萄糖进行检测,得到相对标准偏差(RSD)仅为1.15%,说明有很好的重现性。因为无酶传感器没有酶失活之类不利因素的存在,所以在保存上无需特殊处理。修饰电极对同一浓度葡糖糖 (0.2 mmol/L)连续测定50圈后的电流响应值仍保持原来的85%以上,电极有着很好的稳定性。
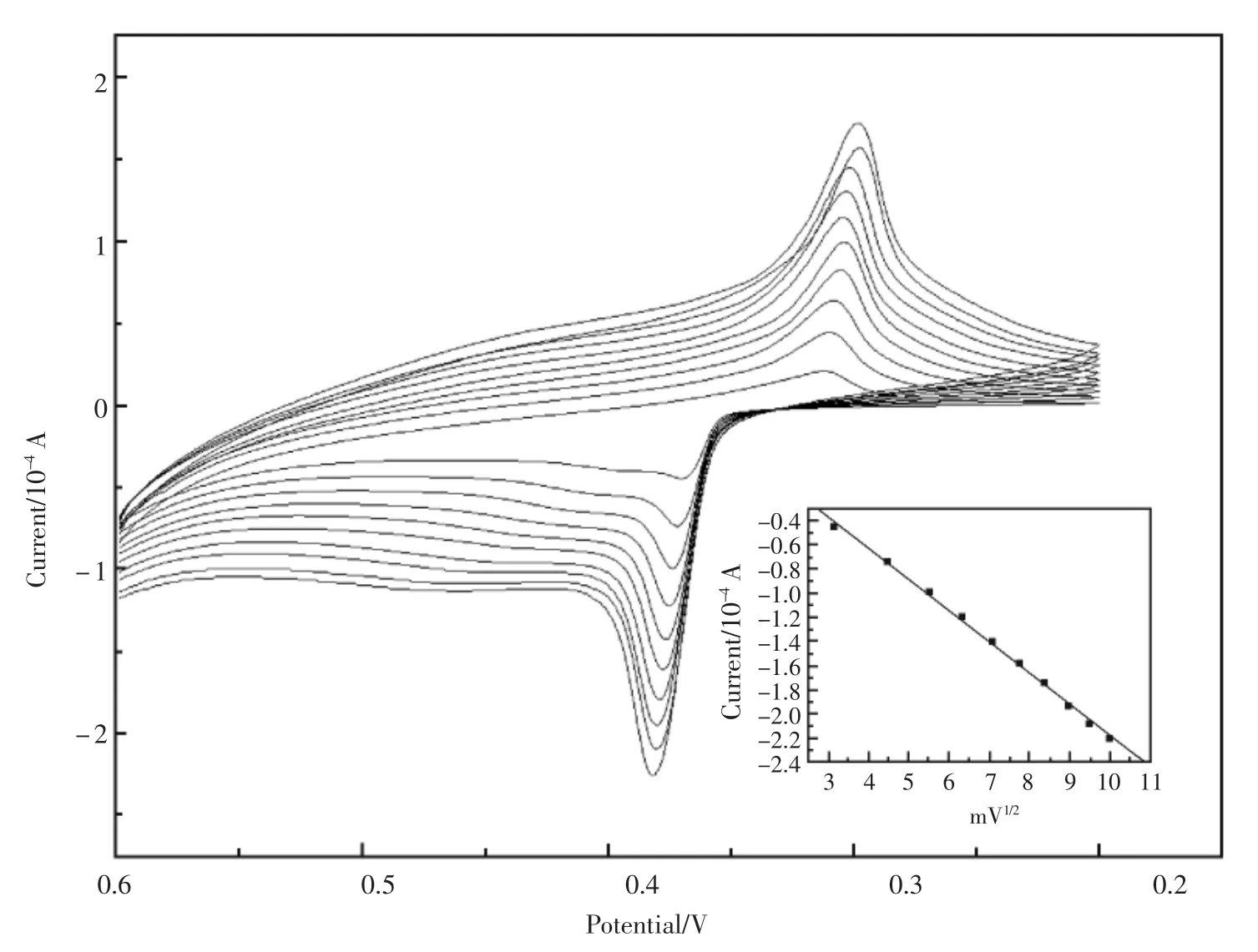
图6 修饰电极在不同扫速的循环伏安曲线扫描速度:10,20,30,40,50,60,70,80,90,100 mV/s(从内至外)内插图 :峰电流与扫速平方根的线性关系Fig.6 Effect of scan rate on the cyclic voltammogram of the modified electrode Inset:Calibration curve of the current and the square root of scan rates
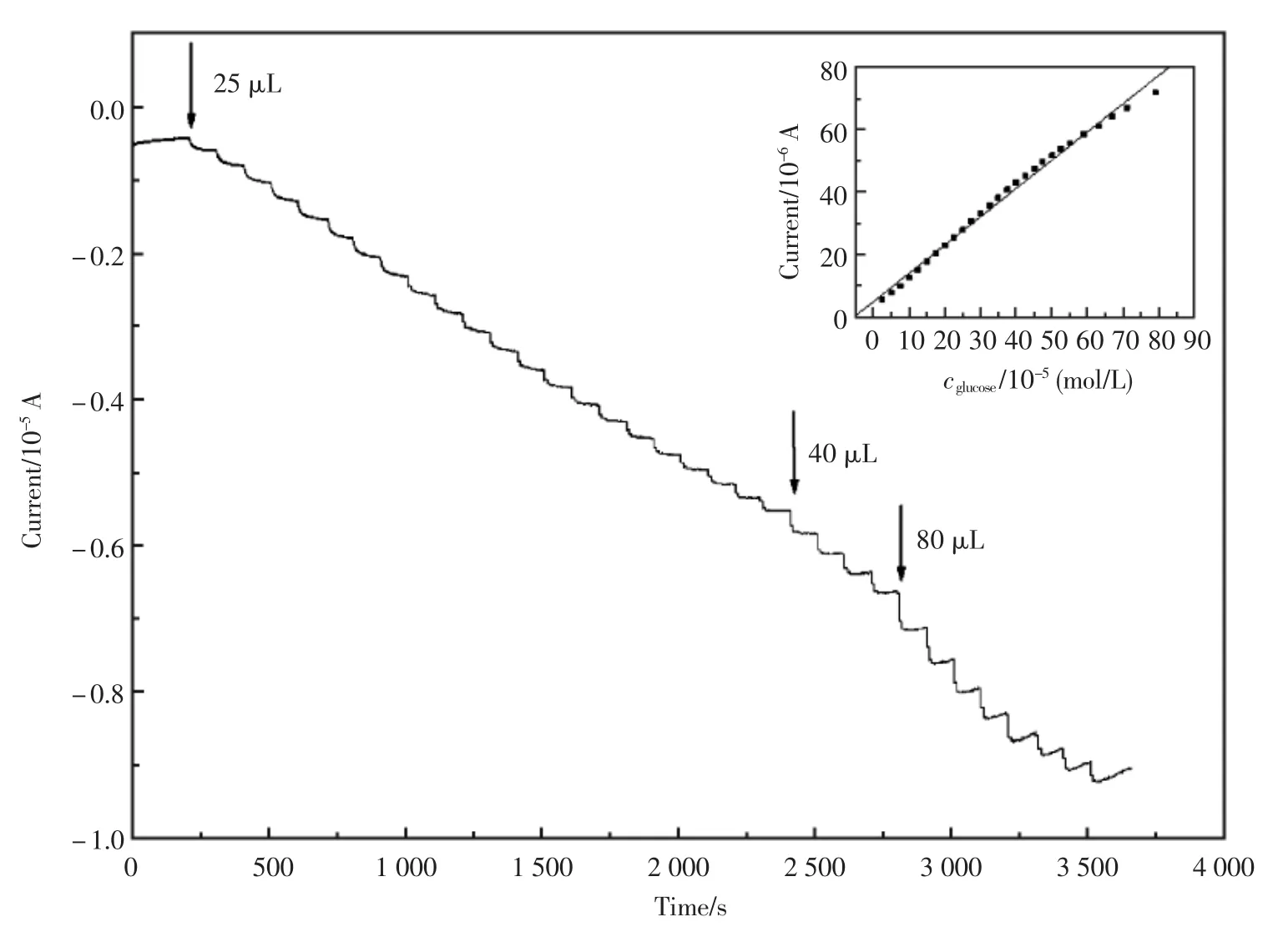
图7 修饰电极在0.2 mol/L NaOH溶液中连续加入不同量的10 mmol/L葡萄糖的计时电流响应;内插图 为浓度和电流的校正曲线Fig.7 Amperometric i-t curve of the modifies electrodes to the different concentration of glucose in 0.2 mol/L NaOH;inset:Calibration curve of the current and the concentration of glucose
2.6 回收率实验
取含未知浓度的葡萄糖水样进行检测,以上述方法进行测定,结果列入表1。同时在样品中分别加入50.0 μmol/L的葡糖糖溶液,测试回收率,结果也列在表1中,该方法测定得到的回收率在98.8%~105.1%,说明为检测葡萄糖提供了一个准确,方便可行的方法。

表1 回收率测定Tab.1 Determination of recovery
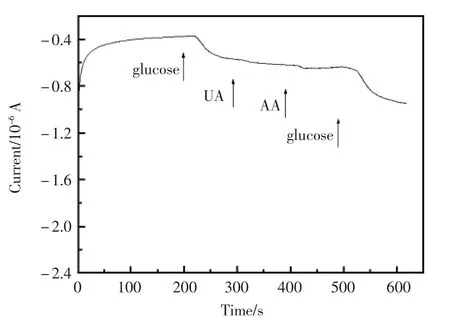
图8 修饰电极在0.2 mol/L NaOH中依次加入2.5×10-5 mol/L的葡萄糖,尿酸,抗坏血酸,葡萄糖的计时电流曲线Fig.8 Amperometric i-t curve of the modifies electrodes with injection of 2.5×10-5mol/L glucose,UA,AA,glucose
3 结论
借助壳聚糖粘合作用修饰了玻碳电极,利用Ni对葡萄糖的催化作用和金所具有的优越的电子传递性能,实现了对葡萄糖的检测。制备的{Au-Ni/Chits}/GCE传感器能对葡萄糖高灵敏的快速响应, 检测浓度范围为 2.5×10-5~9.5×10-4mol/L,线性相关系数为0.995 0,检测限可达到1×10-5mol/L。
[1]Chen H M,He J H,Zhang C B,et al.Self-assembly of novel mesoporous manganese oxide nanostructures and their application in oxidative decomposition of formaldehyde[J].Journal of Physical Chemistry C,2007,111(49):18 033~18 038.
[2]Cheng F Y,Zhao J Z,Song W,et al.Facile controlled synthesis of MnO2nanostructures of novel shapes and their application in batteries[J].InorgaNic Chemistry,2006,45(5):2 038~2 044.
[3]Murakami T,jima K,Miyawaki J,et al.Drug-loaded carbon nanohorns:adsorption and release of dexamethason in vitro[J].Molecular Pharmaceutics,2004,1(6):399~405.
[4]Diandra L,Leslie P.Magnetic Properties of nanostructured Materials[J].Chem.Mater.,1996, 8(8):1770~1783.
[5]Zhao C,Shao C,Li M, et al.Flow-injection analysis of glucose without enzyme based on electrocatalytic oxidation of glucose at a Nickel electrode[J].Talanta,2007,71(4):1 769~1 773.
[6]Morita M, Niwa O, Tou S,et al.Nickel content dependence of electrochemical behavior of carbohydrates on a titaNium-Nickel alloy electrode and its application to a liquid chromatography detector[J].Journal of Chromatography A,1999,8379(2):17~24.
[7]Fleischmann M,orinek K,Pletcher D.The oxidation of orgaNic compounds at a Nickel anode in alkaline solution[J].J.Electroanal.Chem,1971,31(1):39~49.
[8]Danaeea I, Jafariana M, Forouzandeha F, et al.Impedance spectroscopy analysis of glucose electro-oxidation on Ni-modified glassy carbon electrode[J].Electrochimica Acta,2008, 53(5):6 602~6 609.
[9]Lu L M,Zhang L,Qu F L,et al.A nano-Ni based ultrasensitive nonenzymatic electrochemical sensor for glucose:Enhancing sensitivity through a nanowire array strategy[J].Biosens.Bioelectron.,2009,25(1):218~223.
[10]Reis A,Houbaert Y,Xu Z, et al.Modeling of Shrinkage defects during Solidification of Long and Short Freezing Materials[J].Journal of Materials Processing Technology,2008, 202(2):428~434.
[11]Vijayaram T R, Sulaiman S,Hamouda A M S.Numeri-calSimulation ofCasting Solidification Inpermanent MetallicMolds[J].Journal of Materials Processing Technology, 2006, 178(4):29~33.
[12]Masyuki S.Invar alloys[J].Curr.Opin. Solid.State Mater.Sci.,1996,1(3):340~348.
[13]Sridharan K,Worzala F J,Dodd R A.Heat treatmentand microstructure of an Fe-Ni-Co invar alloystrengthened by intermetallic precipitation[J].Mater.Charact,1992,29(3):321~327.
[14]GuadagNiNi L, MignaNi A, Scavetta E, et al.Ni(OH)2versus Ni/Al layered double hydroxides as matrices to immobilize glucose oxidase[J].Electrochimica Acta,2010,55(2):1 217~1 220.
[15]Lua L M,Zhang L,Li F,et al.A nano-Ni based ultrasensitive nonenzymatic electrochemical sensor for glucose:Enhancing sensitivity through a nanowire array strategy[J].Biosens.Bioelectron.,2009,25(6):218~223.
[16]Yang J, Jiang L C, Zhang W D, et al.A highly sensitive non-enzymatic glucose sensor based on a simple twostep electrodeposition of cupric oxide (CuO)nanoparticles onto multi-walled carbon nanotube arrays[J].Talanta,2010,82(1):25~33.
[17]Zheng L,Zhang J Q,Song J F.Ni(Ⅱ)-quercetin complex modified multiwall carbon nanotube ioNic liquid paste electrode and its electrocatalytic activity toward the oxidation of glucose[J].Electrochimica Acta, 2009, 54(19):4 559~4 565.
[18]Wang L,Wang E K.Direct electron transfer between cytochrome c and a gold nanoparticles modified electrode[J].Electrochem.Commun,2004,6(1):49~54.
[19]Moeremans M,Daneels G,Mey J D.Sensitive colloidal metal(gold or silver)staiNing of protein blots on Nitrocellulose membranes[J].Anal.Biochem,1985,145(2):315~321.
[20]Meng S H,Tan Z C,Song Y J,et al.Characterization and thermodynamic study ofultra- ®neparticle of Ni±B amorphous alloy[J].Thermochimica Acta,1999,333(1): 179~181.
[21]Katz E,Willner I,Wang J.Electroanalytical and Bioelectroanalytical Systems Based on Metal and Semiconductor Nanoparticles[J].Electroanalysis,2004,16(1):19~23.
[22]Cheng Z L,Wang E K,Yang X R.Capacitive detection of glucose using molecularly imprinted polymers[J].Biosens.Bioelectron,2001,16(2):179~185.
[23]Guo R X,Chen W W,Hu X Y.Glucose sensor basing nafion/Ni-WCNTs modified GCE[J].Chemical Sensors,2007,27(1):28~35.
[24]Quintino M S M,WinNischofer H,Nakamura M,et al.Amperometric sensor for glucose based on electrochemically polymerized tetraruthenated Nickel porphyrin[J].Analytica Chimica Acta,2005,539(1):215~222.
[25]Salimi A,RoushaNi M.Non-enzymatic glucose detection free of ascorbic acid interference using Nickel powder and nafion sol-gel dispersed renewable carbon ceramicelectrode[J].Electrochem.Commun.,2005,7(9):879 ~887.
