新型肌松拮抗药舒更葡糖的临床研究进展Δ
2017-03-17重庆医科大学附属儿童医院麻醉科重庆400014
刘 佳,柏 林(重庆医科大学附属儿童医院麻醉科,重庆 400014)
新型肌松拮抗药舒更葡糖的临床研究进展Δ
刘 佳*,柏 林#(重庆医科大学附属儿童医院麻醉科,重庆 400014)
目的:了解舒更葡糖(Sugammadex)的临床研究进展。方法:查阅近年来国内外相关文献,就舒更葡糖的作用机制、药动学特点、临床应用、特殊人群应用和不良反应的研究进行归纳和总结。结果与结论:舒更葡糖通过与氨基甾体类肌松药在血浆中特异性地紧密结合成稳定螯合物的方式降低血浆肌松药浓度,使神经肌肉接头处肌松药不断顺浓度差转运至血浆,再通过肾脏排出体外,最终达到拮抗肌松的作用。目前的研究推荐舒更葡糖用于改善罗库溴铵(ROC)的严重过敏反应,帮助解决无法插管通气的临床问题,以及快速、安全、有效地逆转健康成人的ROC和维库溴铵不同程度的神经肌肉阻滞。舒更葡糖在特殊人群的应用方面,暂支持其用于2~18岁儿童、老年人、肥胖者及心、肺、肝、肾(除肾衰竭)、神经肌肉功能障碍患者,但缺乏大量的临床研究数据和循证医学证据。舒更葡糖在2岁以下患儿、孕妇和哺乳期妇女等的临床研究较少。舒更葡糖具有较好的耐受性和安全性,但临床应警惕其潜在的严重过敏反应、QTc间期延长、出血风险增加和神经毒性等。
舒更葡糖;肌松拮抗;神经肌肉功能障碍;罗库溴铵;维库溴铵舒更葡糖(Sugammadex)商品名为布瑞亭(Bridion),是新型氨基甾体类肌松药的特异性拮抗药,是麻醉药理学里程碑式的研究成果,于2008年获欧洲药品管理局(EMEA)、2015年12月获美国食品与药物管理局
(FDA)批准上市,用于逆转成人术中罗库溴铵(ROC)
和维库溴铵诱发的神经肌肉阻滞(NMB)。目前,舒更葡糖的作用机制和药动学特点明确,在健康成人中应用安全、有效,可帮助改善ROC的严重过敏反应,用于解决麻醉中无法插管通气的情况。近年来,舒更葡糖在各类特定人群中的临床研究以及相关的不良反应报道逐渐增多。鉴于此,笔者查阅近年来相关文献,就舒更葡糖的研究进行归纳和总结,以期为其临床合理应用提供参考。
1 作用机制及药动学特点
舒更葡糖为人工合成的γ-环糊精由8个葡萄糖分子围成的环状结构,其分子结构式见图1。舒更葡糖具有亲脂性内腔和亲水性外缘,其内腔大小适合氨基甾体类肌松药ROC。其通过8个从边缘突出的带负电荷的侧链羧基,增加其内部亲脂性和外缘亲水性,以1∶1的比例通过静电紧密结合ROC分子带正电荷的季铵离子,将其封装于环内,形成稳定的螯合物结构,进而有效减少游离肌松药的血药浓度,在效应室(神经肌肉接头处)和中央室(血浆)之间形成浓度梯度,使效应室的肌松药分子顺浓度梯度差迅速转运至中央室,使效应室的浓度迅速降低,从而减少肌松药与烟碱样受体结合,逆转肌松作用,且不受pH和温度影响[1]。
舒更葡糖对甾体非去极化肌松药ROC、维库溴铵、泮库溴铵都具有亲和力,对ROC的亲和力和选择性为维库溴铵的2.5倍,但对去极化肌松药琥珀胆碱、苄异喹啉类非甾体类肌松药(如顺式阿曲库铵、阿曲库铵和美库溴铵)无亲和力,因而对其无拮抗作用[2]。
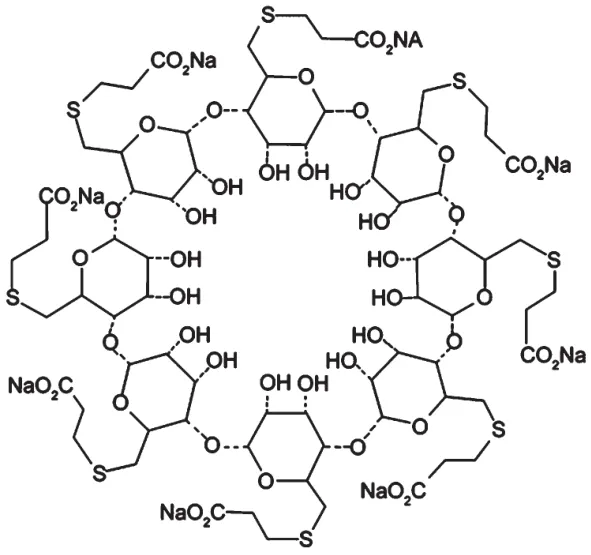
图1 舒更葡糖的分子结构式
舒更葡糖逆转肌松作用呈剂量依赖性,起效时间平均为3 min。舒更葡糖具有较好的水溶性,不与血浆蛋白结合,不透过血脑屏障和胎盘,主要以原型经肾脏、胆道排出。经放射性物质标志的舒更葡糖在6 h内约有70%排出体外,24 h内约有92%排出体外。舒更葡糖的血浆清除率约为75~120 mL/min,与肾小球滤过率相似,其消除半衰期约为100~150 min。给予轻、中度肾功能损伤患者舒更葡糖并不需要调整剂量,但不推荐用于重度肾功能损伤(肌酐清除率<30 mL/min)和需要透析的患者[3]。
2 临床应用
2.1 改善ROC的严重过敏反应
Reddy JI等[4]的研究显示,ROC所致严重的过敏反应发生率约为0.04%,女性多发(女性∶男性=4∶1),严重时可致心跳骤停。舒更葡糖能否改善ROC所致的过敏反应尚存在争议,争议焦点基于舒更葡糖可封装ROC致过敏的表位,从而抑制过敏反应进一步发生的假设。已有较多案例报道证明该假设可能性较大,且在动物模型中也证实其可减少肥大细胞脱颗粒[5]。但是,皮肤模型中的过敏反应被ROC激活后,舒更葡糖并不能完全阻止过敏反应进展[6]。目前,专家推荐在严重过敏反应中仍可考虑早期大剂量(16 mg/kg)使用舒更葡糖[7]。
2.2 改善无法插管通气的情况
麻醉医师推荐有反流误吸风险的患者选择快速序贯诱导插管(RSI)。氯化琥珀胆碱起效快且疗效好,为RSI的首选肌松药,但由于其副作用、禁忌证和自主呼吸恢复时间慢等缺点,不适用于无法插管通气的患者,有逐渐被舒更葡糖和ROC取代的趋势。Sørensen MK等[8]的研究发现,使用舒更葡糖(16 mg/kg)逆转高剂量ROC(1 mg/kg)肌松作用后,患者恢复自主呼吸的时间较氯化琥珀胆碱组(1 mg/kg)明显缩短(216 s vs.406 s,P<0.002),表明舒更葡糖和ROC组合能快速逆转患者无法插管通气的情况。但是,临床面对无法插管通气但却需要RSI的患者,麻醉诱导后肌松药、阿片类和镇静催眠类药物参与呼吸抑制,故舒更葡糖不一定能够完全逆转无法插管通气的情况,解决这一情况的主要办法还是保证气道开放、氧合和通气,药物只作为辅助干预措施[9]。
2.3 有效逆转中度和深度NMB
四个成串刺激(TOF)是用于评价神经肌肉阻滞深度的常用临床方法。当患者自发恢复或者术毕TOF中第2个肌颤搐(T2)的出现被认为是中度NMB,此时可予以新斯的明拮抗;当肌松程度较深时,常用强直刺激后单刺激计数(PTC)来反映阻滞深度,PTC1或PTC2常被认为是深度NMB,此时不能予以新斯的明拮抗。当恢复至TOF率(TOFR)0.9时,可认为肌力恢复。舒更葡糖逆转中度或深度肌松作用有效且安全。
2.3.1 逆转中度NMB Woo T等[10]的研究显示,在T2出现时予以舒更葡糖(2 mg/kg),仅在3 min内逆转ROC的中度NMB,比新斯的明快约8.1倍,且无肌松残余等不良反应。Khuenl-Brady KS等[11]的研究显示,予以舒更葡糖(2 mg/kg)也可在3 min内安全、有效地逆转维库溴铵的中度NMB,比新斯的明快约6.6倍,且无严重的不良反应。Tassonyi E等[12]的研究显示,舒更葡糖(2 mg/kg)逆转哌库溴铵的中度NMB的时间为(1.7±0.59)min,5 min内可以完全逆转,且无术后肌松残余等不良反应。由此说明,2 mg/kg的舒更葡糖在3 min内可安全、有效地逆转ROC、维库溴铵和哌库溴铵的中度NMB。
2.3.2 逆转深度NMB Rahe-Meyer N等[13]的研究表明,术毕PTC1~2时予以舒更葡糖(4 mg/kg)恢复至TOFR0.9的时间较自主恢复组快(2.2 min vs.89.8 min),且无残余肌松等不良反应。Geldner G等[14]的研究表明,PTC1~2时予以舒更葡糖(4 mg/kg)恢复至TOFR0.9的时间较新斯的明组(50 μg/kg)快(2.4 min vs.8.4 min),且94%的舒更葡糖组患者在5 min内恢复至TOFR0.9。Lemmens HJ等[15]的研究表明,术毕PTC1~2时给予舒更葡糖(4 mg/kg)恢复至TOFR0.9的时间较新斯的明组(70 μg/kg)快(4.5 min vs.66.2 min),且无严重的不良反应发生。由此说明,4 mg/kg的舒更葡糖在5 min内可安全、有效地逆转ROC和维库溴铵的深度NMB。
上述研究表明,舒更葡糖可安全、有效地逆转成人术中ROC和维库溴铵导致的NMB,静脉注射2 mg/kg时可在3 min内逆转患者自发恢复或者术毕TOF中出现T2的NMB;静脉注射4 mg/kg则可在5 min内逆转患者自发恢复已到达或者至少达到PTC1~2的NMB。
3 特殊人群的应用
3.1 儿童
不同年龄的儿童对肌松药作用、恢复时间和程度呈现高变异性。EMEA批准2~17岁的患儿可使用舒更葡糖,FDA尚未推荐用于患儿,国际循证医学协作组织支持舒更葡糖2~4 mg/kg用于逆转2~18岁患儿中ROC导致的中度NMB[16]。麻醉医师可进行肌松监测来保证舒更葡糖在患儿中的安全应用。目前,尚无2岁以下患儿的舒更葡糖临床试验开展,仅见于病例报道[17]。
3.2 老年人
老年人(年龄≥65岁)心输出量减少,血液循环减慢,肌肉血流减少,肌松药起效时间延长,舒更葡糖达到有效血药浓度速度较慢,年龄≥75岁老年人较18~64岁成人的清除率降低约50%,肌松恢复时间会延长2~4 min。临床认为舒更葡糖在年龄≥65岁患者与18~64岁患者中的使用方法相似。但Shin S等[18]的研究发现快速逆转(2 min内)年龄≥65岁患者使用ROC导致的深度NMB时,比18~64岁患者使用的舒更葡糖剂量高(4.2 mg/kg vs.3.3 mg/kg,P<0.001)。Yazar E等[19]进一步研究发现,舒更葡糖在年龄≥75岁患者体内的作用时间较65~74岁患者延长(3.27 min vs.5.50 min,P<0.001),这一延长时间在临床接受范围内。由此可见,老年患者使用舒更葡糖恢复肌力的时间会延长,若需要更快速逆转老年患者的肌松作用,则可能需要增加使用剂量。
3.3 肥胖者
肥胖患者使用舒更葡糖时一般不需要调整剂量,但病态肥胖患者[体质量指数(BMI)>30 kg/m2]的使用剂量尚未明确。舒更葡糖进入机体后主要分布于细胞外液,较少受脂肪容积影响,故认为其使用剂量应少于按照总体质量(TBW)计算的理论使用剂量。但研究发现,按标准体质量(IBW)使用舒更葡糖(2 mg/kg)并不能在2 min内逆转病态肥胖患者ROC的中度NMB,使用4 mg/kg也不能在3 min内逆转ROC的深度NMB,但两者均可在10 min内完成安全逆转[20]。由此说明肥胖患者若要快速逆转NMB,可能需要更大剂量的舒更葡糖。Badaoui R等[21]的研究发现,若在4 mg/kg的剂量基础上增加35%~50%,即按5.4~6.0 mg/kg的剂量给药,则能快速逆转肥胖患者ROC的深度NMB,平均时间为(123±60)s,且无术后肌松残余等不良反应。Carron M等[22]比较给予病态肥胖患者舒更葡糖和新斯的明拮抗ROC深度NMB时发现,舒更葡糖(4 mg/kg)比新斯的明恢复时间更短(3.1 min vs.48.6 min,P<0.000 1),且无不良反应发生。
3.4 孕妇和哺乳期妇女
目前,舒更葡糖在孕妇中的使用尚未见相关临床报道。动物实验未发现舒更葡糖影响胎鼠发育的证据,但舒更葡糖会随母鼠乳汁排泄,是否会随人乳排泄尚不明确[23]。Mirakhur RK[24]的研究认为,舒更葡糖口服吸收率低,可能对胎儿无影响,哺乳期妇女使用安全,而认为舒更葡糖会降低孕激素避孕药的有效性。但动物实验显示喂食孕鼠舒更葡糖后其孕酮水平并未受影响[23]。
3.5 脏器功能障碍患者
3.5.1 心功能障碍患者 心输出量减少是心功能不全患者肌力恢复时间延长的主要原因。Dahl V等[25]的研究表明,舒更葡糖2 mg/kg或4 mg/kg两种剂量均可以在2 min内安全、有效地逆转纽约心脏病协会心力衰竭分级(NYHA)Ⅳ~Ⅳ级的非心脏手术患者的ROC的中度NMB。Kizilay D等[26]进一步研究表明,舒更葡糖(3 mg/kg)较新斯的明(0.03 mg/kg)能更快速有效地逆转NYHAⅣ~Ⅳ级非心脏手术患者的ROC的中度NMB,且血流动力学指标稳定。由此可见,舒更葡糖在心脏病患者的非心脏手术中使用安全、有效,但仍需更多试验的进一步证实,这对于心脏病患者的复苏和快通道麻醉研究有一定意义。
3.5.2 肺功能障碍患者 肺疾病患者全身麻醉术后出现支气管痉挛、低氧血症、肺炎、肺不张等风险较其他患者明显更高。肌松残余可增加呼吸系统并发症的发生,常规肌松拮抗药新斯的明联用阿托品也不能完全可靠地消除心动过缓、支气管痉挛、分泌物增加等不良反应。Amao R等[27]的研究表明,T2出现时予以舒更葡糖2 mg/kg或4 mg/kg能在2 min内有效逆转哮喘、慢性支气管炎、慢性阻塞性肺疾病等全身麻醉患者的ROC的NMB,且支气管痉挛发生率低,患者普遍耐受,但类似临床研究较少。
3.5.3 肝功能障碍患者 ROC主要以原型排泄至胆汁,故肝功能障碍或行肝脏手术的患者应用舒更葡糖的有效性及安全性值得考虑。Fujita A等[28]的研究纳入美国麻醉师协会术前患者体质及手术危险性分级(ASA)为Ⅳ~Ⅳ级的全麻患者,使用ROC诱导和持续输注至术毕,术毕T2出现时予以舒更葡糖2 mg/kg,若术毕15 min内T2仍未出现,立即给予舒更葡糖4 mg/kg拮抗。结果显示,给予2 mg/kg时肝功能障碍患者和肝功能正常患者的平均恢复时间分别为2.2、2.0 min(P=0.44),给予4 mg/kg时肝功能障碍患者和肝功能正常患者的平均恢复时间分别为1.9、1.7 min(P=0.70),且均无舒更葡糖相关严重的不良反应发生。可见舒更葡糖应用于肝功能障碍患者安全、有效,但该结论仍需更多的临床数据加以支持。
3.5.4 肾功能障碍患者 慢性肾衰竭患者(肌酐清除率<30 mL/min)对舒更葡糖的代谢较慢,高流量的血液透析可以清除舒更葡糖及其和ROC的复合物[29]。Staals LM等[30]的研究表明,舒更葡糖(2 mg/kg)可在2 min内安全、有效地逆转肾衰竭患者的ROC的中度NMB;舒更葡糖(4 mg/kg)逆转肾衰竭患者ROC的深度NMB恢复TOFR0.9的时间较非肾衰竭患者明显延长(5.6 min vs. 2.7 min,P=0.003)[31],均未发生肌松残余等不良反应。但Kip G等[32]的动物实验表明,高剂量的舒更葡糖(96 mg/kg)会导致糖尿病模型鼠明显的肾组织损伤,故需要更多研究验证其在肾衰竭患者应用中的安全性。由于缺乏大量舒更葡糖在肾衰竭患者中的药动学数据,故目前暂不推荐其用于肌酐清除率<30 mL/min或者需要透析的患者。
3.5.5 神经肌肉功能障碍患者 神经肌肉功能障碍患者对肌松药的敏感性会发生改变。Vymazal T等[33]的研究纳入117例术毕使用舒更葡糖(4 mg/kg)逆转ROC的NMB全身麻醉重症肌无力(MG)患者,发现肌力恢复时间为105~127 s,且无术后肌松残余和呼吸抑制等不良反应,表明舒更葡糖4 mg/kg的剂量逆转MG患者的ROC的NMB是快速、安全的。此外,舒更葡糖能快速恢复罕见的神经肌肉疾病(如强直性肌营养不良、皮肌炎和杜氏肌营养不良等)的肌力至术前状态,但仍需大量的临床试验加以证实。
4 不良反应
舒更葡糖最常见的不良反应为肌肉功能快速恢复致患者在浅麻醉状态下出现呛咳、体动、表情痛苦和吞咽动作,发生率在2%以上[34]。舒更葡糖潜在的不良反应包括过敏反应、QTc间期延长和出血风险增加等。Takazawa T等[35]的研究显示,舒更葡糖的过敏反应发生率为0.002 9%,多发生在使用后5 min内,大多轻微有自限性,有舒更葡糖过敏史或对其成分过敏的患者应作为其禁忌证。舒更葡糖虽可致QTc间期延长,引起心动过缓,甚至心脏停搏,但多发生在具有严重疾病或重大手术潜在风险的患者中,故应该注意患者血流动力学的变化,必要时使用抗胆碱能药物。舒更葡糖的使用剂量与QTc间期延长之间无明显的相关性[36],且已有QTc间期延长的患者并不会加剧这种延长[37]。舒更葡糖是否增加出血风险尚存在争议,但考虑其在术毕使用,止血已在术中完成,可能与降低出血风险存在相关性[38]。近年,有研究报道舒更葡糖可引起线粒体依赖的神经细胞凋亡,如不慎注入蛛网膜下腔,则可能发生严重后果[39],但暂无相关病例报道。
5 结语
舒更葡糖通过与氨基甾体类肌松药在血浆中特异性地紧密结合成稳定螯合物的方式降低血浆肌松药浓度,使神经肌肉接头处肌松药不断顺浓度差转运至血浆,螯合物通过肾脏排出体外,最终达到拮抗肌松的作用。目前的研究推荐舒更葡糖用于改善ROC的严重过敏反应,帮助解决无法插管通气的临床问题,以及快速、安全、有效地逆转健康成人的ROC和维库溴铵不同程度的NMB。舒更葡糖在特殊人群的应用方面,暂支持其用于2~18岁的儿童和青少年、老年人、肥胖者及心、肺、肝、肾(除肾衰竭)、神经肌肉功能障碍患者,但缺乏大量的临床研究数据和循证医学证据。舒更葡糖在2岁以下患儿、孕妇和哺乳期妇女等的临床研究较少。舒更葡糖具有较好的耐受性和安全性,但临床应警惕其潜在的严重过敏反应、QTc间期延长、出血风险增加和神经毒性等。笔者相信,随着对舒更葡糖研究的深入,肌松拮抗、临床麻醉和急救复苏会更加安全、有效。
[1] Schaller SJ,Lewald H.Clinical pharmacology and efficacy of sugammadex in the reversal of neuromuscular blockade[J].Expert Opin Drug Metab Toxicol,2016,12(9):1097-1108.
[2] Akha AS,Rosa J,Jahr JS,et al.Sugammadex:cyclodextrins,development of selective binding agents,pharmacology,clinical development,and future directions[J].Anesthesiol Clin,2010,28(4):691-708.
[3] Panhuizen IF,Gold SJ,Buerkle C,et al.Efficacy,safety and pharmacokinetics of sugammadex 4 mg/kg for reversal of deep neuromuscular blockade in patients with severe renal impairment[J].Br J Anaesth,2015,114(5):777-784.
[4] Reddy JI,Cooke PJ,van Schalkwyk JM,et al.Anaphylaxis is more common with rocuronium and succinylcholine than with atracurium[J].Anesthesiology,2015,122(1):39-45.
[5] Tomak Y,Yılmaz,Bostan H,et al.Effects of sugammadex and rocuronium mast cell number and degranulation in rat liver[J].Anaesthesia,2012,67(10):1101-1104.
[6] Clarke RC,Sadleir PH,Platt PR.The role of sugammadex in the development and modification of an allergic response to rocuronium:evidence from a cutaneous model [J].Anaesthesia,2012,67(3):266-273.
[7] Barthel F,Stojeba N,Lyons G,et al.Sugammadex in rocuronium anaphylaxis:dose matters[J].Br J Anaesth,2012,109(4):646-647.
[8] Sørensen MK,Bretlau C,Gätke MR,et al.Rapid sequence induction and intubation with rocuronium-sugammadex compared with succinylcholine:a randomized trial[J]. Br J Anaesth,2012,108(4):682-689.
[9] Naguib M,Brewer L,LaPierre C,et al.The myth of rescue reversal in“Can’t Intubate,Can’t Ventilate”scenarios[J].Anesth Analg,2016,123(1):82-92.
[10] Woo T,Kim KS,Shim YH,et al.Sugammadex versus neostigmine reversal of moderate rocuronium-induced neuromuscular blockade in Korean patients[J].Korean J Anesthesiol,2013,65(6):501-507.
[11] Khuenl-Brady KS,Wattwil M,Vanacker BF,et al.Sugammadex provides faster reversal of vecuronium-induced neuromuscular blockade compared with neostigmine:a multicenter,randomized,controlled trial[J]. Anesth Analg,2010,110(1):64-73.
[12] Tassonyi E,Pongrácz A,Nemes R,et al.Reversal of pipecuronium-induced moderate neuromuscular block with sugammadex in the presence of a sevoflurane anesthetic:a randomized trial[J].Anesth Analg,2015,121(2):373-380.
[13] Rahe-Meyer N,Berger C,Wittmann M,et al.Recovery from prolonged deep rocuronium-induced neuromuscular blockade:a randomized comparison of sugammadex reversal with spontaneous recovery[J].Anaesthesist,2015,64(7):506-512.
[14] Geldner G,Niskanen M,Laurila P,et al.A randomised controlled trial comparing sugammadex and neostigmine at different depths of neuromuscular blockade in patients undergoing laparoscopic surgery[J].Anaesthesia,2012,67(9):991-998.
[15] Lemmens HJ,El-Orbany MI,Berry J,et al.Reversal of profound vecuronium-induced neuromuscular block under sevoflurane anesthesia:sugammadex versus neostigmine [J].BMC Anesthesiol,2010,doi:10.1166/147-2253-10-15.
[16] Won YJ,Lim BG,Lee DK,et al.Sugammadex for reversal of rocuronium-induced neuromuscular blockade in pediatric patients:a systematic review and meta-analysis[J]. Medicine:Baltimore,2016,95(34):e4678.
[17] Azizoglu M,Birbicer H,Memis S,et al.Reversal of profound neuromuscular blockade with sugammadex in an infant after bronchial foreign body removal[J].J Clin Anesth,2016,33:315-316.
[18] Shin S,Han DW,Lee HS,et al.Elderly patients require higher doses of sugammadex for rapid recovery from deep neuromuscular block[J].Basic Clin Pharmacol Toxicol,2016,118(6):462-467.
[19] Yazar E,Yılmaz,Bilgin H,et al.A Comparision of the effect of sugammadex on the recovery period and postoperative residual block in young elderly and middle-aged elderly patients[J].Balkan Med J,2016,33(2):181-187.
[20] Loupec T,Frascal D,Rousseau N,et al.Appropriate dosing of sugammadex to reverse deep rocuronium:induced neuromuscular blockade in morbidly obese patients[J].Anaesthesia,2016,71(3):265-272.
[21] Badaoui R,Cabaret A,Alami Y,et al.Reversal of neuromuscular blockade by sugammadex in laparoscopic bariatric surgery:in support of dose reduction[J].Anaesth Crit Care Pain Med,2016,35(1):25-29.
[22] Carron M,Veronese S,Foletto M,et al.Sugammadex allows fast:track bariatric surgery[J].Obes Surg,2013,23(10):1558-1563.
[23] Et T,Topal A,Erol A,et al.The effects of sugammadex on progesterone levels in pregnant rats[J].Balkan Med J,2015,32(2):203-207.
[24] Mirakhur RK.Sugammadex in clinical practice[J].Anaesthesia,2009,64(Suppl 1):45-54.
[25] Dahl V,Pendeville PE,Hollmann MW,et al.Safety and efficacy of sugammadex for the reversal of rocuronium:induced neuromuscular blockade in cardiac patients undergoing noncardiac surgery[J].Eur J Anaesthesiol,2009,26(10):874-884.
[26] Kizilay D,Dal D,Saracoglu KT,et al.Comparison of neostigmine and sugammadex for hemodynamic parameters in cardiac patients undergoing noncardiac surgery[J]. J Clin Anesth,2016,28:30-35.
[27]Amao R,Zornow MH,Cowan RM,et al.Use of sugammadex in patients with a history of pulmonary disease[J]. J Clin Anesth,2012,24(4):289-297.
[28] Fujita A,Ishibe N,Yoshihara T,et al.Rapid reversal of neuromuscular blockade by sugammadex after continuous infusion of rocuronium in patients with liver dysfunction undergoing hepatic surgery[J].Acta Anaesthesiol Taiwan,2014,52(2):54-58.
[29] Cammu G,Van Vlem B,van den Heuvel M,et al.Dialysability of sugammadex and its complex with rocuronium in intensive care patients with severe renal impairment[J]. Br J Anaesth,2012,109(3):382-390.
[30] Staals LM,Snoeck MM,Driessen JJ,et al.Reduced clearance of rocuronium and sugammadex in patients with severe to end-stage renal failure:a pharmacokinetic study [J].Br J Anaesth,2010,104(1):31-39.
[31] de Souza CM,Tardelli MA,Tedesco H,et al.Efficacy and safety of sugammadex in the reversal of deep neuromuscular blockade induced by rocuronium in patients with end-stage renal disease:a comparative prospective clinical trial[J].Eur J Anaesthesiol,2015,32(10):681-686.
[32] Kip G,Turgut HC,Alkan M,et al.The effects of low and high doses of sugammadex on kidney tissue in streptozotocin:induced diabetic rats[J].Bratisl Lek Listy,2015,116(12):746-750.
[33] Vymazal T,Krecmerova M,Bicek V,et al.Feasibility of full and rapid neuromuscular blockade recovery with sugammadex in myasthenia gravis patients undergoing surgery:a series of 117 cases[J].Ther Clin Risk Manag,2015,11:1593-1596.
[34] Schaller SJ,Fink H.Sugammadex as a reversal agent for neuromuscular block:an evidence-based review[J].Core Evid,2013,8:57-67.
[35] Takazawa T,Mitsuhata H,Mertes PM.Sugammadex and rocuronium-induced anaphylaxis[J].J Anesth,2016,30(2):290-297.
[36] de Kam PJ,van Kuijk J,Prohn M,et al.Effects of sugammadex doses up to 32 mg/kg alone or in combination with rocuronium or vecuronium on QTc prolongation:a thorough QTc study[J].Clin Drug Investig,2010,30(9):599-611.
[37] de Kam PJ,Grobara P,Dennie J,et al.Effect of sugammadex on QT/QTc interval prolongation when combined with QTc-prolonging sevoflurane or propofol anaesthesia [J].Clin Drug Investig,2013,33(8):545-551.
[38] Carron M.Bleeding risk in surgical patients receiving sugammadex:definitive conclusions are not yet possible[J]. Anesthesiology,2015,123(5):1212.
[39] Kim YH.Sugammadex:watch out for new side effects[J]. Korean J Anesthesiol,2016,69(5):427-428.
R971
A
1001-0408(2017)05-0702-05
2016-10-07
2016-12-30)
(编辑:陶婷婷)
国家临床重点专科建设项目
*住院医师,硕士研究生。研究方向:小儿麻醉。电话:023-63622143。E-mail:779586404@qq.com
#通信作者:副主任医师,副教授,硕士。研究方向:小儿麻醉与疼痛治疗。电话:023-63622143。E-mail:1455973437@qq.com
DOI10.6039/j.issn.1001-0408.2017.05.35
